mTORC1抑制剂影响谷氨酰胺代谢抑制人胰腺神经内分泌肿瘤细胞增殖*
2015-06-01熊双龙龚玉竹谢赣丰梁后杰
熊双龙,龚玉竹,谢赣丰,李 妮,梁后杰
(第三军医大学西南医院肿瘤科,重庆 400038)
论著·基础研究
mTORC1抑制剂影响谷氨酰胺代谢抑制人胰腺神经内分泌肿瘤细胞增殖*
熊双龙,龚玉竹,谢赣丰,李 妮,梁后杰△
(第三军医大学西南医院肿瘤科,重庆 400038)
目的 体外研究雷帕霉素靶蛋白复合物1(mTORC1)抑制剂对人胰腺神经内分泌肿瘤(pNET)细胞株BON增殖的影响,探讨谷氨酰胺(Gln)代谢在mTORC1抑制剂影响BON细胞增殖中的作用。方法 体外培养人胰腺神经内分泌肿瘤细胞BON,分别用1、5、10、25、50、100 nM的雷帕霉素处理后,应用CCK-8检测BON的生长抑制率。用100 nM雷帕霉素处理BON细胞12 h后,检测其对Gln的吸收水平。在无葡萄糖(Glc)和(或)无谷氨酰胺(Gln)的情况下,应用CCK-8检测BON的增殖情况以及流式细胞术检测细胞周期情况。结果 雷帕霉素可明显抑制BON细胞的增殖,抑制率呈时间-浓度依赖性(P<0.05)。同时雷帕霉素影响BON对Gln的吸收,而BON明显依赖于Gln生长,Glc-/Gln+组、Glc-/Gln-组、Glc+/Gln-组生长速率较Glc+/Gln+组差异有统计学意义(P<0.05)。结论 mTORC1抑制剂可能通过影响Gln代谢抑制BON细胞的增殖。
细胞增殖;谷氨酰胺代谢;mTORC1抑制剂;胰腺神经内分泌肿瘤
细胞生长和凋亡的失衡在肿瘤的发生、发展中扮演关键角色,而哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是参与其中重要的信号分子。mTOR在真核生物体以两种复合物的形式存在,即雷帕霉素靶蛋白复合物1(mTORC1)及mTORC2,研究证实mTORC1 特异性抑制剂可显著抑制肿瘤细胞增殖并促进细胞凋亡,表现出显著的临床疗效[1]。近年来相关研究表明mTORC1的激活和营养物的代谢相关。细胞代谢异常是恶性肿瘤重要的特征,肿瘤在其发生、发展过程中常伴随着代谢途径的重塑[2]。既往对肿瘤代谢的研究主要集中于葡萄糖(Glc)代谢,临床上正电子发射计算机断层显像(PET-CT)检查也正是根据肿瘤细胞高糖酵解这一特点得以实现[3]。但不是所有恶性肿瘤PET 显像都呈阳性,例如近50%的胰腺神经内分泌癌PET-CT 检查表现为阴性[4-5],所以并非所有的肿瘤细胞都表现为糖酵解增强,而是主要依赖于其他代谢方式。例如有研究报导乳腺癌细胞株 MDA-MB-453 及宫颈癌细胞株 Hela 都是以谷氨酰胺(Gln)代谢为主[6],并发现谷氨酰胺剥夺后可以引起人肝癌细胞株Hep3B、人骨肉瘤细胞株(143B 和143B206)和人乳腺癌细胞株MCF7 生长停滞[7]。为此作者推测,mTORC1抑制剂在某些特殊肿瘤中,如神经内分泌肿瘤,可能主要是通过影响Gln代谢途径而抑制细胞增殖。本研究检测了mTORC1抑制剂能够抑制BON细胞的增殖,并且影响Gln代谢途径。这为胰腺神经内分泌肿瘤(pancreatic endocrine tumor,pNET)的治疗提供了新的思路。
1 材料与方法
1.1 试剂与材料 BON细胞株由意大利Verona 大学Scarpa 实验室馈赠,由本实验室传代保种。胎牛血清、DMEM/F12培养基购自Gibco公司;DMEM粉末、谷氨酰胺、葡萄糖、酚红、DMSO购自Sigma公司;CCK-8试剂购自日本同仁公司;雷帕霉素购自大连美仑公司;细胞周期检测试剂盒购自贝博公司。
1.2 细胞培养 人PNET细胞系BON培养于含10%胎牛血清和20 mM Gln(Sigma,美国)的DMEM/F12培养基中,置于37 ℃、5% CO2无菌恒温培养箱中培养,常规培养传代。
1.3 雷帕霉素对BON细胞增殖能力的影响 CCK-8检测细胞增殖抑制率:取对数生长期的BON细胞制成5×104/mL培养基,以5 000个/孔铺入96孔板,每组3个复孔。培养24 h后,加入含雷帕霉素的培养液100 μL,用DMSO溶解使终浓度分别为1、5、10、25、50、100 nM,分别于12、24 h后吸掉原培养基,每孔加入100 μL DMEM/F12完全培养基和10 μL CCK-8溶液,再培养2 h后置酶标仪上检测450 nm处的吸光度值。
1.4 液闪仪检测L-[2,3,4-3H]-Gln吸收水平 取对数生长期的BON细胞消化后调整细胞密度为1×106/mL,以100 μL/孔铺入96孔板,贴壁后换成无Gln的培养基,并用浓度为100 nM的雷帕霉素处理BON细胞12 h后设为用药组,另设加等量DMSO的为对照组,培养结束前10 min加入4 mM L-[2,3,4-3H]-Gln,培养结束后用胰酶消化细胞至细胞成球形,收集细胞至玻璃纤维滤纸上,置于闪烁液中,液闪仪测定。
1.5 CCK-8检测Glc和Gln对BON细胞增殖速率的影响 取对数生长期的BON细胞,以3 000个/孔铺入96孔板,每组3个复孔,设空白对照孔。配置条件培养基:将无Glc(Glc-)、无Gln(Gln-)的DMEM粉末(Sigma,美国)加1 L超纯水、2.0 g碳酸氢钠、9.3 mg酚红混匀置成空白培养基,再分别备制为:(1)空白培养基+25 mM Glc+4 mM Gln(对应培养的细胞为Glc+/Gln+组)、(2)空白培养基+4 mM Gln(Glc-/Gln+组)、(3)空白培养基+25 mM Glc(Glc+/Gln-组)、(4)空白培养基(Glc-/Gln-组),过滤后制成含10%胎牛血清的4组条件培养基,6 h细胞贴壁后,吸掉原培养基,每孔加入100 μL DMEM/F12完全培养基和10 μL CCK-8溶液,培养2 h后置酶标仪上检测450 nm处的吸光度值。剩余每孔条件处理细胞后连续检测6 d。
1.6 Glc和Gln对BON细胞细胞周期的影响 将1×105个细胞接种于六孔板中,贴壁后分别用(1)空白培养基+25 mM Glc+4 mM Gln;(2)空白培养基+4 mM Gln;(3)空白培养基+25 mM Glc;(4)空白培养基,条件培养基处理BON细胞24 h,收集细胞后流式细胞仪检测细胞周期情况。
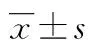
2 结果
2.1 雷帕霉素对BON细胞增殖的影响 CCK-8结果显示雷帕霉素可明显抑制BON细胞的增殖,不同浓度用药组不同处理时间之间生长抑制率差异有统计学意义(P<0.05)。抑制率呈时间-浓度依赖性。见图1。
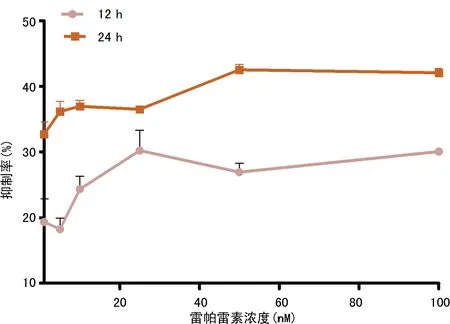
图1 不同浓度雷帕霉素作用12、24 h后BON生长抑制率检测
2.2 雷帕霉素对BON细胞吸收Gln的影响 100 nM的雷帕霉素处理BON细胞12 h后,BON对吸收Gln的能力明显下降,用药组和对照组差异有统计学意义(P<0.05),见图2。

图2 雷帕霉素作用BON影响BON对谷氨酰胺的吸收
2.3 Glc和Gln对BON细胞增殖的影响 BON细胞在无Gln的情况下完全不能存活,在无Glc的情况下生长明显减慢(P<0.05),说明BON细胞更依赖于Gln生长,见图3。

图3 Glc和Gln对BON细胞增殖的影响
2.4 Glc和(或)Gln对BON细胞周期的影响 相对于Glc+/Gln-组、Glc-/Gln+组细胞周期阻滞更明显,表现为G1期细胞数量增多,S期细胞比例下降。见图4。
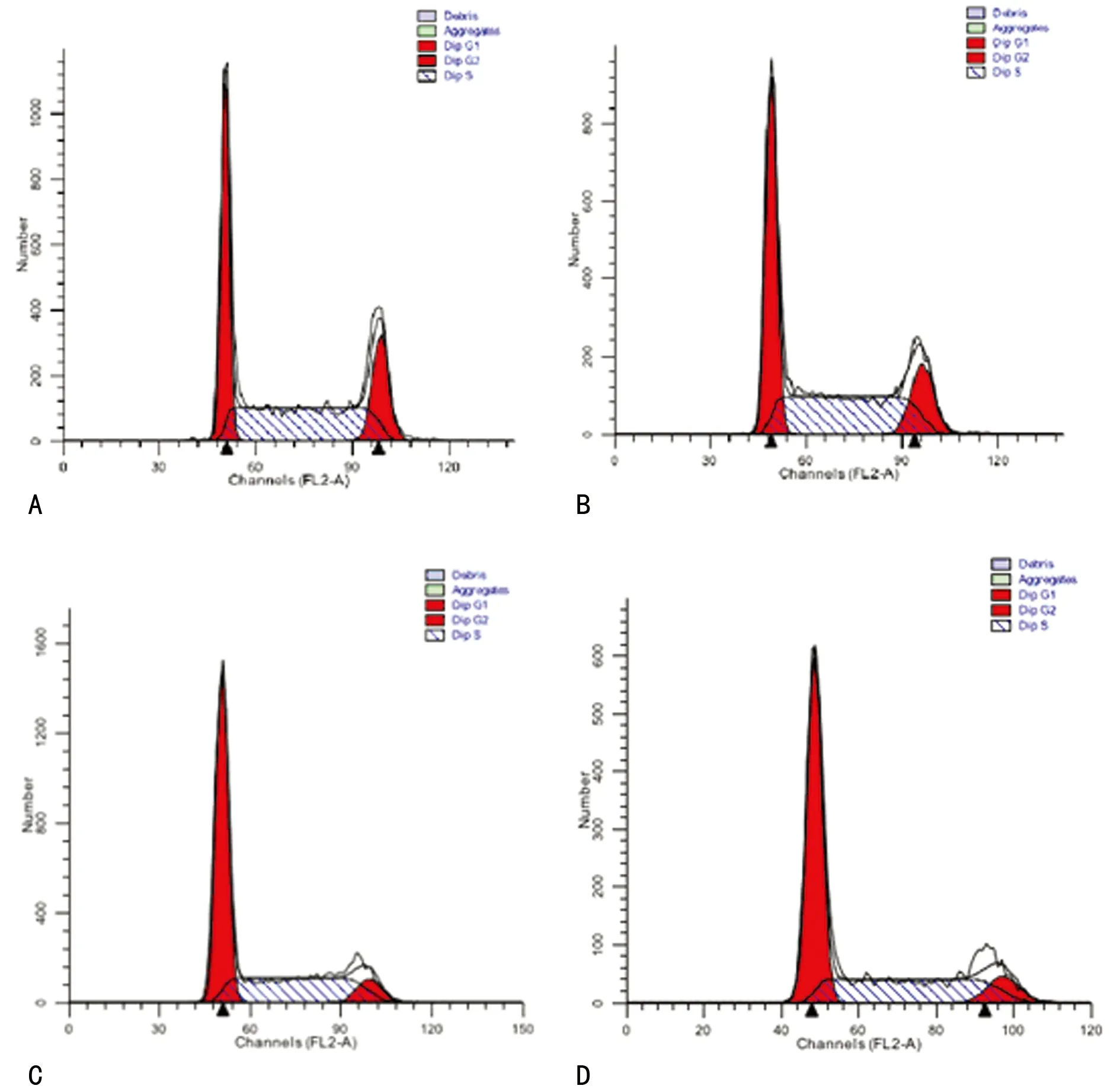
A:Glc+/Gln+组;B:Glc-/Gln+组;C:Glc+/Gln-组;D:Glc-/Gln-组。
图4 Glc和Gln对BON细胞周期的影响
3 讨论
pNET是一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤,人群发病率约在1/10~4/10万,可发生于任何年龄,近年来呈稳步上升趋势[8]。PNET的诊断与治疗近年来取得了快速的发展,分子靶向治疗致力于控制pNET细胞生长和在血管生成的重要信号通路中寻找治疗靶点。目前最受关注的为血管内皮生长因子(VEGF)受体信号通路以及哺乳动物雷帕霉素靶蛋白(mTOR)。PI3K/Akt/mTOR受体信号通路在pNET肿瘤细胞的生长、增殖、代谢和血管生成中发挥了重要作用。依维莫司(Everolimus)作为一种新型的口服 mTORC1抑制剂,早在2011 年就被美国FDA 批准用于治疗不可手术切除或已经扩散到身体其他部位的晚期pNET。尽管大部分的pNET 包含PI3K/Akt 过度表达以及pTEN、TSC1/2、LKB1 缺失导致mTORC1的异常激活[9],但实际上pNET 患者对依维莫司治疗的反应不一。
哺乳动物mTORC1受营养、能量信号的调控而且对雷帕霉素敏感。现在很多研究显示,mTORC1 信号通路的激活参与了多种肿瘤的发生,如乳腺癌、胶质瘤、宫颈癌和肾癌等[10]。既往有研究表明,细胞内的亮氨酸可通过独立于PI3K-Akt-TSC-Rheb 通路的某种特殊方式进行传递,并最终激活mTORC1信号[11]。最近的一项研究表明,亮氨酸通过RagBGDP-RagCGTP 突变体可直接激活mTORC1 信号[12-13],从而促进肿瘤的生长,抑制自噬。本研究表明mTORC1抑制剂通过影响Gln代谢抑制BON细胞的增殖,“Gln代谢”是肿瘤细胞除了Warburg 效应之外又一重要的能量代谢方式,迅速增殖的肿瘤细胞通过消耗Gln来提供其生长和增殖所需的能量和生物大分子原料,维持细胞内氧化还原平衡和参与细胞内信号通路的转导,由于肿瘤对Gln的大量消耗,有人把肿瘤描述成“氮陷阱”(nitrogen trap)[14-15]。本研究发现BON细胞的增殖明显依赖于Gln代谢,BON细胞不能在无Gln的培养基里生长,增加培养基里Gln的浓度可刺激BON细胞的生长,这意味着对BON细胞而言,Gln已从非必需氨基酸转变成必需氨基酸。而且雷帕霉素可以降低其对Gln的吸收,影响Gln代谢,说明pNET的生长是mTORC1通路依赖性的。靶向其代谢的关键环节对pNET的治疗具有重要意义。
[1]Csibi A,Fendt SM,Li C,et al.The mTORC1 pathway stimulates glutamine metabolism and cell proliferation by repressing SIRT4[J].Cell,2013,153(4):840-854.
[2]易梅,向波,李小玲,等.代谢重编程:肿瘤的平衡之舞[J].中南大学学报:医学版,2013,38(11):1177-1187.
[3]Robey IF,Stephen RM,Brown KS,et al.Regulation of the Warburg effect in early-passage breast cancer cells[J].Neoplasia,2008,10(8):745-756.
[4]Ma WW,Jacene H,Song D,et al.[18F]fluorodeoxyglucose positron emission tomography correlates with Akt pathway activity but is not predictive of clinical outcome during mTOR inhibitor therapy[J].J Clin Oncol,2009,27(16):2697-2704.
[5]Jaini S,Dadachova E.FDG for therapy of metabolically active tumors[J].Semin Nucl Med,2012,42(3):185-189.
[6]Dang CV.MYC,microRNAs and glutamine addiction in cancers[J].Cell Cycle,2009,8(20):3243-3245.
[7]Lawrence B,Gustafsson BI,Chan A,et al.The epidemiology of gastroenteropancreatic neuroendocrine tumors[J].Endocrinol Metab Clin North Am,2011,40(1):1-18.
[8]Meng M,Chen S,Lao T,et al.Nitrogen anabolism underlies the importance of glutaminolysis in proliferating cells[J].Cell Cycle,2010,9(19):3921-3932.
[9]Inoki K,Li Y,Zhu T,et al.TSC2 is phosphorylated and inhibited by Akt and suppresses mTOR signalling[J].Nat Cell Biol,2002,4(9):648-657.
[10]Duran RV,Oppliger W,Robitaille AM,et al.Glutaminolysis activates rag-mTORC1 signaling[J].Mol Cell,2012,47(3):349-358.
[11]Smith EM,Finn SG,Tee AR,et al.The tuberous sclerosis protein TSC2 is not required for the regulation of the mammalian target of rapamycin by amino acids and certain cellular stresses[J].J Biol Chem,2005,280(19):18717-18727.
[12]Han JM,Jeong SJ,Park MC,et al.Leucyl-tRNA synthetase is an intracellular leucine sensor for the mTORC1-signaling pathway[J].Cell,2012,149(2):410-424.
[13]Kim E,Goraksha-Hicks P,Li L,et al.Regulation of TORC1 by Rag GTPases in nutrient response[J].Nat Cell Biol,2008,10(8):935-945.
[14]张淑香,李东晓,朱明龙,等.谷氨酰胺限制对杂交瘤细胞生长,代谢和单抗生产的影响[J].高效化学工程学报,2008,22(1):77-82.
[15]DeBerardinis RJ,ChengT.Q′s next:the diverse functions of glutamine in metabolism,cell biology and cancer[J].Oncogene,2010,29(3):313-324.
mTORC1 inhibitor inhibit human pancreatic neuroendocrine tumors cell proliferation by influence glutamine metabolism*
XiongShuanglong,GongYuzhu,XieGanfeng,LiNi,LiangHoujie△
(DepartmentofOncology,ThirdMilitaryMedicalUniversity,Chongqing,400038,China)
Objective To evaluatethe effect of mTORC1 inhibitor on the proliferation in human pancreatic neuroendocrine tumors(pNET) cell line BON,to explore the function of glutamine metabolism in it.Methods In vitro cultured human pancreatic neuroendocrine tumors(pNET) cell line BON,BON cells were treated with different concentrations of rapamycin(1,5,10,25,50,100 nM)for 12,24 h.Then CCK-8 assay are used to calculate the growth inhibitory rate.Rapamycin treated with BON 12 h,test the glutamine uptake level compared with control.Then deprive of glucose and/or glutamine,CCK-8 assay were used in observation of cell proliferation,cell cycle distribution was analyzed by flow cytomety.Results Rapamycin significantly inhibited the growth of BON cells in a time-and dose-dependent manner(P<0.05).Meanwhile,rapamycin can reduce the glutamine uptake level compared with control.BON obviously depends on glutamine for growth,without glucose and glutamine group have obvious difference in growth rate(P<0.05).Conclusion mTORC1 inhibitor can inhibit BON cells proliferation and influence the glutamine uptake level.suggesting that mTORC1 inhibitor might inhibit BON cells proliferation by influenced the glutamine metabolic pathway.
cell proliferation;glutamine metabolism;mTORC1inhibitor;pancreaticneuroendocrine tumors
10.3969/j.issn.1671-8348.2015.06.007
中国临床肿瘤学科学基金(Y-N2013-006)。 作者简介:熊双龙(1989-),在读硕士,主要从事神经内分泌肿瘤的代谢研究。△
,E-mail:lianghoujie@sina.com。
R246.8
A
1671-8348(2015)06-0738-03
2014-10-08
2014-12-10)
