S-亚硝基谷胱甘肽对小鼠肠急性缺血再灌注损伤后肠屏障功能的影响*
2015-06-01孙力华肖卫东
彭 科,许 超,于 敏,孙力华,肖卫东,杨 桦
(第三军医大学新桥医院普通外科,重庆 400037)
·论著·
S-亚硝基谷胱甘肽对小鼠肠急性缺血再灌注损伤后肠屏障功能的影响*
彭 科,许 超,于 敏,孙力华,肖卫东,杨 桦△
(第三军医大学新桥医院普通外科,重庆 400037)
目的 探讨S-亚硝基谷胱甘肽(GSNO)预处理对小鼠肠急性缺血再灌注(I/R)所致的肠黏膜屏障损伤的影响。方法6~8周龄雄性C57BL/6小鼠24只,分为Sham组、I/R组、I/R+GSNO组,每组8只。采用夹闭肠系膜上动脉30 min,再灌注6 h作为小鼠肠I/R模型。苏木素-伊红(HE)染色观察小肠组织形态学的变化;免疫组织化学观察肠上皮细胞间紧密连接蛋白claudin-1的表达情况;Western blot检测claudin-1蛋白水平变化。结果 HE染色显示,与Sham组比较,I/R组肠黏膜明显肿胀,绒毛部分脱落、变粗,绒毛倒伏、断裂,而I/R+GSNO组肠黏膜无明显肿胀,绒毛完整,形态接近正常;免疫组织化学观察显示I/R刺激可造成肠上皮表面claudin-1连续性明显破坏,阳性表达率明显降低,I/R+GSNO组肠上皮claudin-1连续性明显恢复,阳性染色显著增加;肠上皮claudin-1蛋白定量分析显示:与Sham组比较,I/R组及I/R+GSNO小肠上皮紧密连接蛋白claudin-1表达分别下降32.5%,13.8%(P<0.05);与I/R组比较,I/R+GSNO组小鼠肠上皮紧密连接蛋白claudin-1表达上调27.8%(P<0.05)。结论 小肠急性I/R刺激可造成明显的肠黏膜损伤及肠上皮间紧密连接的显著破坏;GSNO预处理可通过上调claudin-1表达,有效缓解I/R对肠黏膜结构与肠上皮屏障功能的损伤。
S-亚硝基谷胱甘肽;肠黏膜屏障;紧密连接蛋白;肠缺血再灌注
肠缺血再灌注(ischemia reperfusion,I/R)作为包括各种大型手术及急性创伤、战伤等多种急性病理刺激下临床常见的病理生理过程之一,是诱发肠道结构及功能损伤,继而导致肠黏膜屏障(intestinal epithelial barrier,IEB)功能破坏、肠道细菌移位及全身炎症反应综合征等系列连锁反应的重要原因,也是影响重症患者预后的重要因素[1]。而IEB的结构及功能的完整性主要依赖于肠上皮间紧密连接蛋白的结构与功能的完整性[2]。S-亚硝基谷胱甘肽(S-Nitrosoglutathione,GSNO)是一种在亚硝基化环境下谷胱甘肽的衍生物[3],已有研究发现其在肠道中也有表达,并在维持IEB结构与功能中有重要作用[4]。还有研究表明GSNO能减轻多种炎性因子刺激对IEB的破坏作用[5]。但目前在GSNO对肠I/R的防治未见有关报道,本实验通过建立小鼠肠I/R模型,探讨GSNO对于肠I/R的防治作用。
1 材料与方法
1.1 实验动物、主要仪器及试剂 雄性C57BL/6小鼠24只购自重庆第三军医大学实验动物中心,6~8周龄,体质量20~25 g。蛋白酶抑制剂(PMSF)、苏木素、二甲苯、聚偏二氟乙烯(PVDF)膜购自美国Millipore公司。GSNO购自美国Sigma公司。claudin-1一抗购自Abcam公司,辣根过氧化物酶(HRP)标记二抗、化学发光(ECL)检测试剂盒、RIPA裂解液、蛋白测定试剂盒和十二烷基磺酸纳-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶配置试剂盒均购自武汉博士德生物工程公司。垂直电泳仪、湿转电转仪购自美国Bio-Rad公司。
1.2 肠I/R模型制备及分组处理方法 24只小鼠分为3组(n=8)。假手术组(sham组)、I/R组、GSNO干预组(I/R+GSNO组)。术前12 h禁食,自由饮水。其中I/R+GSNO组术前30 min和术后经腹腔注射GSNO溶液10 mg/kg[4];同时I/R组、sham组给予等量的生理盐水。小鼠腹腔注射0.15 mL 0.1%的戊巴比妥钠麻醉后切开腹部,沿其腹正中线切开,寻找并游离肠系膜上动脉(superior mesenteric artery,SMA)根部。其中I/R组及I/R+GSNO组,用动脉夹夹闭SMA根部30 min后松开动脉夹恢复血流,sham组只游离SMA不行夹闭。待6 h后将各组小鼠处死,取其小肠组织。
1.3 小肠组织形态学的观察 距小鼠回盲部10 cm以上取小肠组织,经甲醛固定,常规脱水、石蜡包埋、切片后HE染色。光镜下观察肠黏膜组织形态学变化。
1.4 肠claudin-1免疫组织化学染色 石蜡切片脱蜡,用pH7.4的PBS冲洗3次,柠檬酸缓冲液微波抗原修复的后阻断内源性过氧化物酶的活性。一抗室温下孵育2 h。DAB液显色,苏木素复染,自来水冲洗、蓝化,中性树胶封固,晾干后观察。
1.5 小肠组织蛋白提取及Western blot检测 肠黏膜在混有1 mmol/L的苯甲基磺酰氟(PMSF)的RIPA裂解液中采用超声裂解法裂解组织细胞,冰浴30 min,12 000 r/min 4 ℃离心15 min。用蛋白测定试剂盒测定上清液蛋白含量。蛋白上样后80 V电泳2 h,100 V恒压湿转1 h至PVDF膜,转膜结束后用50 g/L的脱脂奶粉封闭1 h。分别加入一抗claudin-1抗体(1∶500)、甘油醛-3-磷酸脱氢酶(GAPDH,1∶1 000),4 ℃冰箱12 h。TBST洗膜3次,每次10 min。然后加入二抗后室温孵育1 h。TBST洗膜3次,每次10 min。加入ECL化学发光试剂显影,采用图像分析系统采集发光信号,经Kodak Molecular Imaging软件行密度分析,以目的蛋白与GAPDH灰度比值作为目的蛋白相对表达量。
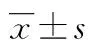
2 结果
2.1 小肠组织形态学的改变 小肠HE染色显示sham组肠绒毛排列整齐,形态结构完整;IR组肠绒毛排列紊乱,可见明显肿胀、变粗,肠黏膜坏死,组织结构松散;I/R+GSNO组肠黏膜部分坏死,肠绒毛未见明显水肿,显著改善了肠I/R所致的肠黏膜形态结构的破坏,见图1。
2.2 紧密连接蛋白claudin-1在肠黏膜中的表达变化 免疫组织化学显示3组小肠黏膜claudin-1均沿肠上皮细胞膜表面分布,为棕黄色线性染色,细胞核及细胞核膜无表达。sham组线性结构完整,表达均匀,I/R组阳性结果明显减弱,细胞膜表面阳性结果呈迷离性表达,其连续性断裂。I/R+GSNO组较I/R组有明显改善。见图2。

A:sham组;B:I/R组;C:I/R+GSNO组。
图1 小肠切片HE染色结果(×400)

A:sham组小肠claudin-1结构完整,表达连续;B:I/R组小肠claudin-1表达严重丢失,其连续性完全断裂;C:I/R+GSNO组小肠claudin-1表达部分丢失,连续性部分断裂。
图2 紧密连接蛋白claudin-1在肠黏膜中的表达变化
2.3 半定量分析肠上皮细胞claudin-1的变化 建立小鼠I/R模型后,提取肠上皮总蛋白,通过Western blot检测小肠上皮中claudin-1蛋白水平的表达变化。结果显示,与sham组比较,I/R组及I/R+GSNO组小肠上皮紧密连接蛋白claudin-1表达分别下降32.5%,13.8%(P<0.05);其中,与I/R组比较,I/R+GSNO组小鼠肠上皮紧密连接蛋白claudin-1表达上调27.8%(P<0.05)。提示I/R刺激可造成肠上皮紧密连接蛋白claudin-1表达的显著下降,而GSNO预处理可明显抑制I/R对claudin-1表达的下调作用。见图3。

A:Western blot图;B:Western blot分析图;a:P<0.05,与sham比较;b:P<0.05,与I/R组比较。
图3 小鼠缺血再灌注模型及GSNO预处理对claudin-1蛋白表达的影响
3 讨论
IEB在维持肠黏膜完整性及机体内环境稳态方面发挥着关键作用[6]。其中机械屏障是其重要的屏障之一。而机械屏障的结构基础是完整的肠上皮细胞(IEC)和相邻上皮细胞之间的紧密连接蛋白(TJ)。紧密连接的基本组成单位是跨膜的连接蛋白,主要有claudin蛋白,闭锁蛋白(occludin)、zona occludins(ZO)以及连接黏附分子(JAM)等。上皮间的细胞通过以上蛋白进行连接,封闭细胞间隙,从而有效的维持内环境的稳态[2]。许多病理情况如严重感染、休克、大面积烧伤、严重创伤等均可导致肠屏障功能的破坏,造成肠源性感染,进一步加重原发疾病,甚至诱发全身炎症反应综合征,导致多脏器功能衰竭[6]。
GSNO是最重要的S-亚硝基硫醇之一,通常被认为是一氧化氮(NO)在体内的供体以及细胞间亚硝基化中间的代谢产物[3]。主要的代谢合成机制是NO在机体内可与还原型谷胱甘肽(glutathione,GSH)形成亚硝基化合物GSNO[7]。目前有研究表明GSNO在心脏缺血及心肌梗死方面对心肌有良好的保护作用[8]。Lima等[9]研究认为在中枢神经系统中,给予GSNO预处理,可以减轻脑缺血再灌注模型对血脑屏障的损伤,且可能与其代谢的关键酶亚硝基谷胱甘肽还原酶(S-nitrosoglutathione reductase,GSNOR)有关[10]。大量研究证实在胃肠道方面,GSNO能缓解多种炎症因子刺激下肠黏膜屏障的破坏,Flamant等[11]发现GSNO减少了弗氏志贺菌(Shigella flexneri)对Caco-2 细胞的感染,从而提高了Claudin在志贺菌感染模型下的表达。然而GSNO在I/R模型中是否对肠黏膜屏障仍具有保护作用目前尚不清楚。
通过本研究的结果可得出:GSNO可以明显的减轻小鼠在肠I/R模型中对肠屏障的损伤作用。主要作用可能是通过调节claudin-1实现的。肠道血供丰富,是I/R损伤最易受累的器官之一[12]。肠缺血可造成明显的组织损伤,而再灌注后肠组织在原缺血造成损伤的基础上组织损伤将进一步加重,则形成再灌注损伤[13]。有研究认为GSNO在病理条件下对肠黏膜屏障的保护作用的主要原因可能是抑制了再灌注后大量氧自由基、炎性细胞因子的释放、P38MAPK信号通路的激活。同时GSNO作为NO信号通路的组成部分,松弛胃肠道平滑肌及血管,有效地缓解了小鼠肠I/R损伤作用[14-16]。目前已发现通过激动与抑制GSNO的合成均能影响其对IEB功能的作用[4]。综上所述,GSNO在肠I/R模型下能有效的缓解小鼠IEB功能的破坏,但具体机制还需进一步探讨。本研究结果可为未来GSNO治疗和预防肠I/R损伤提供可靠的实验依据。
[1]Vollmar B,Menger MD.Intestinal ischemia/reperfusion:microcirculatory pathology and functional consequences[J].Langenbecks Arch Surg,2011,396(1):13-29.
[2]高志光,秦环龙.肠上皮细胞紧密连接的生物学功能及在肠屏障中的作用[J].肠外与肠内营养,2005,12(5):299-302.
[3]Broniowska KA,Diers AR,Hogg N.S-nitrosoglutathione[J].Biochim Biophys Acta,2013,1830(5):3173.
[4]Savidge TC,Newman P,Pothoulakis,et al.Enteric glia regulate intestinal barrier function and inflammation via release of S-nitrosoglutathione[J].Gastroenterology,2007,132(4):1344-1358.
[5]Cheadle GA,Costantini TW,Lopez N,et al.Enteric glia cells attenuate cytomix-induced intestinal epithelial barrier breakdown[J].PLoS One,2013,8(7):e69042.
[6]黎介寿.肠衰竭——概念、营养支持与肠黏膜屏障维护[J].中国临床营养杂志,2004,12(3):155-158.
[7]Sarr M,Chataigneau M,Etienne-Selloum N,et al.Targeted and persistent effects of NO mediated by S-nitrosation of tissue thiols in arteries with endothelial dysfunction[J].Nitric Oxide,2007,17(1):1-9.
[8]Lima B,Lam GK,Xie L,et al.Endogenous S-nitrosothiols protect against myocardial injury[J].Proc Natl Acad Sci U S A,2009,106(15):6297-6302.
[9]Lima B,Lam GK,Xie L,et al.Neuroprotection of S-nitrosoglutathione against ischemic injury by down-regulating Fas S-nitrosylation and downstream signaling[J].Neuroscience,2013,248:290-298.
[10]Palmer LA,deRonde K,Brown-Steinke K,et al.hypoxia-induced changes in protein s-nitrosylation in female mouse brainstem[J].Am J Respir Cell Mol Biol,2015,52(1):37-45.
[11]Flamant M,Aubert P,Rolli-Derkinderen M,et al.Enteric glia protect against Shigella flexneri invasion in intestinal epithelial cells:a role for S-nitrosoglutathione[J].Gut,2011,60(4):473-484.
[12]Flessas II,Papalois AE,Toutouzas K,et al.Effects of lazaroids on intestinal ischemia and reperfusion injury in experimental models[J].J Surg Res,2011,166(2):265-274.
[13]Xiao W,Wang W,Chen W,et al.GDNF is involved in the barrier-inducing effect of enteric glial cells on intestinal epithelial cells under acute ischemia reperfusion stimulation[J].Mol Neurobiol Mol Neurobiol,2014,50(2):274-289.
[14]BeutheuS,GhouzaliI,GalasL,etal.Gluta-mine and arginine improve permeability and tight junction protein expression in methotrexate-treated Caco-2 cells[J].Clin Nutr,2013,32(5):863-869.
[15]Kiroglu OE,Aydinoglu F,Ogulener N.The effects of thiol modulators on nitrergic nerve-and S-nitrosothiols-induced relaxation in duodenum[J].J Basic Clin Physiol Pharmacol,2013,24(2):143-150.
[16]Corti A,Franzini M,Scataglini I,et al.Mechanisms and targets of the modulatory action of S-nitrosoglutathione(GSNO) on inflammatory cytokines expression[J].Arch Biochem Biophys,2014,562:80-91.
The effect of S-Nitrosoglutathione on the intestinal epithelial barrier after acute ischemia reperfusion injury*
PengKe,XuChao,YuMin,SunLihua,XiaoWeidong,YangHua△
(DepartmentofGeneralSurgery,theAffiliatedXinqiaoHospitaloftheThirdMilitaryMedicalUniversity,Chongqing400037,China)
Objective To investigate the effect of S-Nitrosoglutathione (GSNO) on acute ischemia reperfusion (I/R) induced intestinal barrier function lesion in a mouse model.Methods Twenty-four 6-8-year-old C57BL/6 mice were divided into 3 groups,8 for each:(1) the sham group;(2) the I/R group;(3) the I/R+GSNO group.The mouse intestine I/R model was established by the occlusion of the superior mesenteric artery temporarily followed by reperfusion for 6 h.Histological changes in the small intestine were observed after HE staining;the expression of claudin-1 protein in the intestine epithelium was assessed by immunohistochemistry staining as well as western blot analysis.Results Both HE staining and immunohistochemistry results showed the integrate intestinal villi with the continuous Claudin-1 expression alone the villi in the sham group;the intestinal villi of the I/R group partially detached,thickened,crooked and fractured,with the obvious disconnection of Claudin-1 staining alone the top of the villi;while the intestinal villi of the I/R+GSNO group were neatly arranged and damage to intestinal mucosa was much alleviated,accompanied with the marked restoration of the continuity of claudin-1 staining.Compared to the sham group,claudin-1 protein level of for the I/R group and the I/R+GSNO group decreased by 32.5% and 13.8% respectively (P<0.05);and compared to the I/R group,claudin-1 protein level of the I/R+GSNO group increased by 27.8% (P<0.05).Conclusion Protein level of claudin-1 would decreases after I/R,and pretreatment with GSNO can effectively relieve the damage of intestinal mucosal structure as well as intestinal tight junction barrier through upregulating the expression of claudin-1 protein.
S-Nitrosoglutathione;intestinal epithelial barrier;tight junction protein;intestinal ischemia reperfusion
10.3969/j.issn.1671-8348.2015.06.002
国家自然科学基金重点项目(NSFC 81330013);国家自然科学基金面上项目(NSFC 81272078,NSFC 81270451 to W.D.X.);国家教育部创新团队项目基金 (教技函[2013]59号)。 作者简介:彭科(1987-),住院医师,硕士,主要从事胃肠疾病研究。△
,E-mail:hwbyang@126.com。
R151
A
1671-8348(2015)06-0724-03
2014-09-15
2014-11-28)
