秦皮素对苯肾上腺素诱导的大鼠心肌细胞肥大的影响
2015-06-01程阔菊
程阔菊,景 胜
(1.达州市中西医结合医院药学部,四川达州 635000;2.第三军医大学新桥医院麻醉科,重庆 400037)
论著·基础研究
秦皮素对苯肾上腺素诱导的大鼠心肌细胞肥大的影响
程阔菊1,景 胜2
(1.达州市中西医结合医院药学部,四川达州 635000;2.第三军医大学新桥医院麻醉科,重庆 400037)
目的 观察秦皮素对苯肾上腺素诱导的原代SD乳鼠心肌细胞肥大的影响。方法 建立苯肾上腺素诱导的SD乳鼠原代心肌细胞肥大模型,观察秦皮素对心肌细胞肥大的影响;图像分析法计算心肌细胞面积;[3H]-亮氨酸掺入法测试心肌细胞蛋白质合成速率;实时定量荧光 PCR法检测心肌细胞Nrf2和肥大分子标志物心房钠尿肽、心房利尿肽的mRNA表达水平。结果 (1)80 μmol/L 苯肾上腺素刺激心肌细胞48 h能成功复制SD乳鼠心肌细胞肥大模型并伴随Nrf2表达量的增加;(2)秦皮素呈剂量依赖性地抑制苯肾上腺素刺激的SD乳鼠心肌细胞面积的增大、蛋白质合成速率的增加和肥大分子标志物的上调。结论 秦皮素能显著抑制PE诱导的原代大鼠心肌细胞肥大。
心肌细胞;脱氧肾上腺素;秦皮素;Nrf2
心肌肥厚是心脏长期负荷过重时发生的一种心室重构,以心肌细胞蛋白质合成增加、细胞体积增大和心肌细胞间结缔组织沉积为表现,也是多种心血管疾病,如冠心病、高血压、心脏瓣膜病等的常见并发症和病理基础[1-2]。尽管心肌肥厚早期是一种代偿反应,但晚期则逐渐发展为失代偿,常导致严重的心力衰竭、心肌梗死等,最终导致死亡[3]。预防与逆转这种改变是治疗的重要目标。研究表明,NF-E2相关因子2(NF-E2-related factor2,Nrf2)对心肌肥厚及纤维化具有抑制作用,而秦皮素(fraxetin)为Nrf2的天然激动剂[4-7]。目前,关于秦皮素对心肌肥厚及纤维化是否具有抑制作用的问题尚无相关研究报道。鉴于此,本研究拟在苯肾上腺素(phenylephrine,PE)诱导的SD乳鼠心肌细胞肥大模型基础上,观察秦皮素对PE诱导的大鼠心肌细胞肥大作用的影响,以期为心肌肥厚、纤维化及其诱导的心血管疾病提供有效的药物防治。
1 材料与方法
1.1 材料
1.1.1 实验动物 新生SD乳鼠(0~2 d),SPF 级,由第三军医大学实验动物中心提供,合格证号:SCXK(渝)2007-0003。
1.1.2 主要设备与试剂 CO2培养箱(购自SANYO公司),超净工作台(购自JOYN公司),倒置显微镜(购自Leica公司),LightCycler480(购自Roche公司),青霉素、链霉素(均购自华美生物工程公司),二甲基亚砜(DMSO)、fraxetin、phenylephrine(均购自Sigma公司),羊血清、胎牛血清(FBS)、DMEMF12(购自GBCO公司),组织固定液(购自Alphelys公司),RNA 提取试剂盒、逆转录试剂盒及PCR扩增试剂盒(均购自Roche公司)。
1.2 方法
1.2.1 新生SD乳鼠原代心肌细胞的培养与鉴定 无菌取出新生SD乳鼠心脏,预冷PBS溶液洗净心脏残血,切除两心耳、心房与右心室,将左心室切成1~2 mm3碎片,加入消化酶液(Gibco胰酶0.15%,Hyclone胰酶0.10%),以140 r/min的转速于恒温36.5 ℃下消化10 min,沉淀、吸取上清液,加入20%FBS培养液中终止消化,反复多次至所有心脏组织消化完全为止。弃第1次消化的上清液,收集余下上清液,40 μmol/L(40 μm:过滤网规格)过滤网过滤,将过滤细胞接种于细胞培养瓶中贴壁培养90 min,除去贴壁纤维细胞。90 min后,吸取上清液,经滤网再过滤后,加入终浓度为0.1 mmol/L 的5-溴脱氧尿嘧啶核苷,种置于预先包被有明胶的培养皿中。5%CO2培养箱中37 ℃条件下孵育48 h,PBS轻柔清洗1次,更换培养基,观察细胞形态,并对心肌细胞进行形态学及免疫学鉴定。
1.2.2 心肌细胞肥大模型的建立及实验分组 实验对秦皮素设置5个浓度梯度,对PE刺激设置5个时间梯度,秦皮素浓度梯度:0、1.0、2.0、4.0、5.0 μmol/L;PE时间梯度:0、6、12、24、48 h;模型的建立及药物处理:心肌细胞无血清饥饿24 h,换成分别含0、1.0、2.0、4.0、5.0 μmol/L的秦皮素培养基孵育1 h后,加入80 μmol/L的PE,分别继续孵育0、6、12、24、48 h。每组设立3个复孔,重复3次实验。
1.2.3 心肌细胞面积的测定(图像分析法) 细胞处理结束后,弃去培养基,用预冷的PBS快速轻柔洗涤细胞2遍,于倒置显微镜下观察并拍照。每培养皿取3~5个视野,每个视野取5~10个细胞,用专业图像分析软件Image-ProPlus 5.0测定单个心肌细胞面积(m2)。
1.2.4 [3H]-亮氨酸掺入法测定心肌细胞蛋白质合成速率 在离处理结束12 h时,每培养皿加入11 μL Ci/mL[3H]-亮氨酸。实验结束后,弃去培养液,4 ℃PBS清洗贴壁细胞2次,用0.2%胰酶将贴壁细胞消化,收集消化心肌细胞于预备好的玻璃纤维膜上。10.0%三氯乙酸分解破碎心肌细胞,于PBS中清洗3次,除去游离的同位素标记物,烘干滤膜。置于含相应剂量闪烁液的检测瓶内,摇匀,液体闪烁仪(Beckman)测定蛋白质合成速率,结果以cpm表示,[3H]-亮氨酸的掺入量即可反映心肌细胞蛋白质的合成速率。
1.2.5 实时定量荧光PCR检测Nrf2及心肌细胞肥大分子标志物的表达 实验结束后,弃去培养液,按照RNA提取试剂说明书提取心肌细胞总RNA,凝胶电泳检测RNA质量,分光光度仪检测260/280吸光度比值,计算RNA浓度。按照RNA逆转录试剂说明书将mRAN 反转率成cDNA,用LightCycler 480仪器对Nrf2及心肌细胞肥大分子标志物心房钠尿肽(atrial natriuretic peptide,ANP)和心房利尿肽(brain natriuretic peptide,BNP)进行实时定量荧光PCR扩增并,内参甘油醛-3-磷酸脱氢酶(GAPDH)。实时定量荧光PCR引物序列如下:GAPDH上游引物序列:5′-GAC ATG CCG CCT GGA GAA AC-3′,下游引物序列:5′-AGC CCA GGA TGC CCT TTA GT-3′,扩增产物长度为92 bp;Nrf2上游引物序列:5′-TCT GTC AGC TAC TCC CAG GT-3′,下游引物序列:5′-GAA TAT CCA GGG CAA GCG ACT-3′,扩增产物长度为148 bp;ANP上游引物序列:5′-ACA CAG CTT GGT CGC ATT GCC A-3′,下游引物序列:5′-CGT CTG TCC GTG GTG CTG AAG TTT-3′,扩增产物长度为215 bp;BNP上游引物序列:5′-ACA ATC CAC GAT GCA GAA GCT-3′,下游引物序列:5′-GGG CCT TGG TCC TTT GAG A-3′,扩增产物长度为87 bp。
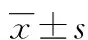
2 结果
2.1 心肌细胞的鉴定 形态学鉴定:心肌细胞刚接种尚未贴壁时形态为椭圆形或圆形。1 d后,细胞伸出伪足开始贴壁;2 d后,伪足成纤维条索状,细胞完全贴壁,细胞胞体则呈现不规则形状,如多角形、菱形或梭形,并有少数细胞开始聚合(图1);3 d后,大部分细胞已聚合成团并成良好搏动状态,频率约100次/分钟。免疫荧光鉴定:心肌细胞anti-α-actinin 染色成阳性,心肌特异性横纹肌结构明显可见,且细胞核周围有少许棕黄色颗粒,心肌细胞纯度大于95%,结果见图2。
2.2 秦皮素对PE诱导的大鼠心肌细胞面积的影响 经PE诱导后,心肌细胞面积显著增大(P<0.05),从12 h起作用,48 h达最大值,表明80 μmol/L PE刺激大鼠心肌细胞48 h能成功复制大鼠心肌细胞肥大模型;经秦皮素预处理后,PE诱导的心肌细胞面积增大随秦皮素呈剂量依赖性的减轻,从4 μmol/L起可以将其抑制在基础水平。表明,秦皮素能显著抑制PE诱导的大鼠心肌细胞面积增大,结果见图3。
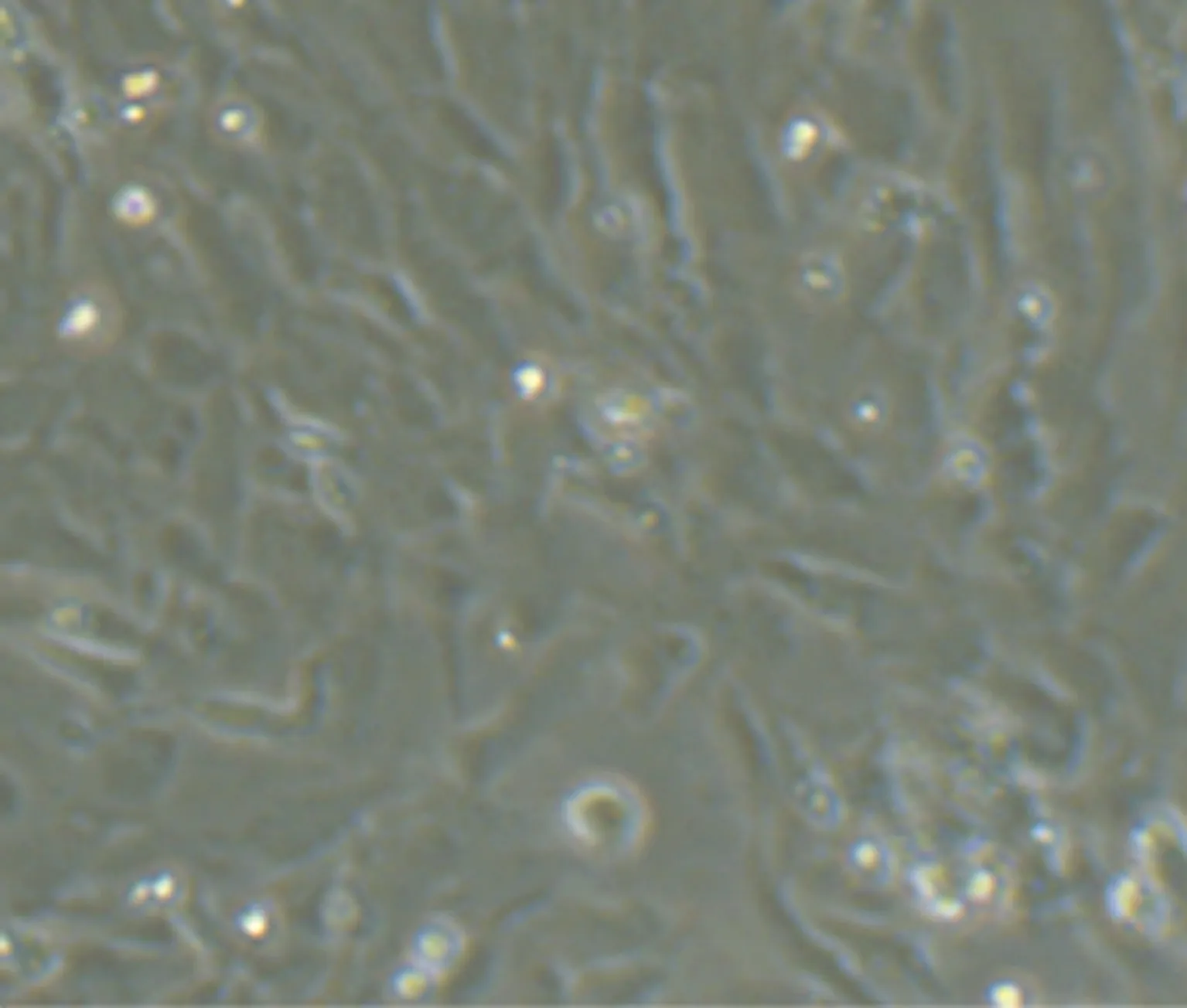
图1 心肌细胞形态学观察
图2 心肌细胞免疫学鉴定

A:不同浓度的秦皮素对心肌细胞面积的影响;B:5 μmol/L秦皮素对PE诱导不同时间的心肌细胞面积的影响;a:P<0.05,与秦皮素组比较;b:P<0.05,与PE+介质组比较。
图3 秦皮素对PE诱导的大鼠心肌细胞面积的影响
2.3 秦皮素对PE诱导的大鼠心肌细胞[3H]-亮氨酸掺入量的影响 经PE刺激诱导后,大鼠心肌细胞的[3H]-亮氨酸掺入量显著增多(P<0.05),从12 h起作用,48 h达最大值,表明80 μmol/L PE刺激心肌细胞可成功的复制心肌细胞肥大模型;应用秦皮素预处理后,[3H]-亮氨酸掺入量显著减少(P<0.05),从4 μmol/L起可以将其抑制在基础水平,表明秦皮素可显著抑制PE诱导的大鼠心肌细胞蛋白质合成速率的增加,结果见图4。
2.4 秦皮素及PE对大鼠心肌细胞Nrf2表达的影响 经PE诱导后,心肌细胞Nrf2的mRNA表达量显著增高(P<0.05),从6 h起作用,48 h达最大值;经秦皮素预处理后,PE诱导的心肌细胞Nrf2表达量并不随秦皮素剂量的改变而变化。表明PE能显著诱导Nrf2表达量的增高,但秦皮素对其表达无影响,结果见图5。
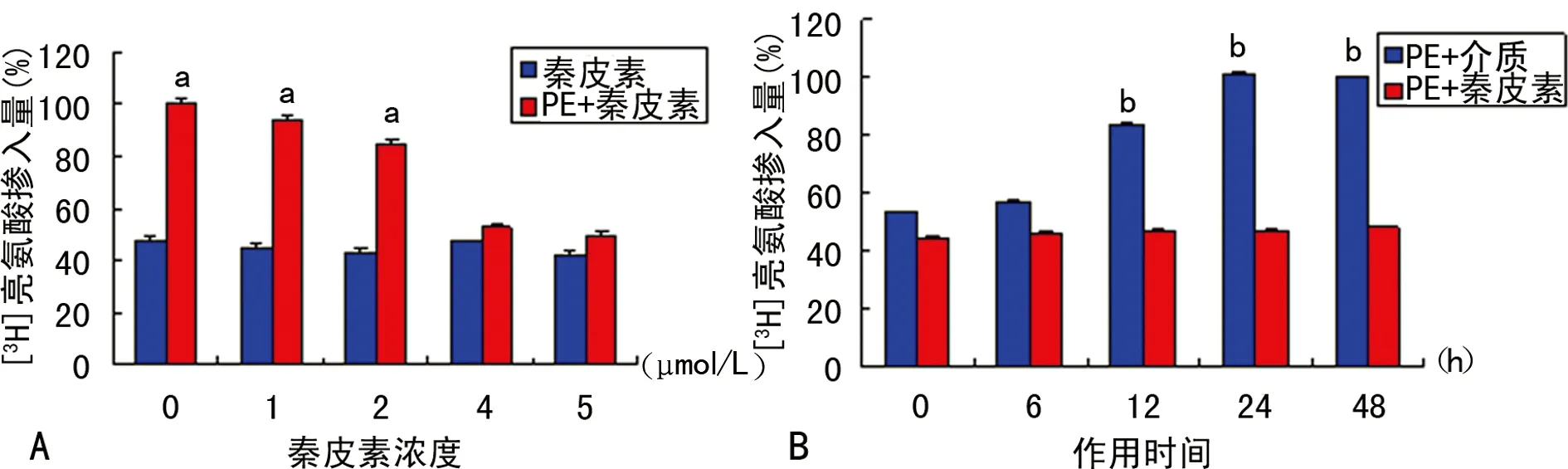
A:不同浓度的秦皮素对心肌细胞[3H]-亮氨酸掺入量的影响;B:5 μmol/L秦皮素对PE诱导不同时间的心肌细胞[3H]-亮氨酸掺入量的影响;a:P<0.05,与秦皮素组比较;b:P<0.05,与PE+介质组比较。
图4 秦皮素对PE诱导的心肌细胞[3H]-亮氨酸掺入量的影响
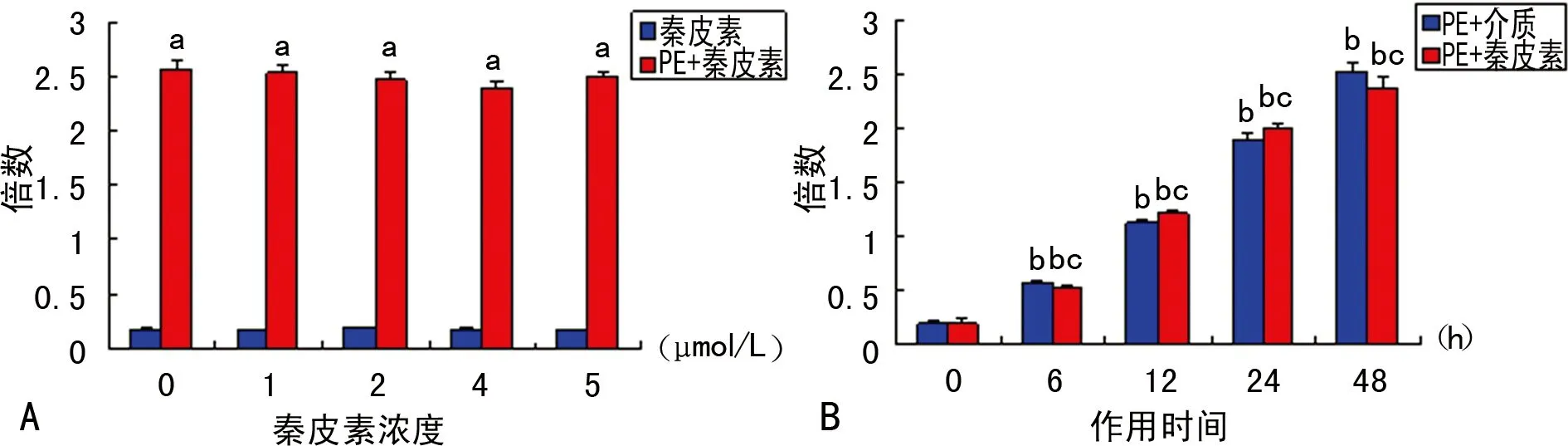
A:不同浓度的秦皮素对心肌细胞Nrf2表达的影响;B:5 μmol/L秦皮素对PE诱导不同时间的心肌细胞Nrf2表达的影响;a:P<0.05,与秦皮素组比较;b:P<0.05,与PE+介质组比较;c:P<0.05,与PE+秦皮素组比较。
图5 秦皮素对PE诱导的大鼠心肌Nrf2 mRNA表达的影响
2.5 秦皮素对PE诱导的大鼠心肌细胞肥大标志物的影响 经PE诱导后,心肌细胞肥大分子标志物ANP、BNP的mRNA表达量明显上调(P<0.05),从6 h开始起作用,48 h达最大值;经5 μmol/L秦皮素预处理后,已上调的心肌细胞肥大分子标志物ANP、BNP的mRNA表达可回落到基础水平(P<0.05)(图6)。表明秦皮素能显著抑制PE刺激诱导的大鼠心肌细胞肥大分子标志物的表达。
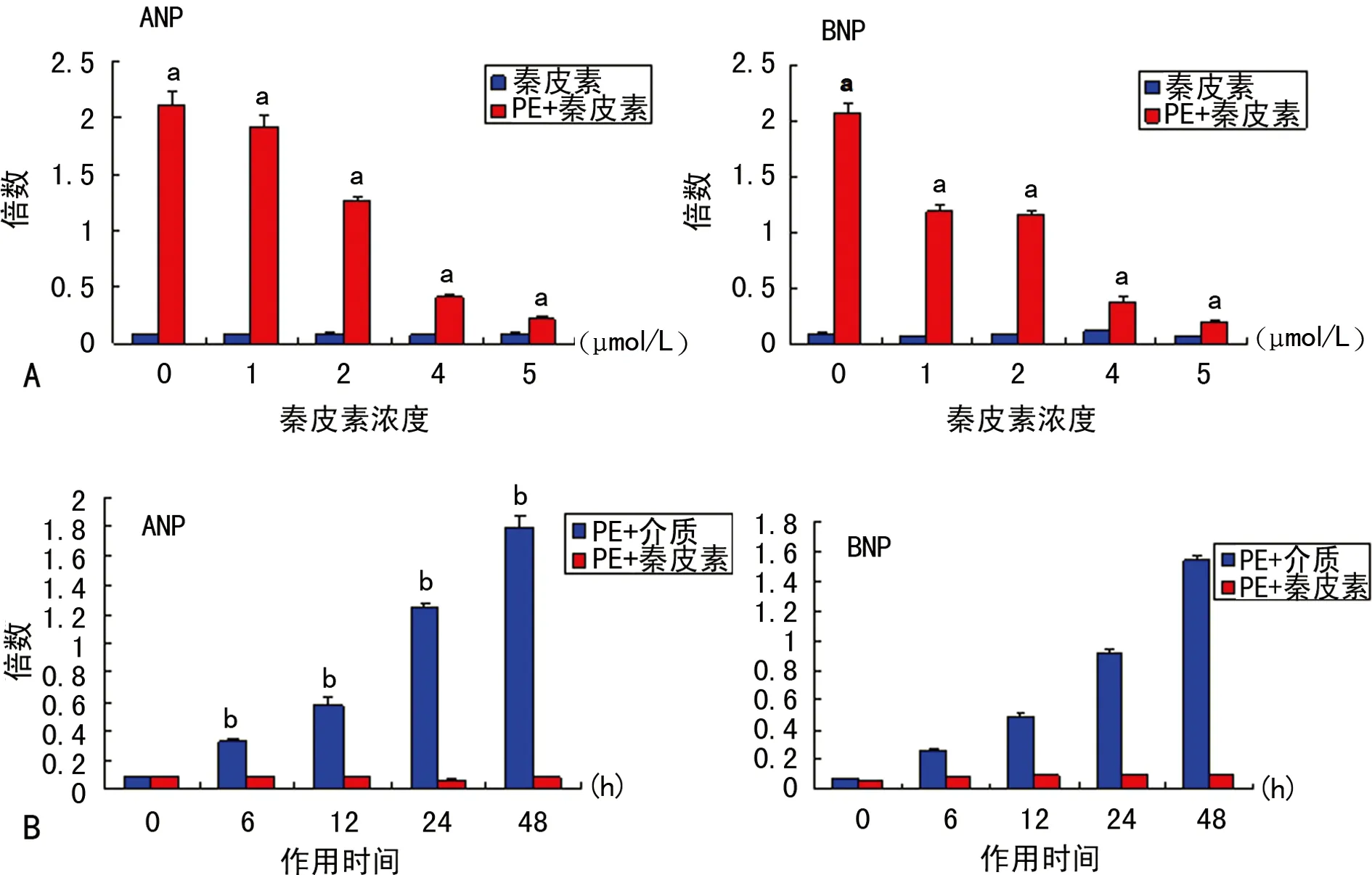
A:不同浓度的秦皮素对心肌细胞肥大标志物的影响;B:5 μmol/L秦皮素对PE诱导不同时间的心肌细胞肥大标志物的影响;a:P<0.05,与秦皮素组比较;b:P<0.05,与PE+介质组比较。
图6 秦皮素对PE诱导的心肌细胞肥大标志物的影响
3 讨论
在临床上,心肌肥厚是多种心血管系统疾病的共同病理基础,如冠心病、高血压病、心肌炎症和先天性心脏病等多种心血管疾病。一般情况下,心肌肥厚是多种因素共同诱导的结果。从广义上讲,诱导心肌肥厚的因素包括两大类,即机械刺激和神经体液分子刺激。机械刺激包括各种压力负荷和容积负荷的直接刺激。
诱导心肌肥厚的各种神经体液分子,目前已报道的有受体酪氨酸激酶激动剂[8],包括胰岛素样生长因子-1、成纤维细胞生长因子、转化生长因子β以及血小板源性生长因子等;G蛋白偶联受体激动剂[9],如内皮素-1、血管紧张素Ⅱ以及α1-/β-肾上腺素受体激动剂,包括肾上腺素、去甲肾上腺素、PE等;促炎因子如肿瘤坏死因子α、白细胞介素6、白血病抑制因子及心肌营养因子-1等[10];花生四烯酸代谢产物前列腺素F2α[11]、蛋白激酶C激动剂[12]等。根据以上心肌肥厚的神经体液诱发分子建立起来的体外心肌细胞肥大模型有PE[13]、异丙肾上腺素[14]、内皮素-1[15]、血管紧张素Ⅱ[16]、醛甾酮[17]等诱导法。本研究参照文献[13]报道,并结合预实验采用80 μmol/L PE刺激心肌细胞成功的复制了大鼠心肌细胞肥大模型。
Nrf2对心肌肥厚及纤维化具有抑制作用[4-5],而秦皮素为Nrf2的天然激动剂[6-7]。因此,本研究推测秦皮素对心肌肥厚及纤维化很可能具有抑制作用。本研究通过在PE诱导的大鼠心肌细胞肥大模型基础上,观察秦皮素对大鼠心肌细胞肥大的影响。结果表明,秦皮素能显著抑制PE刺激诱导的大鼠心肌细胞面积增大、蛋白质合成的增多以及肥大分子标志物ANP、BNP表达的上调,证实秦皮素可以抑制PE诱导的大鼠心肌细胞肥大;在心肌细胞肥大模型中,Nrf2的表达量显著上调,而秦皮素对其表达却无影响,说明秦皮素的作用靶点可能位于Nrf2蛋白转录之后而非转录之前,这一结论也正好与秦皮素为Nrf2的天然激动剂相吻合[6-7]。至于秦皮素抑制心肌肥厚的作用机制是否通过Nrf2,以及秦皮素是否对整体动物心肌肥厚模型具有抑制作用,有待进一步研究。观察秦皮素对心肌肥厚的作用,并探讨其分子机制,以期为临床心肌肥厚、纤维化及其诱导的心血管病提供有效的药物防治。
[1]Yamamoto S,Kita S,Iyoda T,et al.New molecular mechanisms for cardiovascular disease:cardiac hypertrophy and cell-volume regulation[J].J Pharmacol Sci,2011,116(4):343-349.
[2]Andrea A,Scarafile R,Ferrara,et al.An unusual case of apical hypertrophic cardiomyopathy in a transplanted heart[J].Monaldi Arch Chest Dis,2010,74(4):192-194.
[3]Rodilla E,Pascual JM,Costa JA,et al.Regression of left ventricular hypertrophy and microalbuminuria changes during antihypertensive treatment[J].J Hypertens,2013,31(8):1683-1691.
[4]Li J,Ichikawa T,Villacorta L,et al.Nrf2 protects against maladaptive cardiac responses to hemodynamic stress[J].Arterioscler Thromb Vasc Biol,2009,29(11):1843-1850.
[5]Li J,Zhang C,Xing Y,et al.Up-regulation of p27(kip1) contributes to Nrf2-mediated protection against angiotensin II-induced cardiac hypertrophy[J].Cardiovasc Res,2011,90(2):315-324.
[6]Thuong PT,Pokharel YR,Lee MY,et al.Dual anti-oxidative effects of fraxetin isolated from Fraxinus rhinchophylla[J].Biol Pharm Bull,2009,32(9):1527-1532.
[7]Jiang JH,Jin CM,Kim HS,et al.Anti-toxoplasmosis effects of oleuropein isolated from Fraxinus rhychophylla[J].Biol Pharm Bull,2008,31 (12):2273-2276.
[8]OkaT,KomuroI.Molecularmechanismsunderlyingthetransitionofcardiachypertrophytoheartfailure[J].Circ J,2008,72 Suppl A:13-16.
[9]Mishra S,Ling H,Grimm M,et al.Cardiac hypertrophy and heart failure development through Gq and CaM kinase II signaling[J].J Cardiovasc Pharmacol,2010,56(6):598-603.
[10]Hohensinner PJ,Kaun C,Rychli K,et al.The inflammatory mediator oncostatin M induces stromal derived factor-1 in human adult cardiac cells[J].FASEB J,2009,23(3):774-782.
[11]Jiang QS,Huang XN,Yang GZ,et al.Cardiac hypertrophy induced by prostaglandin F2α may be mediated by calcineurin signal transduction pathway in rats[J].Sheng Li Xue Bao,2005,57 (6):742-748.
[12]Vega RB,Harrison BC,Meadows E,et al.Protein kinases C and D mediate agonist-dependent cardiac hypertrophy through nuclear export of histone deacetylase 5[J].Mol Cell Biol,2004,24(19):8374-8385.
[13]Ruchi P,Rebecca HR,Lgor R,et al.Phenylephrine induced hypertrophy in neonatal cardiac myocytes is modulated by testosterone[J].J Mol Cell Cardiol,2007,42(6):138
[14]Yeh JL,Hsu JH,Wu PJ,et al.KMUP-1 attenuates isoprenaline-induced cardiac hypertrophy in rats through NO/cGMP/PKG and ERK1/2/calcineurin A pathways[J].Br J Pharmacol,2010,159(5):1151-1160.
[15]Yu L,Li M,She T,et al.Endothelin-1 stimulates the expression of L-type Ca2+channels in neonatal rat cardiomyocytes via the extracellular signal-regulated kinase 1/2 pathway[J].J Membr Biol,2013,246(4):343-353.
[16]Matsumoto E,Sasaki S,Kinoshita H,et al.Angiotensin II-induced cardiac hypertrophy and fibrosis are promoted in mice lacking Fgf16[J].Genes Cells,2013,18(7):544-553.
[17]Patel BM,Mehta AA.Aldosterone and angiotensin:Role in diabetes and cardiovascular diseases[J].Eur J Pharmacol,2012,697(1/3):1-12.
Effect of fraxetin on cardiomyocyte hypertrophy induced by phenylephrine
ChengKuoju1,JingSheng2
(1.DepartmentofPharmacy,DazhouCityHospitalofIntegratedTraditionalandWesternMedicine,Dazhou,Sichuan635000,China;2.DepartmentofAnesthesiology,XinqiaoHospitalAffliatedtotheThirdMilitaryMedicalUniversity,Chongqing400037,China)
Objective To investigate the effect of fraxetin on primary cardiomyocyte hypertrophy induced by phenylephrine.Methods Primary SD cardiomyocyte hypertrophy was induced by phenylephrine,and we observed the effects of fraxetin on cardiomyocyte hypertrophy induced by phenylephrine.Image-ProPlus 5 measured the area of cardiomyocyte;[3H]-leucine incorporation assay detected the protein synthesis rate of cardiomyocyte;Real-time PCR measured the Nrf2 and molecular markers (ANP,BNP) mRNA expression levels of cardiomyyocyte hypertrophy.Results (1)Primary neonate SD Cardiomyocyte hypertrophy model was successfully established by 80 μmol/L phenylephrine for 48 h,and Nrf2 expression levels significantly increased in cardiomyocyte hypertrophy model;(2)The increase of cardiomyocyte area,protein synthesis rate and molecular markers expression of cardiomyyocyte hypertrophy were significantly inhibited by fraxetin in a dose-dependent manner.Conclusion Fraxetin could significantly inhibit the cardiomyyocyte hypertrophy induced by PE.
cardiomyocytes;deoxye pine phrine;fraxetin;Nrf2
程阔菊(1984-),药师,硕士,主要从事心肌保护方向研究。
10.3969/j.issn.1671-8348.2015.02.010
R966
A
1671-8348(2015)02-0174-03
2014-07-12
2014-10-22)
