p47phox介导活性氧产生与疾病的关系*
2015-03-14张玲萍综述董文斌审校
张玲萍 综述,董文斌审校
(泸州医学院附属医院新生儿科,四川泸州646000)
活性氧(reactive oxygen species)是指氧自由基和氧化作 用较强的非自由基含氧产物。主要包括超氧阴离子(·O2-)、羟自由基 (·OH)、过氧化氢(H2O2)和单线态氧(1O2)等[1]。活性氧在机体的免疫过程和细胞信号转导中起着重要的作用。然而当活性氧过多积聚,超过抗氧化酶系统的清除能力,就会产生氧化应激。引发脂质过氧化反应损伤细胞膜、引起蛋白质变性、酶活性丧失等损害作用[2-3];诱导或加重心血管疾病、高血压、肿瘤、炎症及肺部疾病的发生和进展[4]。机体有多种酶体参与活性氧的生成,如烟酰胺腺嘌呤二核苷酸磷酸 (nicotinamide adenine dinucleotide phosphate,NADPH)氧 化 酶(NADPH oxidase,NOX)、线粒体呼吸链复合酶、黄嘌呤氧化酶、细胞色素P450、一氧化氮合成酶等[1,3]。其中 NADPH 氧化酶是体内活性氧生成的重要来源。而p47phox对于激活NADPH氧化酶起着至关重要的作用。本文主要从p47phox介导活性氧产生及与疾病的关系方面的进展作一综述。
1 p47phox的结构
1964年,Rossi和Zatti在吞噬细胞中首次发现了与呼吸爆发有关的NADPH氧化酶。1973年Babior第一次证实了NADPH氧化酶是与活性氧产生有关的一种酶复合体,它被激活后,可以在短时间内产生大量的活性氧。吞噬细胞NADPH氧化酶是由多亚基构成的酶复合体,它的催化亚基GP91phox又被称作NADPH氧化酶2(NOX2)[5]。随着研究的进展,在不同的非吞噬细胞中发现了GP91phox的同源物,分别称为:NOX1、NOX3、NOX4、NOX5、DUOX1、DUOX2,后来被命名为NOX蛋白家族[6]。
吞噬细胞NADPH氧化酶是由多个亚基构成的。包括胞膜组分GP91phox(NOX2)和p22phox结合而形成的异源二聚体细胞色素b558;胞质组分:p40phox、p47phox、p67phox和小分子的GTP结合蛋白Rac-1或Rac-2(单核细胞为Rac-1,嗜中性粒细胞为Rac-2)。其中反应吞噬细胞NADPH氧化酶活性的重要亚基p47phox是胞质与胞膜组分之间的连接蛋白,由390个氨基酸组成。其氨基酸序列N末端有一个Phox同源结构域(phox homology,PX),位于氨基酸序列的第4~121。在p47phox磷酸化后,能够被释放,与3,4-二磷酸磷脂和磷脂酸结合,有助于膜定位和NADPH氧化酶的组装;p47phox氨基酸的中间序列包含2个Src同源3结构域(Src homology 3,SH3)。SH3A位于氨基酸序列的159~214,SH3B位于序列的229~284。SH3A和SH3B之间形成一个浅槽,构成肽链结合面。当细胞处于静息状态时,这个位点由自动抑制区占领,以保持细胞处于自动抑制状态,当p47phox被激活后,这个位点则由胞质组分p22phox的富含脯氨酸的区域(PRR)占领,以保持胞质组分与胞膜组分的结合。p47phox的C末端则包含1个 自 动 抑 制 区 (auto-inhibitory region,AIR)和 至 少 1 个PRR,p47phox的PRR能与p67phoxC末端的SH3域结合,实现胞质组分的组装[7],见图1(图1参照文献[8]绘制)。

图1 p47phox的结构
2 p47phox介导活性氧产生的机制
吞噬细胞NADPH 氧化酶在静息状态下没有活性或者只产生少量具有生理作用的活性氧。当机体受到炎症因子、生长因子、钙离子(Ca2+),以及重金属、部分药物等刺激后会被激活,产生大量的活性氧[9-10]。有研究证实,心肌细胞在缺血的状态下,细胞内活性氧明显升高,并且p47phox蛋白的表达与活性氧升高程度是相吻合的[11]。当人脐静脉内皮细胞受到20 mmol/L的高浓度葡萄糖刺激以后,活性氧的水平较对照组(正常培养基培养)明显增加,同时胞质组分p47phox在胞膜区域有高表达现象[12]。而在吞噬细胞NADPH氧化酶受药理抑制或存在p47phox基因缺失的动物模型中,血管的氧化应激是减少的[13-14]。
众多研究证明,p47phox是与吞噬细胞NADPH氧化酶活性有关的重要调节因子。当机体在细胞因子、激素、炎症等因素的刺激下,p47phox发生磷酸化,其构象发生改变,分子间的紧密结合打开,自动抑制区被释放,SH3域和PX域暴露出来。接着p47phox富含脯氨酸区域与p67phoxC末端的SH3区结合,而p67phoxN末端能与Rac、p40phox结合,这就使胞质亚基形成了一个复合体。当p47phox完成与胞质组分的结合后,便开始了磷酸化的p47phox携带p67phox、p40phox和Rac靠近胞膜。最后p47phox利用N末端2个SH3域之间浅槽样的肽结合位点与胞膜组分p22phox的富含脯氨酸区域结合,最终实现了胞质复合体与胞膜复合体在细胞膜上的组装。这个过程中多个亚基复杂整合,从而激活了NADPH氧化酶。活化后的NADPH氧化酶在质膜胞质面能够将电子传递给还原型NADPH,从而将氧分子还原形成单线态氧(2O2+NADPH→2O2-+NADP+H+)[15-17],见图2。
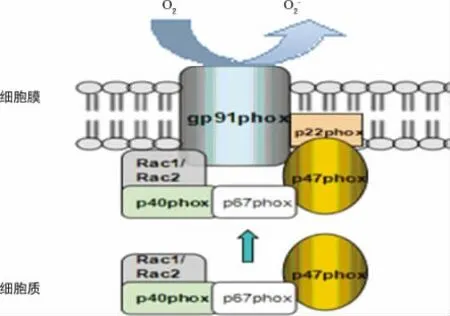
图2 NADPH氧化酶活化的机制
3 p47phox与疾病
慢性肉芽肿病(chronic granulomatous disease,CGD)是一种吞噬细胞功能障碍的原发性免疫缺陷病。CGD患儿由于基因突变引起NADPH氧化酶复合物缺陷,使得NADPH氧化酶不能正常活化,产生超氧化物,以杀伤过氧化物酶阳性细菌与真菌。因而出现严重的、反复的细菌和真菌感染。编码NADPH 氧化酶亚单位gp91phox、p22phox、p47phox、p67phox的基因分别是CYBB(Xp21)、CYBA(16q24)、NCF1(7q11)、NCF2(1q25)。其中70%的CGD患儿是由于CYBB基因突变而致gp91phox缺乏所引起的。而引起这个疾病第2位的原因是p47phox的缺乏,约占25%;这种突变类型绝大多数患者NCF1基因缺失2bp,是由野生型基因和假基因重组导致的,患者的p47phox蛋白表达表现出检测不到的水平。目前,要根治CGD的唯一方法是免疫重建,包括干细胞移植和基因治疗。在英美国家,已有p47phox CGD患者基因治疗成功的报道[18]。
动脉粥样硬化(atherosclerosis,AS)的氧化学说认为,低密度脂蛋白的氧化修饰在促进AS的形成中起到非常关键的作用。它可以摄取巨噬细胞、刺激内皮细胞多种炎性因子和黏附分子表达、诱导平滑肌细胞增生。此外,它作为氧化因子诱导的氧化应激反应也会损伤血管平滑肌细胞和内皮细胞,在高血压、糖尿病、高脂血症等引起的动脉粥样硬化的发病机制中起重要的作用。NADPH氧化酶是血管内活性氧的主要来源,也被证实为是AS进展中活性氧产生的重要来源。p47phox调节NADPH氧化酶活化可产生大量的活性氧,当超过机体的清除能力时,过多的活性氧可以通过增加钙离子水平激活胞内信号通路、改变细胞内的氧化还原状态、上调血管炎性分子的表达、促进平滑肌细胞增殖和低密度脂蛋白的氧化修饰、引起血管收缩性改变,最终导致AS的发生与发展[13]。
类风湿性关节炎(rheumatoid arthritis,RA)是一种慢性炎症和自身免疫性疾病,最常受累的是关节,表现为多个关节的滑膜增生和关节软骨的破坏。NADPH氧化酶参与了RA的炎性反应过程。在关节炎患者关节滑液中含有大量的中性粒细胞和巨噬细胞,在中性粒细胞中,发现磷酸化的p47phox和NADPH氧化酶活性高度增加。并且,在体外培养RA病理变化的主要功能细胞-成纤维细胞样滑膜细胞(fibroblast-like synoviocyte,FLS)的实验中,晚期氧化蛋白产物(advanced oxidation protein products,AOPP)处理FLS,使得FLS内 NADPH氧化酶被激活,活性氧显著增加,NADPH氧化酶源性活性氧可以帮助AOPP刺激下游信号,诱导FLS释放肿瘤坏死因子-α(TNF-α)、IL-1β、基质金属蛋白酶(MMPS)等细胞因子。加剧关节的炎性反应和软骨的侵蚀,加速RA的进展。而在NADPH氧化酶的激活过程中p47phox起着关键的作用[19]。
肝纤维化是慢性肝损伤常见的后果,也是世界范围内引起死亡的一个重要的原因。肝内不同细胞产生的活性氧在肝纤维化进程中起着重要的作用,包括肝星状细胞、枯否细胞和肝细胞,它们均表达NADPH氧化酶,因此NADPH氧化酶是肝脏内活性氧的重要来源。当机体受到血管紧张素Ⅱ、纤维化的细胞因子等刺激时,可以诱导p47phox发生磷酸化,进而产生活性氧。将小鼠的p47phox基因敲除,再结扎小鼠的胆管(bile duct ligation,BDL)21d,使之出现典型的胆汁淤积型肝损伤;或是给予小鼠肝毒性四氯化碳(CCl4)注射使之出现中毒性肝损伤。本研究发现,p47phox基因敲除的小鼠与野生型小鼠相比,肝纤维化参数明显更低。可见p47phox基因缺乏的小鼠能抵抗这2种损伤模型诱导的肝纤维化,反之,p47phox在肝纤维化进程中是起着重要的作用[20]。
很多肺部疾病的发病机制也与NADPH氧化酶有关的。在肺血管内皮细胞内表达吞噬细胞NADPH氧化酶,这有助于高氧诱导活性氧生成,促进炎性反应发生和组织损伤。在野生型小鼠的实验中,观察到高氧诱导小鼠出现肺水肿和中性粒细胞浸润,而在敲除吞噬细胞NADPH氧化酶基因的小鼠中,这种反应是更轻的。这提示吞噬细胞NADPH氧化酶源性活性氧和急性肺损伤之间有一定的关系。另外,在小鼠肺纤维化损伤模型的进展中需要p47phox的参与,这种纤维化的进程和炎性反应有关。通过对p47phox基因敲除小鼠的研究,将有助于本研究更加深入了解p47phox介导的活性氧在肺纤维化中的作用[21]。
4 p47phox激活NADPH氧化酶的抑制剂
吞噬细胞NADPH氧化酶源性活性氧是机体多个器官活性氧的主要来源。当机体受到生长因子,血管紧张素Ⅱ等刺激时,p47phox发生磷酸化,分子构象发生改变,紧接着引起NADPH氧化酶多个亚基的复杂整合,激活NADPH氧化酶,产生大量的活性氧。过多的活性氧能诱导或加重动脉粥样硬化、高血压、类风湿性关节炎、肝纤维化等疾病的发生或发展,在这些疾病的基础病理变化中有着不容忽视的作用。因此,需要从源头上阻止活性氧过多产生,控制氧化应激。所以,本研究有更多的理由靶向吞噬细胞NADPH氧化酶,通过对其组织者p47phox功能的抑制,来阻止过多活性氧的产生。
由p47phox与活性氧产生的机制出发,可以从多种途径阻断p47phox激活吞噬细胞NADPH氧化酶,从而减少活性氧的产生。这些途径包括:(1)阻止或减少p47phox的磷酸化。目前已有研究发现胶霉毒素可以阻止蛋白激酶C定位到p47phox,来抑制p47phox的磷酸化[22]。(2)干扰p47phox携带胞质组分向胞膜移位。罗红霉素可能会干扰胞质成分移位到胞 膜[23],从 而 阻 断 NADPH 氧 化 酶 的 激 活。(3)抑 制p47phox与胞膜复合体细胞色素b558结合。PR-39能与p47phox的SH3域绑定,阻止p47phox与p22phox结合,这也就阻断了胞质复合体与胞膜复合体的组装,抑制了NADPH氧化酶的激活[24]。除此之外,目前还发现牛磺酸氯胺,夹竹桃麻素等物质能从多个环节阻止NADPH氧化酶的激活,减少活性氧生成[16,25]。目前,对这些抑制剂的研究,虽然还未进入临床阶段,但对疾病的治疗将提供一个新的靶点。
5 展 望
p47phox是吞噬细胞NADPH氧化酶的一个亚单位,也是调节吞噬细胞NADPH氧化酶活性的重要亚基,在NADPH氧化酶源性活性氧的产生中有至关重要的作用。它主要是通过携带胞质复合体向胞膜移位来调节活性氧的生成量。通过对这种机制的认识,有助于本研究从源头上控制过多活性氧的产生,这对于预防心血管疾病的发生或其他多种氧化应激损伤性疾病是非常有利的。然而,在研究p47phox激活NADPH氧化酶的抑制剂方面,本研究还有很多的未知需要开拓,还有很长的路需要去探索,以期积累更多知识,为临床预防和治疗氧化损伤提供更多的理论支撑。
[1] Strzelczyk JK,Wiczkowski A.Oxidative damage and carcinogenesis[J].Wspolczesna Onkol,2012,16(3):230-233.
[2] 卢美燕,董文斌.氧化应激在高体积分数氧肺损伤中的作用[J].实用儿科临床杂志,2012,27(22):1763-1765.
[3] 魏燕,辛晓燕.活性氧调控的细胞凋亡信号[J].现代肿瘤医学,2011,19(2):371-373.
[4] 韩晓燕.NADPH氧化酶NOX家族与疾病的关系[J].国际病理科学与临床杂志,2010,30(6):513-517.
[5] Bedard K,Krause KH.The NOX family of ROS-generating NADPH oxidases:physiology and pathophysiology[J].Physiol Rev,2007,87(1):245-313.
[6] Maghzal GJ,Krause KH,Stocker R,et al.Detection of reactive oxygen species derived from the family of NOX NADPH oxidases[J].Free Radic Biol Med,2012,53(10):1903-1918.
[7] Marcoux J,Man P,Petit-Haertlein I,et al.p47phox molecular activation for assembly of the neutrophil NADPH oxidase complex[J].J Biol Chem,2010,285(37):28980-28990.
[8] El-Benna J,Dang PM,Gougerot-Pocidalo MA,et al.p47phox,the phagocyte NADPH oxidase/NOX2organizer:structure,phosphorylation and implication in diseases[J].Exp Mol Med,2009,41(4):217-225.
[9] 王威,唐圣松.吞噬细胞NADPH氧化酶活性的调控[J].国际病理科学与临床杂志,2009,29(4):318-323.
[10]Casbon AJ,Long ME,Dunn KW,et al.Effects of IFN-γ on intracellular trafficking and activity of macrophage NADPH oxidase flavocytochrome b558[J].J Leukoc Biol,2012,92(4):869-882.
[11]Hahn NE,Meischl C,Wijnker PJ,et al.NOX2,p22phox and p47phox are targeted to the nuclear pore complex in ischemic cardiomyocytes colocalizing with local reactive Oxygen species[J].Cell Physiol Biochem,2011,27(5):471-478.
[12]王蕾,吴和平,舒筱灿,等.p47phox向胞膜移位调节高糖导致的内皮细胞内活性氧升高[J].医学研究杂志,2011,40(7):65-67.
[13]Jackman KA,Miller AA,De Silva TM,et al.Reduction of cerebral infarct volume by apocynin requires pretreatment and is absent in Nox2-deficient mice[J].Br J Pharmacol,2009,156(4):680-688.
[14]Fan LM,Teng L,Li JM.Knockout of p47phox uncovers a critical role of p40phox in reactive oxygen species production in microvascular endothelial cells[J].Arterioscler Thromb Vasc Biol,2009,29(10):1651-1656.
[15]Kleniewska P,Piechota A,Skibska B,et al.The NADPH oxidase family and its inhibitors[J].Arch Immunol Ther Exp(Warsz),2012,60(4):277-294.
[16]Drummond GR,Selemidis S,Griendling KK,et al.Combating oxidative stress in vascular disease:NADPH oxidases as therapeutic targets[J].Nat Rev Drug Discov,2011,10(6):453-471.
[17]Van Der Vliet A.NADPH oxidases in lung biology and pathology:host defense enzymes,and more[J].Free Radic Biol Med,2008,44(6):938-955.
[18]Wada T,Muraoka M,Toma T,et al.Rapid detection of intracellular p47phox and p67phox by flow cytometry;useful screening tests for chronic granulomatous disease[J].J Clin Immunol,2013,33(4):857-864.
[19]Zheng S,Zhong ZM,Qin S,et al.Advanced oxidation protein products induce inflammatory response in fibroblast-like synoviocytes through NADPH oxidase-dependent activation of NF-κB[J].Cell Physiol Biochem,2013,32(4):972-985.
[20]De Minicis S,Seki E,Paik YH,et al.Role and cellular source of nicotinamide adenine dinucleotide phosphate oxidase in hepatic fibrosis[J].Hepatology,2010,52(4):1420-1430.
[21]Bernard K,Hecker L,Luckhardt TR,et al.NADPH oxidases in lung health and disease[J].Antioxid Redox Signal,2014,20(17):2838-2853.
[22]Tsunawaki S,Yoshida LS,Nishida S,et al.Fungal metabolite gliotoxin inhibits assembly of the human respiratory burst NADPH oxidase[J].Infect Immun,2004,72(6):3373-3382.
[23]Abdelghaffar H,Babin-Chevaye C,Labro MT.The macrolide roxithromycin impairs NADPH oxidase activation and alters translocation of its cytosolic components to the neutrophil membrane in vitro[J].Antimicrob Agents Chemother,2005,49(7):2986-2989.
[24]Shi J,Ross CR,Leto TL,et al.PR-39,aproline-rich antibacterial peptide that inhibits phagocyte NADPH oxidase activity by binding to Src homology 3domains of p47 phox[J].Proc Natl Acad Sci U S A,1996,93(12):6014-6018.
[25]Kinkade K,Streeter J,Miller FJ.Inhibition of NADPH oxidase by apocynin attenuates progression of atherosclerosis[J].Int J Mol Sci,2013,14(8):17017-17028.
