吸烟对全身麻醉的病人体温及体温调节性周围血管收缩反应的影响
2015-06-01王明玲郑利民王焱林
王明玲,郑利民*,王焱林,黄 飞
(1.北京大学深圳医院麻醉科,深圳518036;2.武汉大学中南医院麻醉科,武汉430071)
吸烟对全身麻醉的病人体温及体温调节性周围血管收缩反应的影响
王明玲1,郑利民1*,王焱林2,黄 飞1
(1.北京大学深圳医院麻醉科,深圳518036;2.武汉大学中南医院麻醉科,武汉430071)
目的 探讨全身麻醉下吸烟病人体温与体温调节性周围血管收缩反应的变化。方法 全身麻醉下行择期开腹手术的成年男性病人23例(ASA1-2级),分为吸烟组(S组,n=12)与对照组(C组,n=11)。S组患者烟龄13.58 ±8.38年、吸烟量17.08±5.82支/日,C组患者无吸烟史,其他情况同S组;两组麻醉诱导相同,即用丙泊酚1-2mg/kg、芬太尼4μg/kg、维库溴铵0.1mg/kg,气管插管后行间歇正压通气(IPPV),维持PETCO235-40mmHg,麻醉维持用1-2%异氟烷,0.08-0.12μg/kg/min瑞芬太尼,0.1-0.2mg/kg/h维库溴铵;监测食道温(TES)、平均皮肤温(TMSK)、前臂-指尖皮肤温度差(TFOR-FIN)。以TFOR-FIN=0℃时的TES作为体温调节性周围血管收缩阀值(threshold),以阈值下TES与TFOR-FIN间的线性回归斜率作为其增益(gain)。结果 两组患者一般情况、血流动力学指标及麻醉诱导前(T0)TES、TMSK、食道-平均皮肤温度差(TES-MSK)、TFOR-FIN无统计学差异(P>0.05);TES:与T0比,C组T20至T180、S组T10至T180显著下降(P<0.05、P<0.01);组间比较,S组T20至T180显著低于C组(P<0.05、P<0.01),S组threshold显著低于C组(P<0.01)。结论 全身麻醉下长期吸烟病人食道温及体温调节性血管收缩阈值显著下降,易出现低体温的并发症,全身麻醉时对吸烟病人更应加强体温的监测与管理。
全身麻醉;吸烟;体温调节
(Chin J Lab Diagn,2015,19:0961)
低体温是全身麻醉时常见并发症。全身麻醉时,行为性体温调节反应与寒战反应受到抑制,周围血管收缩是最重要的体温调节反应[1]。文献报道,吸烟不仅可直接影响体温调节中枢,而且还可损害血管功能[2,3],我们推测它有可能加重全身麻醉期间的低体温,但目前尚未见相关的临床报道。本研究的目的是探讨长期(烟龄≧5年)、大量(吸烟量≧10支/日)吸烟病人在全身麻醉下体温及体温调节性周围血管收缩反应的变化。
1 资料与方法
1.1 病例选择与分组 全身麻醉下行择期开腹手术的成年男性病人23例(ASA1-2级),麻醉手术时间超过180min。分为吸烟组(S组,n=12)与对照组(C组,n=11)。S组为吸烟病人,吸烟量≧10支/日,烟龄≧5年,烟草品牌不限,但不添加薄荷醇。C组为与S组同期手术的不吸烟病人。本研究除外合并循环、神经、呼吸、内分泌系统疾病,发热,术前二周服用血管活性药物及目前所知的有可能影响体温调节的药物的病人。
1.2 方法 本研究通过北京大学深圳医院伦理委员会批准,并取得病人及其家属的同意。术前禁食超过8h,术前不用镇静及抗胆碱药。为除外体温日间波动的影响,所有手术均在9:00时到13:00时之间进行。手术室温度保持在23℃、湿度40%。入手术室后平卧位,采用多功能监测仪(美国1700型,Spacelabs公司)监测常规监测Ⅱ导联心电图(ECG)、心率(HR)、血压(SBP/DBP)、脉搏氧饱和度(SpO2)、呼气末二氧化碳(PETCO2)、桡动脉置管监测平均动脉压(MAP);桡动脉测压同侧的上肢静脉穿剌,作为静脉注药及输液通道。不在测温的肢体测血压、输液。开始输注液为加温至38℃的乳酸林格液,初始输注速度为10ml/kg/h,麻醉手术开始后另根据病人情况适当增减输液速度及输注6%中分子羟乙基淀粉130/0.4氯化钠液。麻醉诱导用丙泊酚1-2mg/kg,芬太尼4μg/kg,维库溴铵0.1 mg/kg,气管插管后接呼吸机行间歇正压通气(IPPV),潮气量(VT)8-12ml/kg,频率10-15次/分,维持PETCO235-40mmHg。麻醉维持用1-2%异氟烷,瑞芬太尼0.08-0.12μg/kg/min,维库溴铵0.1-0.2mg/kg/h。
连续监测食道温及胸壁、大腿、前臂、指尖皮肤温。食道温(TES)采用YSI-REF701食道温探头(YSI公司,英国)经鼻插入食道下段测定,插入深度为身高的四分之一。皮肤温测定采用YSI-709B皮肤温探头(YSI公司,英国),按文献报道的方法分别安放于前胸壁、大腿中段内侧面、前臂前侧面、食指指尖腹侧。术中常规覆盖手术铺巾,不进行保温处理,不输注氨基酸、果糖等有可能增加产热的药物。以麻醉诱导前为对照值(T0),于麻醉诱导后每隔10min记录体温及血压、心率的变化,直到诱导后180min(T180)。
1.3 观察指标 ①食道温(TES)、平均皮肤温(TMSK)及食道-平均皮肤温度差(TES-MSK)。以TES作为核心温,以TMSK作为周围温,TES-MSK表示核心温与周围温度差。TMSK采用Roberts[4]推荐的三点法监测与计算:TMSK=0.43×胸壁皮肤温+0.25×上臂皮肤温+0.32×大腿皮肤温。Nakajima报道[5],上臂皮肤温与前臂皮肤温间无显著性差异,故本研究采用前臂皮肤温代替上臂皮肤温。②前臂-指尖皮肤温度差(TFOR-FIN)与体温调节性周围血管收缩阀值(threshold)及其增益(gain)。以麻醉手术期间TFOR-FIN=0℃时的TES作为threshold,以阈值下TES(自变量)与TFOR-FIN(应变量)间的线性回归斜率(采用加权最小二乘法)作为gain。③血流动力学稳定指数及平均动脉压(MAP)、心率(HR)。血流动力学稳定指数按以下公式计算:血流动力学稳定指数=4×A+6×B+5×C,其中,A为麻醉期间收缩压最高值与最低值之差;B为麻醉后期收缩压最高值与最低值之差,我们取麻醉诱导后120min(T120)至180min(T180)时段的数据;C为麻醉期间HR最高值与最低值之差。
1.4 统计学处理 采用SPSS13.0统计学软件。正态分布的计量资料以均数±标准差(±s)表示,组内比较采用重复测量数据的方差分析,组间比较用两样本t检验。非正态分布的计量资料用中位数(四分位数间距)[M(Q)]表示。计数资料用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 两组患者年龄、身高、体重、体重指数、输液量、出血量、TFOR-FIN=0℃时呼气末异氟烷浓度及手术内容无显著性差异(见表1)。全部病人麻醉手术时间均超过180min,避免了麻醉苏醒期体温调节反应变化所带来的影响;S组(吸烟组)烟龄13.58±8.38年(5-30年)、吸烟量17.08±5.82支/日(10-30支/日),术前禁烟时间(最后一次吸烟至进入手术的时间)10.08±10.68天(1-30天)。
2.2 血流动力学指标的比较 两组诱导前、诱导后及麻醉维持中各时间点的血流动力学指标组间比较无统计学差异(P>0.05)。
表1 两组患者一般情况比较(±s)
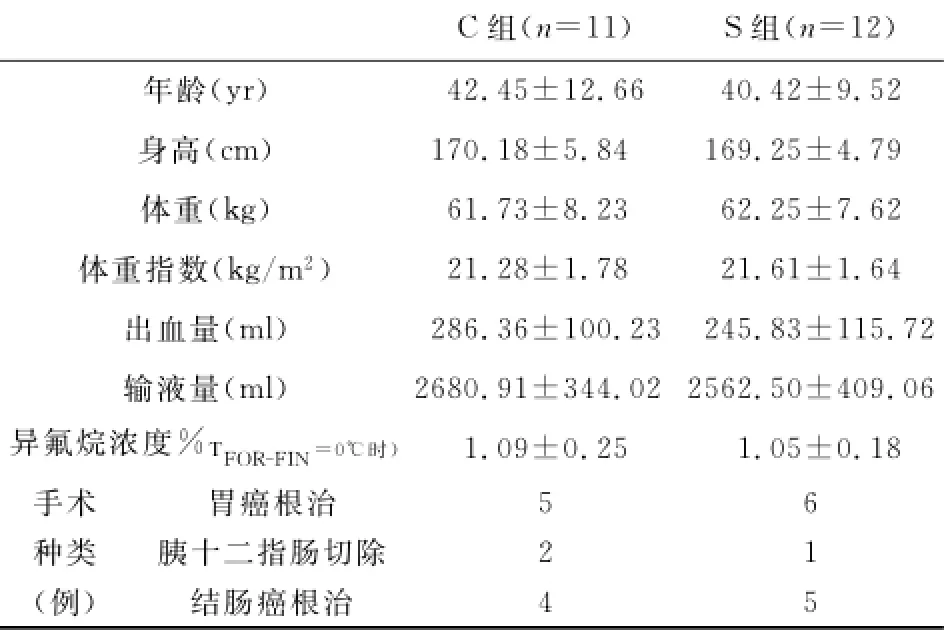
表1 两组患者一般情况比较(±s)
C组(n=11)S组(n=12)年龄(yr)42.45±12.66 40.42±9.52身高(cm)170.18±5.84 169.25±4.79体重(kg)61.73±8.23 62.25±7.62体重指数(kg/m2)21.28±1.78 21.61±1.64出血量(ml)286.36±100.23 245.83±115.72输液量(ml)2680.91±344.02 2562.50±409.06异氟烷浓度%TFORFIN=0℃时)1.09±0.25 1.05±0.18-手术胃癌根治5 6种类胰十二指肠切除2 1(例)结肠癌根治4 5
表2 两组患者体温调节性血管收缩阈值及其增益的改变(±s)

表2 两组患者体温调节性血管收缩阈值及其增益的改变(±s)
与C组比,**P<0.01
n threshold(℃)gain C组9 35.48±0.18 6.57±2.31 S组7 34.89±0.20**6.83±1.68
2.3 体温的变化 两组诱导前(T0)TES、TMSK、TES-MSK、TFOR-FIN基本相同(P>0.05)。TES:与T0比,C组T20至T180、S组T10至T180显著下降(P<0.05、P<0.01);组间比较,S组T20至T180显著低于C组(P<0.05、P<0.01)。TMSK:与T0相比,S组T30至T180、C组T90至T180显著升高(P<0.05、P<0.01);组间比较,除T60及T110S组显著高于C组(P<0.05)外,余无显著性差异(P>0.05)。TES-MSK:与T0比,C组T20至T180、S组T10至T180显著下降(P<0.05、P<0.01);组间比较,S组T30至T180显著低于C组(图1-4)。
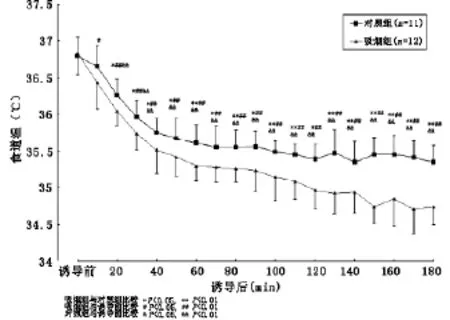
图1 两组患者食道温(TES)的变化
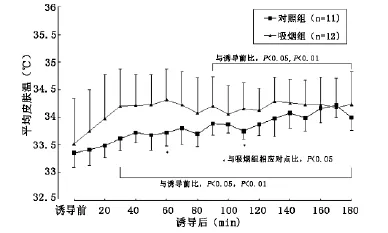
图2 两组患者平均皮肤温(TMSK)的变化
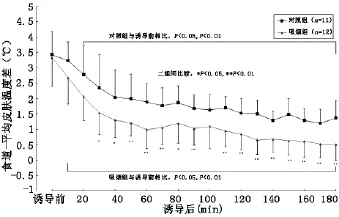
图3 两组患者食道-平均皮肤温度差(TES-MSK)的变化
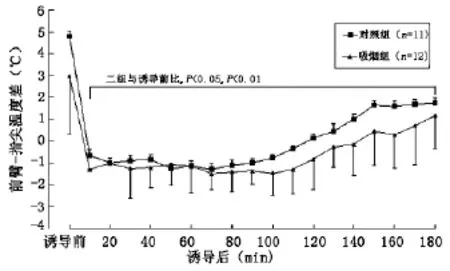
图4 两组患者前臂-指尖温度差(TFOR-FIN)的变化
2.4 血管收缩阈值(threshold)及其增益(gain)的变化 剔除在观察期间TFOR-FIN未达到0℃标准的病例:C组2例(18.2%)、S组5例(41.7%)。统计学分析S组threshold显著低于C组(P<0.01),组间gain无统计学差异(表2)。
3 讨论
全身麻醉时体温调节反应受麻醉用药、环境温度、代谢率、血流动力学变化、麻醉手术时间及年龄、性别等诸多因素的影响[1]。TES与主动脉血温有着良好的相关性[2],通常被作为核心温度。TFOR-FIN值与手指血流量有着良好的相关性[TFOR-FIN=0.2-5.7log(血流量),r=0.98],且比单独的指尖温度受环境的影响较少,是测量体温调节性外周血管收缩的简便、准确方法[5]。
本研究采用Sessler等推荐并广泛应用于临床体温研究的TFOR-FIN=0℃时的TES作为体温调节性血管收缩阈值[5]。结果显示二组病人TES均呈典型的全身麻醉后三相变化,即TES显著下降,TMSK显著升高,TES-MSK显著下降。但吸烟组TES与TES-MSK在诱导后后30min至180min时显著低于对照组,说明与不吸烟者相比,吸烟病人在全身麻醉后核心温更低。且吸烟组血管收缩阈值显著也低于对照组,表明全身麻醉下吸烟病人需要更低的核心温才能触发周围血管收缩性体温调节反应,其周围血管收缩性体温调节反应性减弱。
周围血管收缩性受丘脑下部体温调节中枢的控制,对全身麻醉下的体温调节起着重要作用[1]。吸烟引起这一体温调节反应减弱的原因尚不甚清楚,我们推测:①可能与烟碱长期作用于体温调节中枢的受体与神经递质改变有关。研究证明,烟碱可直接作用于体温调节中枢烟碱型胆碱能受体(nAChR),使血管扩张,促进散热,引起体温下降。长期吸烟还可致体温调节中枢nAChR与毒蕈碱型胆碱能受体(mAChR)功能与结构发生改变。此外,研究还证明吸烟与烟碱对去甲肾上腺素、多巴胺、5-羟色胺(5-HT)、乙酰胆碱、前列腺素E1和α促黑素(αMSH)、精氨酸加压素(AVP)等参与体温调节的神经介质或神经肽有影响[6--8]。②可能与吸烟致血管功能障碍有关。研究表明:影响血管舒缩功能的药物(如:硝苯吡啶、PGE1、多巴酚丁胺等)均可影响病人的体温调节[1]。另有研究表明吸烟可损害血管内皮细胞,引起血管舒缩功能障碍[9]。无任何心血管症状的长期吸烟者,其体循环血管阻力显著增加[10];吸烟者在停止吸烟10年后脉搏波传导速度(PWV)才恢复到正常水平[11]。因此,周围血管的功能受损可能也是其原因之一。
本研究结果表明全身麻醉下长期吸烟病人食道温及体温调节性血管收缩阈值较不吸烟者显著下降,易出现低体温,故全身麻醉时对吸烟病人更应加强体温的监测与管理。
[1]Sessler DI.Temperature monitoring and perioperative thermoregulation[J].Anesthesiology,2008,109:318.
[2]马长生.吸烟与心血管疾病[J].中华内科杂志,2008,47:405.
[3]Lavi S,Prasad A,Yang EH,et al.Smoking is associated with epicardial coronary endothelial dysfunction and elevated white blood cell count in patients with chest pain and early coronary artery disease[J].Circulation,2007,115:2621.
[4]Roberts MF,Wenger CB,Stolwijk JA,et al.Skin blood flow and sweating changes following exercise training and heat acclimation[J].J Appl Physiol,1977,43:133.
[5]Sessler DI.Perioperative heat balance[J].Anesthesiology,2000,92:578.
[6]汪 海,张蜀平.中枢N受体对M受体介导体温降低作用的调节[J].中国药理学与毒理学杂志,1996,10:28.
[7]Xu Z,Seidler FJ,Ali SF,et al.Fetal and adolescent nicotine administration:efects on CNS serotonergie systems[J].Brain Res,2001,914:166.
[8]Marty MA,Erwin VG,Cornell K,et al.Effects of nicotine on beta-endorphin,alpha MSH,and ACTH secretion by isolated perfused mouse brains and pituitary glands,in vitro[J].Pharmacol Biochem Behav,1985,22:317.
[9]周晓梅,齐保申,徐成丽,等.长期吸烟对心血管功能和血脂水平的影响[J].中国预防医学杂志,2004,5:422.
[10]Jatoi NA,Jerrard-Dunne P,Feely J,et al.Impact of smoking and smoking cessation on arterial stiffness and aortic wave reflection in hypertension[J].Hypertension,2007,49:981.
[11]Piha SJ,Seppanen A.Attenuated Valsalva heart rate response in subjects with smoking history:possible role of autonomic dysfunction[J].Clin Physiol,1993,13:51.
Effect of smoking on temperature and thermoregulatory peripheral vasoconstriction in patients under general anesthesia
WANG Ming-ling,ZHENG Li-min,WANG Yan-lin,et al.(Department of Anesthesiology,Peking University,Shenzhen Hosital,Shenzhen518036,China)
Objective To explore the changes of the temperature and the thermoregulatory peripheral vasoconstriction in smoking patients under general anesthesia.Methods 23adult male patients undergoing abdominal operation under general anesthesia(ASA1-2),were divided into current smokers(group S,n=12,17.08±5.82cigarettes/day for 13.58±8.38years)and nonsmokers control group(group C,n=11).Demographic data was similar in the two groups.Both groups of patients were administered with propofol1-2mg/kg,fentanyl 4μg/kg and vecuronium 0.1mg/kg for general anesthesia induction,followed by isoflurane 1%-2%,remifentanil 0.08-0.12μg/kg/min and vecuronium 0.1-0.2mg/kg/h for anesthesia maintenance.;After trachea intubation,all patients were received intermittent positive pressure ventilation(IPPV)and the PETCO2were maintained between 35-40mmHg.The esophageal temperature(TES),mean skin temperature(TMSK),and forearm-fingertip temperature gradient(TFOR-FIN)were recorded.A forearm-fingertip temperature gradient of 0(TFOR-FIN=0℃)was considered as onset of thermoregulatory vasoconstriction and the esophageal temperature(TES)that triggered the onset of vasoconstriction was defined as the thermoregulatory threshold.The slope of the linear regression of the forearm-fingertip temperature gradient-TESrelationship below the threshold was calculated as its gain(gain).Results There were no significant differences in hemodynamic parameters,TES,TMSK,esophageal-mean skin temperature gradient(TES-MSK)and TFOR-FINbefore anesthesia induction(T0)between the two groups(P>0.05);TESwere significantly decreased from T20to T180in group C and from T10to T180in group S when compared to T0(P<0.05,and P<0.01,respectively).In addition,the TES were significantly lower in group S than that of group C fromT20to T180(P<0.05,and P<0.01,respectively).The threshold value in group S was lower than that in group C(P<0.01).Conclusion long-term smoking patients have reduced esophageal temperature and thermoregulatory vasoconstriction threshold,and are prone to hypothermia complications during general anesthesia.It is sug-gested that smoker patients should be emphasized for temperature monitoring and management.
general anesthesia;smoking;thermoregulatory
R971+.3
A
王明玲,女,副主任医师,研究方向:麻醉与应激反应。
2014-06-07)
1007-4287(2015)06-0960-04
2012年深圳市科技局科研立项课题(编号201203023)
*通讯作者
