例析化学平衡问题的图示解法
2015-05-30武赞寿
武赞寿


摘 要:将抽象复杂的化学平衡问题转化为简洁易懂的图示,实现难易转化,为解题提供捷径。
关键词:化学平衡;转化;图示法
化学平衡问题是中学化学的难点,也是高考的重点。笔者尝试用图示法分析,化抽象为具体,使问题简洁明了,学生易于理解和掌握,效果良好。
一、判断平衡移动方向
例1.某温度下,在一容积可变的容器中,反应2A(g)+2B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半 B.均加倍 C.均增加1 mol D.均减少1 mol
解析:保持温度和压强不变,判定平衡是否移动即判定各组分的浓度与平衡浓度比较是否改变,而判定移动方向即判定在原平衡浓度的基础上谁的浓度增大。
答案: C
二、判断反应的气体体积大小关系
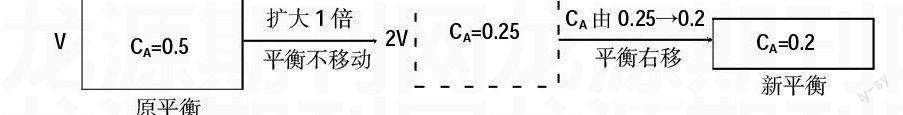
例2.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)zC(g)达到平衡后,测得A的浓度为0.5 mol/L,恒温下将容积扩大1倍后重新达到平衡,测得A的浓度为0.2 mol/L,比较该反应的系数大小关系。
解析:欲比较系数大小须先确定平衡移动方向。假定在容积扩大1倍的瞬间平衡未发生移动,虚拟如下过程:
平衡向右移动,根据勒夏特列原理:减小压强,平衡向气体体积增大的方向移动,故x+y 三、计算物质的量浓度 例3.在一定温度下一定体积的密闭容器中,有如下平衡:H2(g)+I2(g)2HI(g),已知:H2和I2起始浓度为0.10 mol/L。达到平衡时,HI的浓度为0.16 mol/L。若H2和I2起始浓度均为0.20 mol/L,则平衡时H2的浓度是多少? 解析:根据等效平衡原理容易得新平衡中IH的浓度。在定温定容条件下: 则平衡时,根据氢元素守恒:平=始-CHI=0.2-×0.32=0.04(mol/L) 四、比较转化率 例4.有两只密闭容器A和B,A保持恒压,B保持恒容,起始时向两容器中分别冲入等量且为2∶1的SO2和O2的混合气体,并使A和B容积相等,在保持400℃条件下使之发生反应2SO2(g)+O2(g)=SO3(g),达到平衡后两容器中SO2的转换率分别为a%、b%,比较a%和b%大小。 解析:因为两容器起始状态完全相同,在不同条件(定温定容和定温定压)下建立,所以可将定温定压下的平衡视为定温定容下的平衡定温加压得到: 由平衡Ⅱ加压得平衡Ⅰ,平衡正向移动,SO2转化率增大,因此a% 五、比较体积分数 例5.一真空容器密閉容器中盛有1 mol PCl5加热到200℃时发生反应PCl5(g)PCl3(g)+Cl2(g)达到平衡时,PCl5所占体积分数为m%,若在同温度和同容器中最初投入2 mol PCl5,达到平衡时PCl5所占体积分数为n%,则m与n的正确的关系是( ) A.m>n B.m 解析:分别取容积为V和2V的两个容器在相同温度下建立等效平衡Ⅰ和Ⅱ,将平衡Ⅱ定温加压使容积由2V变为V就可得到平衡Ⅲ。设计如下途径: 由平衡Ⅱ加压得平衡Ⅲ,平衡逆向移动,因此m% 答案:B 综上所述,只有认真研究题型,理清转化过程,准确运用基本依据,灵活设计图示,便可轻松解决平衡类问题。 参考文献: 张军贵.化学计算巧解探索[J].中学化学教学参考,2010(12). 编辑 谢尾合
