电针命门穴对去卵巢骨质疏松大鼠股骨OPG/RANKL系统的影响
2015-05-30纪峰等
纪峰等


【摘 要】 目的:研究电针命门穴对去卵巢骨质疏松症模型大鼠股骨OPG/RANKL系统中的关键信号分子骨保护素(OPG)、核因子Kappa B受体因子配体(RANKL)蛋白表达的影响。方法:将4~5月龄SD雌性大鼠随机分为假手术组(Sham)、模型组(Ovx)、电针命门组(GV4)、电针非经非穴组(Mock),每组各10只。除假手术组外,各组大鼠均切除双侧卵巢(ovariectomy ,OVx)制备绝经后骨质疏松症模型。命门组和非经非穴组每日电针1次,频率为2Hz,强度为1mA,每次持续20min,10d为一个疗程,治疗3个疗程;模型组和假手术组不进行干预,给予相同的套头、抓取、固定操作,疗程同针刺组。3个疗程后检测各组大鼠骨生物力学、骨密度以及大鼠股骨OPG、RANKL蛋白的表达情况。结果:和模型组相比较,电针命门穴能够显著改善Ovx大鼠骨小梁结构松散、排列紊乱、密度降低的骨质疏松形态学改变,改善股骨最大载荷和断裂载荷,并提高骨密度,与模型组比较均有统计学意义(P<0.01);免疫组化结果表明电针命门穴能够激活OPG、RANKL的表达。然而电针非经非穴组不能显著改善上述生物学指标。结论:通过激活OPG/RANKL信号通路、提高骨代谢过程中的骨形成并增强骨强度可能是电针命门穴治疗绝经后骨质疏松症的机制之一。
【关键词】 绝经后骨质疏松症;命门穴;OPG;RANKL
【中图分类号】R245.9+7 【文献标志码】 A 【文章编号】1007-8517(2015)07-0026-05
Abstract:Objective To observe the effect of electroacupuncture at Mingmen point on OPG/RANKL signaling of femur in postmenopausal osteoporosis rats.Methods 4-5 month female SD rats were randomly divided into sham operation group (Sham),model group (OVx),electroacupuncture Mingmen group(GV4),electroacupuncture non-acupoint group (Mock).Except for the sham group, the rats were performed ovariectomized(ovariectomy,OVx)to induced the model of postmenopausal osteoporosis.After the models were prepared,rats from different group were performed relatively treatment.After 3 courses of treatment,bone miner density,biomechanics and OPG/RANKL signaling by different method.Results staining results suggested electroacupuncture at Mingmen point can significantly improve the morphological changes of osteoporosis in ovariectomized rats.And electroacupuncture at Mingmen point could improve the maximum load and fracture load,as well as the bone density(P<0.01);Immunohistochemical results suggest that electroacupuncture at Mingmen point can activate the OPG/RANKL signaling pathway.Conclusion Electroacupuncture at Mingmen point can improve the effect of bone metabolism in the process of bone formation,and activing the OPG/RANKL signaling pathway might be one of the mechanism by which the electroacupuncture at Mingmen point treating the postmenopausal osteoporosis.
Keywords:Postmenopausal osteoporosis;Mingmen point;OPG;RANKL
绝经后骨质疏松症(Postmenopausal osteoporosis, PMOP)是指绝经后妇女由于卵巢功能衰退,雌激素水平下降,在骨代谢过程中骨吸收大于骨形成,从而以低骨量和骨组织的显微结构退行性变为其特征,临床表现为骨脆性和骨折易感性增加的一种代谢疾病[1],可归为中医“骨痿”、“骨痹”范畴。
命门,又名“精宫”,归属于督脉,陈士铎在《石室秘录》中说:“肾得命门而作强”,具有很强的培元补肾的作用,能针对PMOP的病机起治疗作用。本课题的前期研究已证明,针刺命门穴治疗可以改善肾精不足、骨失濡养的绝经后骨质疏松,并且通过上调骨形成蛋白-2(BMP-2)来改善骨吸收是其重要的分子生物学机制之一[2-7]。
骨保护素(osteoprotegerin, OPG)和核因子Kappa B受体活化因子配体(receptor of activator of nuclear factor B-ligand, RANKL)作为破骨细胞形成、分化和骨吸收调节的关键因子,OPG/RANKL系统被证实与骨质疏松等骨科疾病的发病机制密切相关[8-11]。
1 材料与方法
1.1 实验动物及分组 4~5月龄SD雌性大鼠40只,体质量为250~290g,购自福建中医药大学实验动物中心,动物批号:2007000530580。用随机数字表法,将40只大鼠分为造模组30、假手术组(Sham)10只,然后将造模组随机分为模型组(Ovx)、电针命门组(GV4)、电针非经非穴组(Mock)三组,每组各10只。
1.2 主要仪器及试剂
1.2.1 仪器 美国公司的DEXL双能X线骨密度仪;万能材料实验机 (岛津,AG-IC 20KN,日本);光学显微镜(YS2-H,尼康,上海普赫光电科技有限公司);MOTIC6.0图像分析软件(厦门麦克奥迪有限公司);OLYMPUS 1x70倒置显微镜;0.5寸针灸针(0.30x13mm,厂家:苏州医疗用品厂有限公司);电针仪(华佗SDZ-V,厂家:苏州医疗用品厂有限公司)、载玻片、注射器、棉签、纱布、手术刀、剪刀、塑料手套及棉手套(福州贝尔曼生物技术有限公司供)。
1.2.2 试剂 即用型 SABC 免疫组化染色试剂盒 (博士德公司) ;DAB 显色试剂盒(博士德公司);2%的戊巴比妥钠(麻醉用);戊酸雌二醇(广州,先灵药业有限公司);0.9%氯化钠溶液、青霉素(4万U/ml)、75%酒精(福州贝尔曼生物技术有限公司供);4%多聚甲醛。
1.3 模型制备 按照文献[12]方法造模。腹腔注射2%的戊巴比妥钠,按照0.2ml/100g的剂量进行麻醉。于腹正中线切开皮肤,逐层分离皮下组织及肌肉筋膜进入腹腔,可见乳白色组织,轻轻将之提出腹腔,找到被包裹的粉红色黄豆大小“桑堪样”卵巢,结扎并切除双侧卵巢,分层缝合肌肉、皮肤。假手术组10只大鼠采用上述相同的操作方法进行,但在找到卵巢后并不切除卵巢,而是切除卵巢周围的等量的软组织,余下处理同造模组。
术后,给大鼠腹腔注射青霉素生理盐水(4万U/ml)抗炎,每天注射1ml,连续3d。所有大鼠分笼按常规喂养,饲养室保持良好通风,室温控制在(22±1)℃,湿度60%,噪音<50分贝,光照与黑暗时间为每12h交替。造模完成后5d开始进行阴道脱落细胞涂片检测,观察大鼠阴道脱落细胞涂片细胞学变化,判断大鼠是否去势完全。造模成功后喂养12周,用美国公司的DEXL双能X线骨密度仪检测骨密度,记录骨密度数据,确定绝经后骨质疏松症模型成功。此后,开始进行干预。
1.4 干预方法
1.4.1 选穴 穴位定位参照《实验针灸学》[13]。
1.4.2 命门组 “命门”:第2腰椎棘突下凹陷;操作:将大鼠黑色布手套头固定,穴位局部剪去鼠毛,常规消毒,采用0.5寸针灸针,连接电针(SDZ-V),其中一侧电极连接腧穴,另一侧电极连接到大鼠尾巴中段左侧,频率为2Hz,波形为疏密波,强度1.0mA,每日上午9:00~11:00电针1次,每次电针持续20min,10d为1个疗程,疗程间休息一天,共治疗3个疗程。
1.4.3 非经非穴组 “非经非穴”:胁下髂嵴上20~25mm,后正中线旁开20mm处。电针操作同电针命门组。
1.4.4 模型组 不进行针刺,抓取及套头等干预方法同针刺组。期间,各组动物均正常饮食,自由饮水。余同电针组。
1.4.5 假手术组 不进行针刺,抓取及套头等干预方法同针刺组。期间,各组动物均正常饮食,自由饮水,余同电针组。
1.5 观察指标及检测方法
1.5.1 骨密度检测 干预1个月后,在2%戊巴比妥钠2ml/kg麻醉下,将大鼠仰躺固定于木板上,用美国公司的DEXL双能X线骨密度仪及其所附的小动物软件,记录骨密度指数。
1.5.2 取样 将大鼠处死,取大鼠两侧股骨,去掉股骨头端附着的肌肉韧带, 左侧股骨置于10%中性甲醛溶液中,4℃保存, 备行免疫组织化学检测。右侧股骨采用生理盐水纱布包裹,放于-20℃的冰箱中。
1.5.3 HE染色 取大鼠股骨头部分,置于10%多聚甲醛固定48h,用 10%EDTA(pH7.2)脱钙,每周更换1次,约 42d。脱钙至大头针无明显阻力通过,流动水冲洗24h,常规酒精上行梯度脱水,二甲苯透明,石蜡包埋,切片5mm,并附于经多聚赖氨酸处理过的载玻片上,60℃过夜,然后脱蜡、入水冲洗、PBS洗两次。苏木素染液染色7min,70%乙醇浸泡30min,脱去胞质着色,碱性液碱化,蒸馏水漂洗1min,伊红染液染色40sec,梯度乙醇脱水,二甲苯透明2次,干燥,封片,光学显微镜下观察股骨形态结构,判断去势完全的大鼠是否患有骨质疏松症。
1.5.4 右侧股骨放在津岛AG—IC20KN 万能材料实验机测股骨生物力学性能 三点弯曲实验,将股骨置于实验机上(生理盐水浇灌标本以保持温度,室温23 ℃),各个股骨按照股骨头凹面朝下,股骨头端朝前的位置放置,压头大概在股骨长度中间位置的正上方,调节压头最接近股骨的位置但不触碰到股骨,避免对股骨产生压力,跨距24mm,加载速度2mm/min,直至股骨断裂,记录最大载荷和断裂载荷值,股骨断裂前所能承受的最大力为最大载荷,股骨断裂时所承受的力为断裂载荷。
1.5.5 免疫组化 取大鼠股骨头部分,置于 10%多聚甲醛固定48h,用 10%EDTA(pH7.2)脱钙,每周更换1次,约 42d。脱钙至大头针无明显阻力通过,流动水冲洗24 h,常规酒精上行梯度脱水,二甲苯透明,石蜡包埋,切片5mm,严格按即用型SABC试剂盒说明书操作, PBS 缓冲液代替一抗作阴性对照,一抗稀释倍数均为 1∶100。每张切片随机选5个视野(×400) 应用 OLYMPUS1×70倒置显微镜观察并拍照, 运用厦门麦克奥迪有限公司 MOTIC6.0 图像分析软件对每张照片进行OPG、RANKL表达的阳性细胞个数及灰度值进行测量,每张、每组切片取其平均值。阳性判断标准: 当细胞膜、胞浆和或细胞核出现棕黄色阳性物质为阳性细胞。用平均灰度值表示染色强弱。
1.6 统计学处理 采用SPSS 16.0软件对数据进行统计分析,本数据为计量资料,满足正态性和方差齐性,采用单因素方差分析,两组间比较应用LSD-t检验,所有数据用均数±标准差(x[TX-*3]±s)表示,P<0.05为差异具有统计学意义。
2 结果
2.1 大鼠阴道脱落细胞涂片结果 镜下见细胞稀疏且细胞核大、核浆比例大,或满视野不成熟小细胞(呈成片或成串小紫葡萄),提示去卵巢成功,见图1。
2.2 各组大鼠股骨骨组织形态结果 模型组大鼠的骨小梁与假手术组大鼠比较,数量明显减少,结构松散,排列紊乱,密度和面积明显变小,而骨髓腔,明显变大,有大量的脂肪和空泡,表现出典型的骨质疏松症骨组织形态。电针命门穴能够显著改善大鼠卵巢去势诱导的形态学改变,而非经非穴组不能明显改善大鼠卵巢去势引起的骨质疏松,详见图2。
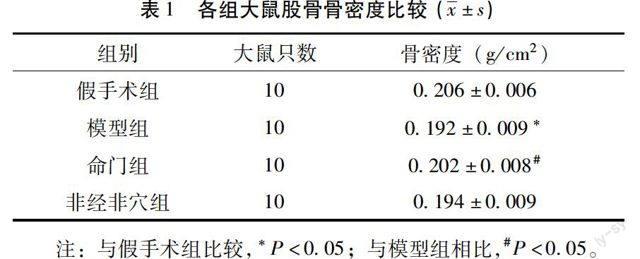
2.3 各组大鼠股骨骨生物力学结果及骨密度结果 模型组骨密度与假手术组比较显著降低(P<0.05);命门组与模型组相比显著升高(P<0.05)。见表1。
模型组最大载荷、断裂载荷与假手术组比较显著降低(P<0.05);命门组与模型组相比最大载荷、断裂载荷均明显升高(P<0.05)。见表2。
2.4 电针对各组大鼠OPG、RANKL表达的影响 大鼠股骨OPG、RANKL蛋白表达结果(免疫组化, ×100)。棕色或者棕黄色颗粒为阳性细胞,阳性细胞染色深表示其强阳性表达。
OPG、RANKL蛋白的表达水平与阳性目标总面积和阳性目标平均灰度有关。阳性目标总面积表示股骨OPG、RANKL蛋白分布面积的大小,面积越大,OPG、RANKL蛋白分布的越广泛。灰度值表示OPG、RANKL蛋白表达的强弱,灰度值越低,OPG、RANKL蛋白阳性表达越强。命门组的灰度值(P>0.05),与其他三组相比较数值差异有统计学意义(P<0.05),表示OPG、RANKL蛋白的强阳性表达。综合OPG、RANKL蛋白阳性目标总面积和阳性目标平均灰度,命门组OPG、RANKL蛋白的表达量最多,模型组与命门组比较差异有统计学意义(P<0.05);命门组与非经非穴组比较,差异有统计学意义(P<0.05)。见图3、图4。
3 讨论
中医经典上记载“肾藏精,主骨生髓,其充在骨”。肾为先天之本,主骨生髓,骨的生长、发育、强劲与衰弱和肾精有密切的关系,肾精充足则骨髓生化有源,骨骼得以滋养而强劲有力,肾精亏虚则骨髓生化无源,骨骼失养而痿弱无力。《素问·逆调论篇》:“肾不生,则髓不能满;水不胜火,骨枯而髓虚,足不任身”。《素问·脉要精微论篇》中阐述了肾、骨、髓之间的病理联系,说明肾精不足、骨髓失养则骨髓脆弱无力。因此,祖国医学认为,肾虚是形成绝经后骨质疏松症的基本病机[14]。命门穴为“元阳聚积之处”, “肾得命门而作强”,电针命门穴可沟通两肾之阴阳水火,补养机体先天之精气,具有补益先天,强肾固本,温督壮阳的作用。本研究选用“命门”穴正是针对绝经后骨质疏松症肾虚精亏髓虚的实质而定。
OPG和RANKL作为破骨细胞形成、分化和骨吸收调节的关键因子,OPG/RANKL系统被证实在骨质疏松、骨关节炎等[8-11]骨科疾病的发病机制及治疗方面具有重要作用。在骨重塑过程中,降低破骨细胞的数量及活性是防治骨质疏松症的重要策略[15]。RANKL又称骨保护素配体(osteoprotegerin ligand, OPGL),为破骨细胞表面核因子Kappa B 受体活化因子(receptor of activator of nuclear factor Kappa B,RANK)的配体,主要由成骨细胞及其前体表达,通过旁分泌方式与破骨细胞前体或破骨细胞表面的RANK结合,促进破骨细胞的生成和活化。OPG在骨组织中由成骨细胞及骨髓基质细胞分泌产生,为RANKL的饵受体,可竞争性结合RANKL,封闭RANKL与RANK结合,抑制破骨细胞的发生、分化和成熟,并诱导破骨细胞凋亡。RANKL/OPG比例的变化对于破骨细胞产生至关重要,一般来说,当RANKL/OPG的比值上升,破骨细胞的数量和活性将增加,RANKL/OPG的比例下降时,破骨细胞的数量和活性将降低。 总之,正常的骨重建和骨量的稳定依赖于OPG和RANKL的平衡,OPG/RANKL的比值是评估骨重塑过程的指标[16-24]。
本研究通过电针命门穴的治疗,大鼠股骨OPG和RANKL蛋白表达量增多,治疗前后大鼠股骨骨密度增加,治疗组比模型组骨生物力学最大载荷和断裂载荷增大,OPG/RANKL系统中的关键信号分子OPG和RANKL蛋白表达强阳性,可以提示电针命门穴的治疗机制是通过OPG/RANKL系统中的关键信号分子OPG和RANKL为靶点,改善骨质疏松症的。
参考文献
[1]徐志英,梁九根,蒋宁一,等.围绝经期及绝经后妇女骨量变化规律的初步分析[J].中国骨质疏松杂志,2006,12(4):378-396.
[2]李沛,纪峰,林莺,等.“髓会”穴透刺为主对绝经后骨质疏松症生存质量的影响[J].甘肃中医学院学报,2010,27(1):45-47.
[3]李沛,纪峰,陈贵珍.针药结合对绝经后骨代谢相关激素影响的临床观察[J] .福建中医学院学报,2005,15(3):21-22.
[4]李沛,林莺,许金榜.针药结合对绝经后妇女骨代谢调节作用的临床研究-附20例分析 [J] .福建医药杂志,2009,31(6):131-133.
[5]张木兰,纪峰,林莺,等.电针关元穴对去卵巢骨质疏松症模型大鼠IGF-1和骨生物力学的影响[J] .针刺研究,2014.39(3):207-210.
[6]黄桂榕,李沛,范怀玲,等.电针命门穴对绝经后骨质疏松症模型大鼠骨形成蛋白-2的影响[J] .针刺研究,2014.39(2):130-135.
[7] 李沛,纪峰,林莺,等.电针命门穴对去势骨质疏松症模型大鼠肾上腺雌激素受体ERα mRNA表达的影响[J] .时珍国医国药,2014.25(3):749-750.
[8]Bord S,Ireland DC,Beavan SR,et al.The effects of estrogen on osteoprotegerin,RANKL and estrogen receptor expression in human osteoblasts [J].Bone,2003,32(2):136-141.
[9]Hofbauer LC.Pathophysiology of RANK ligand (RANKL) and osteoprotegerin (OPG) [J].Ann Endocrinol(Paris),2006,67(2):139-141.
[10]Boyce B F,Xing L.The RANKL/RANK/OPG pathway[J].Curr Osteoporos Rep,2007, 5(3):98-104.
[11]Marie P,Halbout P.OPG/RANKL: role and therapeutic target in osteoporosis[J].Med Sci(Paris),2008,24(1):105-110.
[12]张晗祥,梅浩,骆旭东.仙灵骨葆对去卵巢大鼠骨质疏松症模型预防效果的研究[J].中国中医骨伤科杂志,2011,19(8):672-675.
[13]郭义.实验针灸学[M].北京:中国中医药出版社,2008:417.
[14]王晓琳.从中医的整体观、辨证观探讨绝经后骨质疏松症的发病[J].陕西中医学院学报.2009,32(2):7.
[15]Deal C.Potential new drug targets for osteoporosis [J].Nat Clin Pract Rheumatol,2009,5(1):20-27.
[16]Boyce B F,Xing L.Functions of RANKL/RANK/OPG in bone modeling and remodeling [J].Arch Biochem Biophys,2008,473(2):139-146.
[17]Rauner M,Sipos W,Goettsch C,et al.Inhibition of lamin A/C attenuates osteoblast differentiation and enhances RANKL-dependent osteoclastogensis [J].J Bone Miner Res,2009,24(1):78-86.
[18]Hofbauer L C,Gori F,Riggs B L,et al.Stimulation of osteoprotegerin ligand and inhibition of osteoprotegerin production by glucocorticoids in human osteoblastic lineage cells:potential paracrine mechanisms of glucocorticoid-induced osteoporosis [J].Endocrinology,1999, 140(10):4382-4389.
[19]Kostenuik P J,Capparelli C,Morony S,et al.OPG and PTH-(1-34) have additive effects on bone density and mechanical strength in osteopenic ovariectomized rats [J].Endocrinology,2001,142(10):4295-4304.
[20]Dolder S,Hofstetter W,Wetterwald A,et al.Effect of monoterpenes on the formation and activation of osteoclasts in vitro [J].J Bone Miner Res,2006,21(4):647-655.
[21]Romas E,Gillespie MT,Martin TJ.Involvement of receptor activator of NF kappa B ligand and tumor necrosis factoralpha in bone destruction in rheumatoid arthritis [J].Bone,2002,30(2):340-346.
[22]Ominsky M S,Stolina M,Li X,et al.One year of transgenic overexpression of osteoprotegerin in rats suppressed bone resorption and increased vertebral bone volume,density and strength [J].J Bone Miner Res,2009,24(7):1234-1246.
[23]Zehnder A F,Kristiansen A G,Adams J C,et al.Osteoprotegrin knockout mice demonstrate abnormal remodeling of the otic capsule and progressive hearing loss[J].Laryngoscope,2006,116(2):201-206.
[24]Kulkarni R N,Bakker A D,Everts V,et al.Inhibition of osteoclastogenesis by mechanically loaded osteocytes: involvement of MEPE[J].Calcif Tissue Int,2010, 87(5): 461-468.
(收稿日期:2015.01.28)
