点击:必修1、2中重、难点知识
2015-05-30常焕玲
常焕玲


一、化学中的实验方法
高考对基本实验的考查多以选择题为主,试题背景源于实验仪器的选择、基本操作的正确与否、物质中成分的检验、混合物的分离与提纯等,以表格或装置图展现实验内容的形式逐渐增多。复习时,要对分液漏斗、冷凝管、容量瓶等仪器的用途、使用注意事项进行识记,对蒸发与蒸馏、萃取与分液、降温结晶与蒸发结晶等进行辨别与选择,对常见气体的制备方法进行归类,当然,实验安全(如防倒吸、防爆炸、防污染、防干扰、防暴沸等)与绿色化学要求也不容忽视。另外,还要掌握必修教材中再重要的演示实验及气体的实验室制法。
例1 下列有关实验操作的叙述正确的是()。
①向试管中滴加液体,胶头滴管紧贴试管内壁。②将O2和H2的混合气体通过灼热的Cu0以除去H2。⑧汽油和煤油互溶,用萃取的方法分离。④用容量瓶配制溶液时,若加水超过刻度线,立即用胶头滴管吸出多余的液体。⑤用溶解过滤的方法分离KNO3和NaCl的固体混合物。⑥配制溶液定容时,仰视容量瓶的刻度线,会使溶液浓度偏高。
A.①②
B.①②③⑤
C.②⑥
D.无
①胶头滴管不能接触试管内壁,以防污染试剂。②容易发生爆炸。③用蒸留的方法分离。④应该重新配制溶液。⑤用结晶法分离。⑥使溶液浓度偏小。本题选D。
二、化学计量
高考有关化学计量的考查常以选择题为主,以阿伏加德罗常数为载体,涉及氧化还原反应中得失电子数目、电解质溶液中粒子数目、物质分子数或原子数,以及电子数、化学键数目等。复习时需要注意以下几点:①辨别儿组概念,即物质的量与摩尔,阿伏加德罗常数与6.02×1023,摩尔质量与相对分子质量,气体摩尔体积J022.4L·mol-1 ,物质的量浓度与质量分数等。②气体摩尔体积只适用于气体,命题者常给出S03、戊烷等标准状况下非气态的物质迷惑大家。③区分某些粒子的组成,如-OH与OH-的电子数,H2O、D2O的中子数,白磷分子中的P-P键数目等。④最简式相同的粒子按照最简式计算,如乙烯与丙烯,NO2与N2O4等。⑤可逆反应不能进行到底,弱电解质不完全电离等。⑥汁算氧化还原反应中得失电子数目时,找对基准物质,如1 mol钠与足量氧气反应生成氧化钠与过氧化钠的混合物时,按照钠计算。
例2 设NA为阿伏加德罗常数的值,下列说法正确的是()。
三、氧化还原反应与离子反应
本部分涉及的知识点比较多,通常考查氧化还原反应的概念判断、物质氧化性与还原性的比较、方程式的书写、离子共存等。复习时需要注意以下儿点:①氧化还原反应与离子反应是化学反应的两个侧面,相互之间并不排斥,所以存在氧化还原旺的离子反应;掌握常见的氧化性离子与还原性离子之间的反应;书写方程式时保证得失电子守恒与电荷守恒的统一。②氧化还原反应中物质氧化性、还原性的比较与反应顺序的问题。③氧化还原反应与电化学内容相关,自发的氧化还原反应的化学能能够转化为电能,“负氧化、正还原”。④复分解型“以强制弱”的反应诠释了化学反应向着“更弱”“更难溶”“更难电离”的方向进行的趋势。⑤两类反应的应用。在金属的冶炼、电能与热能的获取、杀菌消毒等方面,理解氧化还原反应的应用;在污水处理、离子检验、离子共存等方面,理解离子反应的应用。成CO2、Mg (OH)2沉淀。D项中的Fe3+与SCN-发生络合反应,生成难电离的Fe(SCN)3。B项中的Fc2-、H+、NO3-能发生氧化还原反应。本题选B。
四、元素及其化合物
考试说明中要求掌握的金属元素有Na、Al、Fe、Cu等,非金属元素有H、C、N、O、Si、S、Cl等。其中Na是活泼金属的代表;Al是“两性”金属的代表;Fe是变价元素的代表;Cu是考试说明中新增的元素,课本中虽未系统地讲述其性质,但其单质与化合物的性质也时常遇到。C、H、O元素是构成有机物的主要元素,N、S、Cl元素的化合物是对环境质量有重要影响的物质,Si的化合物是与当今科技前沿息息相关的物质。复习时应以性质特点、用途、化学方程式为主线,将每一种元素及其化合物之间的转化编织成一张网。元素化合物知识是一切化学知识考查的“肌肉”,单独考查知识点已经不是很突出,在这种看似“弱化”的表面之下,而是融合在实验、基本概念及基本理论等载体之中,使元素化合物的考查更富有情境化,更具有现实意义。
例4 下列叙述正确的是()。
A,漂白粉在空气中不稳定,故可用于漂白纸张
B.漂白粉在空气中久置易变质,是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C.因为用较强酸可以制取较弱酸,所以用次氯酸无法制取盐酸
D.在碎瓷片上加热石蜡油,产生的气体能使溴的四氯化碳溶液褪色,证明发生了化学反应
A项,漂白粉漂白纸张利用了漂白粉的漂白性。B项,漂白粉在空气中久置易变质,是因为漂白粉中的Ca(ClO)2与空气中的CO2反应生成CaCO3与HC1O,HC1O见光分解。C项,HClO具有较强的氧化性,遇到还原剂或者本身分解就会生成盐酸。D项,石蜡油的主要成分是烷烃,本身不能使溴的四氯化碳溶液褪色。在碎瓷片上受热后,产生的气体能使溴的四氯化碳溶液褪色,说明生成了含不饱和键的新物质,证明发生了化学反应。本题选D。
五、物质结构与元素周期律
物质结构与元素周期律是学习元素化合物的理论依据,涉及的知识点主要有元素周期表与周期律、原子结构与元素性质、化学键的判断等。近几年涉及本部分的高考题知识丰富、规律性强,以典型元素化合物推导为铺垫,结合热化学方程式、电化学、溶液里的离子平衡等知识进行综合考查。复习时应注意以下几点:①理解几组关系,即电荷数与核电荷数,质量数与相对原子质量,化合价与化学式,核素与同位素等。②记住常见分子的化学式的书写规律,理解化合价、化学键类型的内在规律,并能作相应推导。③掌握特征微粒结构或者特征元素及其化合物知识,作为元素推断的突破口。④以常见元素的“位、构、性”三者之间的关系为节点建立“元素族谱”,以金属性递变和非金属性递变依据为两条线索进行梳理。⑤以元素在周期表中的位置为基础,以氢化物的稳定性与最高价氧化物对应水化物的酸性为主要性质指标进行比较。
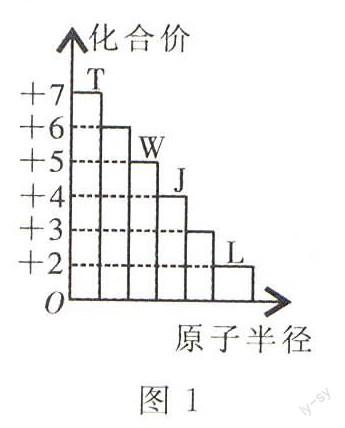
例5 有四种短周期元素,最高化合价与原子半径的关系如图1所示,下列推断正确的是()。
A.T能与其他三种元素最多组成三种物质
B.T、W、J形成的气态氢化物的稳定性逐渐减弱
C.J不能形成同素异形体
D.T和W组成的分子中每个原子均达到8电子结构
由图可知,短周期只有第三周期元素有+6、+7价,所以这四种元素位于第三周期。T为氯元素,W为磷元素,J为硅元素,L为镁元素。A项,T能与其他三种元素组成氯化镁、四氯化硅、三氯化磷、五氯化磷等。B项,氯化氢、磷化氢、硅烷的稳定性依次减弱。C项,硅元素有晶体硅和无定形硅两种同素异形体。D项,五氯化磷分子中磷原子最外层电子数为10。本题选B。
六、化学反应与能量
任何化学反应的发生均以物质变化为特征,同时一定伴随有能量的变化。化学能与热能可以直接转化,化学能转化为电能则需要通过一定的装置。高考考查的重点有热化学方程式的书写、盖斯定律、原电池的原理等,偶有考查必修教材中对化学反应与能量变化的认识与理解。复习时注意辨别“两个角度”:化学反应的发生就是旧化学键的断裂与新化学键的牛成,所以对于吸热反应与放热反应,可以从物质具有的能量角度理解,也可以从化学键键能的角度理解。如放热反应,可以理解成反应物具有的总能量高于生成物具有的总能量,也可以理解成断开旧化学键吸收的能量小于形成新化学键所放出的能量。还应注意原电池形成的条件及正、负极的判断。
例6 图2所示的设备T作时,将化学能转化为热能的是()。
A项,硅太阳能电池可将太阳能转化为电能。B项,锂离子电池可将化学能转化为电能。C项,太阳能集热器可将太阳能转化为热能。D项,燃料燃烧可将化学能转化为热能。本题选D。
七、有机化合物
必修教材对有机化合物做了入门介绍,让同学们从有机化学特有的角度认识了一大类简单元素构成的有机化合物。复习时,应掌握几种重要有机物的结构、性质及应用,如甲烷、乙烯、苯、乙醇、乙酸,以及几种基本营养物质的特征性质;应牢记几种有机反应类型,如取代反应、加成反应、氧化反应、酯化反应等。高考的考查多限于选择题,而有机物的组成与性质、同分异构体的判断是近年出现频率较高的考查形式。分析结构,预测性质,通晓用途,从理论到实际,从生产到生活,考查越来越细致。
例7 下列有机物中同分异构体数目最少的是()。
A,戊烷
B.戊醇
C.戊烯
D.乙酸乙酯
A项,戊烷有正戊烷、异戊烷、新戊烷三种同分异构体。B项,戊基有8种结构,戊醇属于醇类,同分异构体也有8种,若加上醚的结构,戊醇的同分异构体多于8种。C项,戊烯是在戊烷碳链的基础上加上碳碳双键,有5种同分异构体,再加上环烷烃,戊烯的同分异构体多于j种。D项,乙酸乙酯的同分异构体有甲酸丙酯、甲酸异丙酯、丙酸甲酯、丁酸、异丁酸等。本题选A。
八、化学与自然资源的开发和利用
化学与能源开发、环境保护、资源利用等密切相关,自然界为人类提供了丰厚的资源宝库,但口益严峻的环境问题已成为近年来高考命题的热点。对资源的综合利用、废弃物的合理处置、低碳环保的理念均应有所了解。此部分内容起点高、落点低,只要稍作关注便不会被众多主干知识淹没。
例8 下列叙述不正确的是()。
A.制饭勺、饭盒、高压锅等的不锈钢是合金
B.光催化还原水制氢比电解水制氢更节能、环保、经济
C.含重金属离子的电镀废液不能随便排放
D.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
A项,不锈钢属于合金。H项,光能比电能更清洁,更节约资源。C项.重金属离子会污染水源和土壤,不能随便排放。D项,聚乙烯塑料难以降解,会造成污染,而聚乳酸塑料可以在乳酸菌的作用下降解。本题选D。
