纽荷尔脐橙果皮光泽型突变体及其高接后代果皮蜡质成分比较研究
2015-05-28刘德春王敏力刘山蓓
刘德春,王敏力,杨 莉,曾 琼,刘山蓓,刘 勇
(江西农业大学 农学院,江西 南昌 330045)
表皮蜡质层是覆盖在植物器官表面的一层保护性组织,具有防止表皮失水、抵御生物和非生物胁迫等生理功能。植物表皮蜡质主要由特长链(C20-C36)饱和脂肪酸及其衍生物(包括烃、醛、酮、醇、脂等)、萜类物质和其他微量次级代谢物(固醇及类黄酮类等)组成。不同种类植物表皮蜡质含量和化学成分组成不同,并且同一种植物在不同的生长环境中,表皮蜡质组成也不同[1]。
和其它植物一样,柑橘果皮也覆盖着一层蜡质,具有重要的生理功能。在柑橘果实采收处理的过程中,打蜡是关键一环,可以增加果实光泽度,提高贮藏性能。但机械打蜡带来的柑橘低温贮藏过程中产生异味、品质下降以及消费者关于食品安全的担忧始终是难以解决的问题[2]。如果能选育出自身蜡质结构和成分改变的柑橘新品种,将可能解决这个难题。
2006年,本课题组在江西省信丰县发现一株纽荷尔脐橙枝条变异,连续7年来观察该枝条变异遗传稳定,主要特点是果实表皮极富光泽,因此被命名为“纽荷尔脐橙果皮光泽型突变体”[3]。前期研究表明,与纽荷尔脐橙相比,该突变体果皮蜡质晶体数目显著减少,蜡质成分中的烷和醛含量显著下降[3],突变体果实比对照具有更好的外观品质[4];在4℃冷藏过程中,果实失重率和MDA含量突变体一直高于对照和打蜡脐橙,且前期(99 d前)突变体脐橙腐烂率低于对照,但后期腐烂较快,突变体果实可溶性固形物、可滴定酸、可溶性总糖、Vc含量普遍高于对照和打蜡脐橙,说明突变体具有较好的脐橙果实贮藏品质[5]。
本研究选择不同发育时期的纽荷尔脐橙果皮光泽型突变体母树果实(突变体)、突变体脐橙枝条异地高接子一代果实为研究材料。对其不同发育时期的果皮蜡质含量和成分进行比较分析,以鉴定突变体脐橙蜡质成分的变化是否为基因变异导致的芽变,为纽荷尔脐橙果皮光泽型新品种的选育提供参考,并为进一步研究突变体形成的分子机理提供有用的信息。
1 材料与方法
1.1 材料
纽荷尔脐橙(Citrus sinensis[L.]Osbeck cv.Newhall)果皮光泽型突变体母树果实(突变体)、突变体脐橙枝条异地高接子一代果实(子一代)分别于2012年7月28日、9月28日、11月28日在江西省信丰县脐橙园采样。母树突变体脐橙从变异枝条东西南北四个方位,每个方位采集2个健康、无病虫害果实,每个发育时期采集8个果实;子一代脐橙随机选择3棵长势良好的果树,从东西南北四个方位,每个方位采集2个健康、无病虫害果实,每个种类每个发育时期果实共采摘24个,当天运回实验室进行下一步处理。
1.2 果实角质膜蜡质成分提取(酶解法)与测定方法(GC-MS)
用游标卡尺测定果实横纵径,再用蒸馏水清洗,置于玻璃板上晾干。用内径为1.1 cm的打孔器在果实赤道部位均匀取4个孔。获得的小圆片,用刀片仔细切除白皮层,放入20 mL玻璃试管中。加入10 mL EB酶解液(内含0.1 mol/L的醋酸钠、1 mmoL的叠氮化钠、1%的果胶酶、1%的纤维素酶,用冰醋酸将pH调至3.8),在37℃条件下震荡培养48 h,中间换EB酶液一次,换液时注意剥离角质和细胞壁成分。弃去酶液,用10 mmol/L的十水四硼酸钠缓冲液清洗,除去依附于角质上的细胞壁杂质。再用DDW水清洗分离后的角质膜,清洗标准:上表面光滑,紧挨着细胞壁的表面平滑,没有任何杂质。将清洗干净的角质膜放入25 mL的血清瓶中,在60℃条件下烘48 h[6]。
向装有样品的玻璃瓶内加入50μL(0.2 mg/μL)的标准物质正二十四烷烃,在通风厨内晾干;加入2 mL氯仿,抽提1min;吸取200~500μL抽提液到反应瓶;氮气吹干至少于200μL;转到反应瓶,继续吹干至少或等于100μL;在每一个反应瓶中加入20μL硅烷化试剂(BSTFA),在温度为70℃的烘箱中衍生40 min;转到上样瓶中上样分析。
GC-MS条件:采用通用型hp-5MS毛细管柱(30 m×0.25 mm×0.25μm),固定相为聚二甲基硅氧烷。色谱条件为:进样口温度280,质谱源温度230℃,柱流速2 mL/min,恒定流速;Aux-2温度280℃,载气为氦气,无分流注样,进样量1μL。质谱条件为:电子轰击电离方式,能量70 eV,质量扫描范围50~600 amu,全扫描方式,溶剂延迟3 min。升温过程为50℃保持1 min,以20℃/min升温至170℃,保持2 min;再以5℃/min升温至300℃,保持8min。各种蜡质成分经GC-MS检测后得到其离子峰,依据质谱库进行检索判定并按一定的条件对离子峰进行面积积分。
1.3 数据分析
采用Excel 2003办公软件对数据进行整理与分析,用SigmaPlot 10.0作图。利用DPS软件中的Duncan新复极差法作多重比较分析。其中显著性差异水平:显著(P<0.05);极显著(P<0.01)。
2 结果与分析
2.1 突变体脐橙与突变体脐橙子一代果实发育过程中各蜡质种类含量变化
突变体果实和子一代果实发育期间果皮各蜡质种类含量变化情况见表1、图1。试验分离鉴定出的蜡质组分主要有脂肪酸、烷烃、醇、三萜类化合物、小分子代谢产物和酯类。
7月采集的样品中,突变体脐橙果实表皮中蜡质含量从高到低依次为:脂肪酸、三萜类化合物、烷烃、小分子代谢产物、醇、酯类。其中脂肪酸含量最高为1.362 1μg/cm2,占蜡质总量的比例为62.623 4%;酯类物质含量最低为0.036 1μg/cm2,占蜡质总量的比例为1.657 5%。子一代脐橙果实表皮蜡质含量从高到低依次为:脂肪酸、三萜类化合物、小分子代谢产物、烷烃、醇、酯类。其中脂肪酸含量最高为0.693 1 μg/cm2,占蜡质总量的比例为42.691 3%;酯类物质含量最低为0.027 1 μg/cm2,占蜡质总量的比例为1.669 6%。突变体脐橙果实表皮的蜡质总量略高于子一代脐橙表皮蜡质总量,但差异不显著,并且突变体和子一代果皮除烷烃外各种蜡质种类含量都不存在显著差异。

表1 果实发育期间各蜡质种类含量的变化Tab.1 Change of each wax fraction amount during fruit development
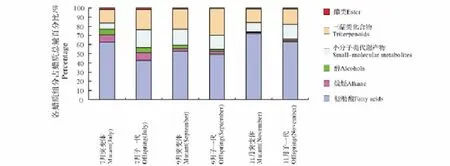
图1 果实发育期间各蜡质组分所占百分比Fig.1 Change of the percentage of each wax composition during the fruit development
9月采集的样品中,突变体脐橙果实表皮中蜡质含量从高到低依次为:脂肪酸、三萜类化合物、小分子代谢产物、醇、烷烃、酯类。其中脂肪酸含量最高为3.157 5μg/cm2,占蜡质总量的比例为52.755 2%;酯类的含量最低为0.042 3μg/cm2,占蜡质总量的比例为0.706 9%。子一代脐橙果实表皮蜡质含量从高到低依次为:脂肪酸、三萜类化合物、小分子代谢产物、烷烃、醇、酯类。其中脂肪酸含量最高为2.901 5 μg/cm2,占蜡质总量的比例为49.410 6%;酯类含量最低为0.027 5 μg/cm2,占蜡质总量的比例为0.468 3%。9月中突变体和子一代脐橙果皮蜡质总量不存在显著差异,各种蜡质种类含量也不存在显著差异。
11月中,突变体脐橙果实表皮中蜡质含量从高到低依次为:脂肪酸、三萜类化合物、小分子代谢产物、烷烃、酯类、醇。其中脂肪酸含量最高为7.413 9μg/cm2,占蜡质总量的比例为72.104 9%;醇的含量最低为0.086 7μg/cm2,占蜡质总量的比例为0.842 8%。子一代脐橙果实表皮蜡质含量从高到低依次为:脂肪酸、三萜类化合物、小分子代谢产物、醇、烷烃、酯类。其中脂肪酸含量最高为6.138 6μg/cm2,占蜡质总量的比例为63.021 0%;酯类物质含量最低为0.096 0μg/cm2,占蜡质总量的比例为0.985 7%。突变体脐橙中蜡质总量为10.282 1μg/cm2略高于子一代脐橙9.740 6μg/cm2,但两者差异未达到显著水平。突变体脐橙与子一代脐橙脂肪酸、烷烃、醇类物质、三萜类物质、酯类等蜡质种类含量差异均未达到显著水平,但小分子代谢产物含量存在显著差异。
随突变体和子一代果实的生长发育,脂肪酸含量逐渐增加(表1)。突变体脐橙脂肪酸含量从1.362 1 μg/cm2增加至7.413 9 μg/cm2,子一代脐橙脂肪酸含量也逐渐升高,最低为0.693 1 μg/cm2,最高为6.138 6 μg/cm2;突变体脐橙烷烃含量逐渐下降,最高为0.178 0 μg/cm2,最低为0.112 3 μg/cm2。子一代脐橙烷烃含量先上升后下降,9月最高为0.176 0μg/cm2,7月份含量最低为0.138 9μg/cm2;突变体脐橙和子一代脐橙在果实发育过程中醇类物质无显著性差异;突变体脐橙三萜类化合物含量持续上升,7月份最低为0.322 6μg/cm2,11月份最高为1.534 5μg/cm2。子一代三萜类化合物含量先迅速上升,后缓慢下降,最低为0.355 6μg/cm2,峰值为1.695 9μg/cm2;突变体脐橙小分子代谢产物含量7—9月份上升迅速,9—11月份呈缓慢上升趋势,最低含量为0.143 5μg/cm2,最高含量为1.045 4μg/cm2,子一代脐橙小分子代谢产物含量持续上升,最低为0.321 4μg/cm2,最高为1.607 0μg/cm2;突变体脐橙和子一代脐橙酯类物质含量7—9月份缓慢上升,9—11月份上升迅速。突变体脐橙蜡质总量逐渐上升,由2.175 1μg/cm2上升至10.282 1μg/cm2,子一代脐橙蜡质总量变化趋势与突变体脐橙一致,由1.623 6μg/cm2上升至9.740 6μg/cm2。如图1所示,脂肪酸含量所占百分比突变体和子一代均是11月份最高,突变体为72.104 9%,子一代为63.021 0%。烷烃含量在中蜡质成分中所占百分比均呈逐渐下降的趋势。醇类含量所占比例在突变体脐橙和子一代脐橙果实表皮中呈下降趋势,7月份、9月份和11月份在突变体脐橙和子一代脐橙中不存在显著差异。三萜类化合物含量所占比例呈先上升后下降趋势,其在子一代脐橙果实表皮中所占比例更大。小分子代谢产物含量在子一代脐橙果皮中所占比例更大。酯类物质含量所占比例随着果实的生长发育先下降后上升。
2.2 突变体脐橙与突变体脐橙子一代果实发育过程中各蜡质成分含量变化
如图2所示,为果实发育过程中突变体脐橙和子一代脐橙果实表皮的蜡质成分。通过酶解法,共分离鉴定出 22 种蜡质成分。分别为 C16、C17、C18、C20、C24、C28,C32、C33、C34的饱和脂肪酸和 C18∶2、C18∶1、C29∶5的不饱和脂肪酸;C27、C29、C31烷烃;C26∶1 和 C32∶1 的不饱和醇;β-香树精,软木三萜酮,β-谷甾醇,6甲氧基黄酮,单甘酯。
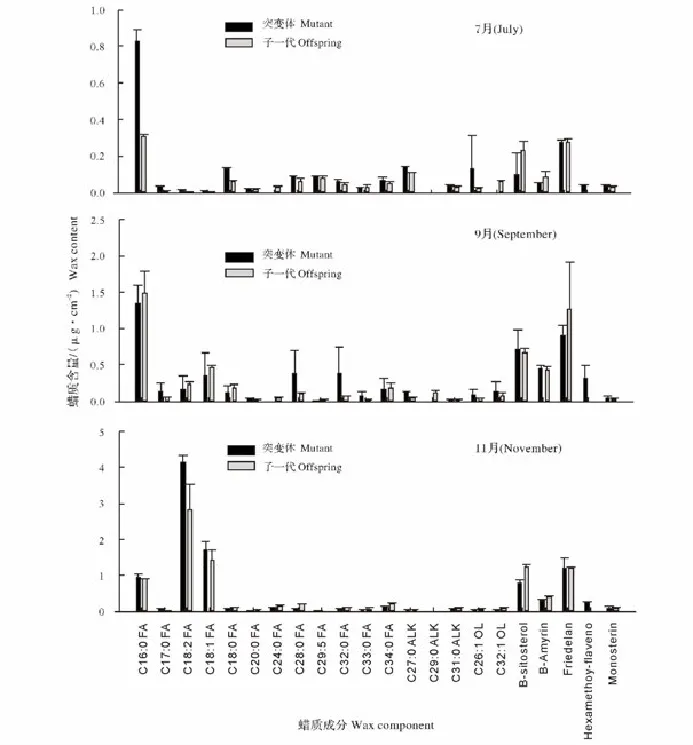
图2 果实发育期间(7—11月)蜡质成分的变化Fig.2 Change of theWax composition during the fruit development(from July to November)
7月样品中,突变体脐橙和子一代脐橙果皮含量有差异的有8种,分别为C16、C17、C18∶2、C18、C24和C28脂肪酸,C27烷烃以及C32∶1醇。突变体脐橙和子一代脐橙均是C16脂肪酸含量最高,突变体中C16脂肪酸含量为0.828 6μg/cm2,子一代为0.306 6μg/cm2,突变体显著高于子一代。此期间,变异和对照均未检测出C29烷烃和C30∶6烷烃,β-谷甾醇、β香树素、6甲氧基黄酮,软木三萜酮、单甘酯等成分均不存在显著差异。
9月中,突变体脐橙和子一代脐橙成分含量有显著差异的有3种,分别是C24、C28脂肪酸,C27烷烃。突变体脐橙和子一代脐橙均是C16脂肪酸含量最高,突变体中为1.339 3μg/cm2,子一代为1.481 8μg/cm2,突变体含量略低于子一代,但两者不存在显著差异。
果实成熟期(11月),突变体脐橙与子一代脐橙果皮蜡质差异成分主要有10种,分别为C18∶2、C29∶5不饱和脂肪酸、C20、C24、C28、C32、C34饱和脂肪酸、β-谷甾醇、β-香树精和 6 甲氧基黄酮。其中突变体脐橙中含量较高的为C18:2不饱和脂肪酸。子一代脐橙中含量较高的为C18∶2不饱和脂肪酸、C29烷烃、β-谷甾醇、软木三萜酮。另外13种蜡质成分虽然两者在含量上存在差异,但是差异都不显著。它们分别是分别为 C16、C17、C18、C33的饱和脂肪酸和 C18∶1 不饱和脂肪酸;C27、C29、C30、C31烷烃;C26∶1 和 C32∶1 的不饱和醇;软木三萜酮;单甘酯。
3 结论与讨论
迄今,人们已研究了很多柑橘品种的果皮蜡质成分,GC-MS技术也广泛应用在柑橘果皮精油成分研究[7]。通过GC-MS结果分析,大部分柑橘果实中,烷烃、醛、醇和脂肪酸都是主要的蜡质成分,但不同的柑橘品种和栽培环境的差异对蜡质组分影响很大[8-9]。例如,Sala等[10]研究表明,生长在西班牙巴伦西亚的奈维林娜脐橙和温州蜜柑的果皮蜡质成分中,醛类、烷烃和脂肪酸含量较高,初级醇和萜类物质含量较少,并且温州蜜柑果皮蜡质含量显著低于奈维林娜脐橙;而同样来自瓦伦西亚的富贵橘果皮蜡质主要成分由多到少依次为烷烃、脂类、酮类、醛类、脂肪酸、初级醇、萜类[11]。与前人的研究结果类似,本研究采用酶解法从纽荷尔果皮光泽型突变体及其高接子一代脐橙果皮中也分离出了脂肪酸、烷烃、醇类、三萜类化合物、小分子代谢产物、酯类等蜡质成分,但各蜡质种类的含量与前人研究有差异,这可能是由于品种和栽培环境的差异造成的。
果实的生长发育过程中,无论是突变体脐橙还是突变体脐橙子一代,其蜡质总量都是不断增加的。果实生长发育过程中各组分在总蜡质成分中所占比例也不断变化。这些结果表明,果实生长发育过程中,在持续不间断的分泌蜡质,单位面积的蜡质含量一致不断累积,但单位表面积各蜡质组分含量的增加速度不一致。和本文的研究结果一致,Sala等[10]研究也表明,生长在西班牙巴伦西亚的奈维林娜脐橙和温州蜜柑果皮蜡质总量随着果实的发育也不断增加。
本研究的主要目的是鉴定突变体脐橙与其高接子代果皮蜡质组成的差异。结果表明在3个发育时期,突变体和子一代的果皮蜡质总量差异不显著,并且除烷烃和小分子代谢产物外,脂肪酸、醇、三萜类化合物和酯类均差异不显著,所有的蜡质成分均不存在极显著差异。表明突变体与其高接子代的蜡质主要差异成分不显著。但是,对于某些单独的蜡质成分,如11月成熟期的C18∶2、C29∶5不饱和脂肪酸、C20、C24、C28、C32、C34饱和脂肪酸、β-谷甾醇、β-香树精和 6 甲氧基黄酮,突变体和子一代存在较大的差异。突变体和子一代各个时期的差异成分,除C24和C28脂肪酸是在7月、9月、11月3个时期均存在显著差异,在7月和9月均存在显著差异为C24、C28脂肪酸和C27烷烃,在7月和11月均存在显著差异为C18∶2、C24和C28脂肪酸,其他成分差异均只在单个月份发生。由于柑橘果皮蜡质结构和组成成分与柑橘种类、栽培环境、相对空气湿度、树体部位、果实不同的成熟度、树龄等有密切相关[9-13]。因此这些差异很可能由突变体母树与嫁接子一代树龄和栽培环境及管理措施的差异导致的。果实成熟过程中,糖类物质在有色层和果肉不断积累,酸类物质不断降解,氨基酸逐渐增加,多种代谢物在不同组织中变化各不相同,具有较强的组织特异性和阶段特异性[14]。因此,果实发育过程中单独时期的蜡质成分含量差异可能是由于阶段特异性和组织特异性所导致。
本研究表明,突变体异地高接子一代脐橙果皮具有和突变体相似的蜡质组成,是一个由基因突变导致的稳定遗传的芽变品种。
[1]Bernard A,Joubès J.Arabidopsis cuticularwaxes:advances in synthesis,export and regulation[J].Progress in Lipid Research,2013,52(1):110-129.
[2]Marcilla A,Martínez M,Carot Jm,et al.Relationship between sensory and physico-chemical quality parameters of cold-stored‘Clemenules’mandarins coated with two commercialwaxes[J].Spanish Journal of Agricultural Research,2009,7(1):181-189.
[3]Liu D C,Zeng Q,JiQ X,et al.A comparison of the ultrastructure and composition of fruits’cuticular wax from the wild-type“Newhall”navel orange(Citrus sinensis[L].Osbeck cv.Newhall)and its glossy mutant[J].Plant Cell Reports,2012,31(12):2239-2246.
[4]刘德春,曾琼,刘勇,等.‘纽荷尔’脐橙及其光泽型突变体果皮色差指数变化规律的研究[J].果树学报,2013,30(6):914-917.
[5]曾琼,吴启,王玥辰,等.纽荷尔脐橙果皮光泽型突变体贮藏性研究[J].江西农业大学学报,2013,35(3):525-529.
[6]Schönherr J,Riederer M.Plant cuticles sorb lipophilic compounds during enzymatic isolation[J].Plant,Cell and Environment,1986,9(6):459-466.
[7]黄远征,陈全友.110个种和品种的柑橘属植物叶精油的化学成分[J].植物学报,1998,40(9):846-852.
[8]Baker E A,Procopiou J,Hunt GM.The cuticles of citrus species:composition of leaf and fruit waxes[J].Journal of the Science of Food and Agriculture,1975,26(8):1093-1101.
[9]El-OtmaniM,Coggins CW J.Fruit age and growth regulator effects on the quantity and structure of the epicuticular wax of‘Washington’navel orange fruit[J].Journal of the American Society for Horticultural Science,1985,110(3):371-378.
[10]Sala JM,Lafuente,Cuñat P.Content and chemical composition of epicuticular wax of‘Navelina’oranges and‘Satsuma’mandarins as related to rindstaining of fruit[J].Journal of the Science of Food and Agriculture,1992,59(4):489-495.
[11]Sala JM.Content,chemical composition andmorphology ofepicuticularwax of Fortunemandarin fruits in relation to peel pitting[J].Journal of the Science of Food and Agriculture,2000,80(13):1887-1894.
[12]Chikaraishi Y,Naraoka H.Carbon and hydrogen is otopevariation of plantbiomarkers in a plant soil system[J].ChemicalGeology,2006,231(3):190-202.
[13]Xu SJ,Jiang PA,Wang ZW,etal.Crystal structures and chemical composition of leaf surfacewax depositions on the desert moss Syntrichia caninervis[J].Biochemical Systematics and Ecology,2009,37(6):723-730.
[14]刘淑桢,韩静雯,云泽,等.国庆1号温州蜜柑果实成熟过程中极性代谢物变化[J].中国农业科学,2012,45(21):4437-4446.
