贵州典型土壤中Cd形态分布及环境风险评价
2015-05-15王永平詹永发韩世玉
邢 丹,王永平,任 婧,苏 丹,詹永发,韩世玉*
(1.贵州省辣椒研究所,贵州 贵阳 550006;2.贵州大学 林学院,贵州 贵阳 550025;3.贵州省土壤肥料研究所,贵州贵阳550006)
土壤重金属污染是指由于人类活动导致土壤中某一或某些金属元素因过量沉积而引起含量过高的现象,其中Cd对生物体毒性较高,在土壤中的活性与移动性也较强,易通过食物链向人体中迁移和积累,对食品安全与人体健康具有严重的危害,因此需要格外关注土壤中Cd的环境风险效应。据调查显示,贵州省土壤中Cd含量平均值为0.659 mg/kg,已高于国家土壤环境质量标准(GB15618—1995)中二级标准(pH≤7.5 时,Cd 含量≤0.3 mg/kg;pH>7.5 时,Cd 含量≤0.6 mg/kg)的限量要求;同时,全省 Cd的单因子污染指数为4.05,已属于镉(Cd)的重污染区[1]。另有研究表明[2-3]贵州农用地土壤在长期的耕作过程中,承载了大量的Cd。然而贵州是典型的喀斯特地区,其土壤层较薄,生态较为脆弱,土壤污染影响了它的正常功能,限制了农业可持续发展。黄壤和石灰土作为贵州省典型的土壤类型,这两种土壤中Cd对环境危害风险程度尚未十分清楚,因此亟待开展相关研究。
目前,因重金属的生物毒性和生态效应与其结合形态密切相关[4-5],学者们越来越重视利用土壤中重金属赋存形态评估其对环境风险[6-8]。对于土壤赋存形态研究,以Tessier等[9]提出的Tessier法和欧共体标准局(Bureau Community of Reference,简称BCR)提出的BCR法[10-11]最为权威,它们为重金属形态分析、风险评价等研究做出了很大贡献[8,12-14]。尤其是BCR法稳定性及重现性较好、提取精度较高,能较好反映土壤中重金属元素的形态分布情况,已被许多学者用于评估重金属在土壤中的迁移性[15-16]。另一方面,BCR法对提取剂选择的多方面均衡考虑(低浓度以及无Ca、Mg元素)更有适于高灵敏度分析仪器如ICP-MS的测定[17]。
鉴于此,本研究模拟贵州省黄壤和石灰土遭受对食品安全、人体健康与生态环境都具有较高毒性的Cd后,采用BCR法探讨自然土壤和污染土壤中Cd不同形态分布情况,并评估黄壤和石灰土中Cd的环境风险危害,为贵州省Cd污染风险管理提供科学依据。
1 材料与方法
1.1 供试材料
供试土壤采自贵州省贵阳市清镇市青龙街道办事处石关村的耕作黄壤(N:26°34′,E:106°30′)和石灰土(N:26°34′,E:106°31′)。随机采集表层0~20 cm的混合土壤样品,为避免引起土壤二次污染,采样时用不锈钢铲,并用干净的编织袋盛装土壤样品。样品采回后自然风干后过5 mm不锈钢筛并去除植物根系,各类型土壤搅拌混匀保存备用。黄壤和石灰土各取50 g,四分法分为两部分,一部分研磨过10目尼龙筛用于测定土壤pH,一部分研磨过100目尼龙筛用于测定土壤有机质、全Cd含量。供试土壤理化性质见表1。

表1 供试土壤基本理化性质Tab.1 Basic physicochemical properties of the soils
1.2 试验设计
为模拟研究不同程度污染土壤中Cd赋存形态,按土壤类型布置了黄壤和石灰土2组盆栽试验,每组试验按添加 Cd2+浓度分为 5 个处理(T0=0 mg/kg,T1=0.5 mg/kg,T2=1.0 mg/kg,T3=2.5 mg/kg,T4=5.0 mg/kg),每个处理3次重复。根据试验的预设浓度,将CdCl2·2.5H2O分析纯溶于超纯水,然后以喷雾形式将其均匀喷洒于土样中。充分搅拌后将土样装入经稀酸浸泡并冲洗干净、带有托盘(接纳渗漏出的土壤溶液,以便倒回盆钵防止Cd液淋溶损失影响试验结果的准确性)的塑料盆钵中,盆钵大小为20 cm×25 cm,每盆装土3.5 kg。随后,将盆钵移入室内静置两周,用去离子水浇灌使土壤含水量保持在田间持水量的70%左右。
1.3 样品处理与分析测定
试验两周后,先将各盆土壤混匀,随后取出约20 g土壤风干、研磨、过100目尼龙筛,用于测定土壤中Cd全量及不同形态Cd含量。
研究中所涉及到主要测试指标及测定方法见表2。实验所用试剂均为优级纯,水为超纯水,所用器皿使用前均用10%HNO3浸泡过夜,用超纯水清洗干净。

表2 土壤测试指标及测定方法Tab.2 Analysis for indexes and methods in soils
1.4 质量控制与数据处理
采用Excel对数据进行处理。为确保结果的可靠性、准确性,实验过程采用平行样、空白样和Cd的土壤成分分析标准物质GBW-07405(GSS-5)进行质量控制。平行样品分析误差在5%的范围以内,Cd的回收率为94%~115%。
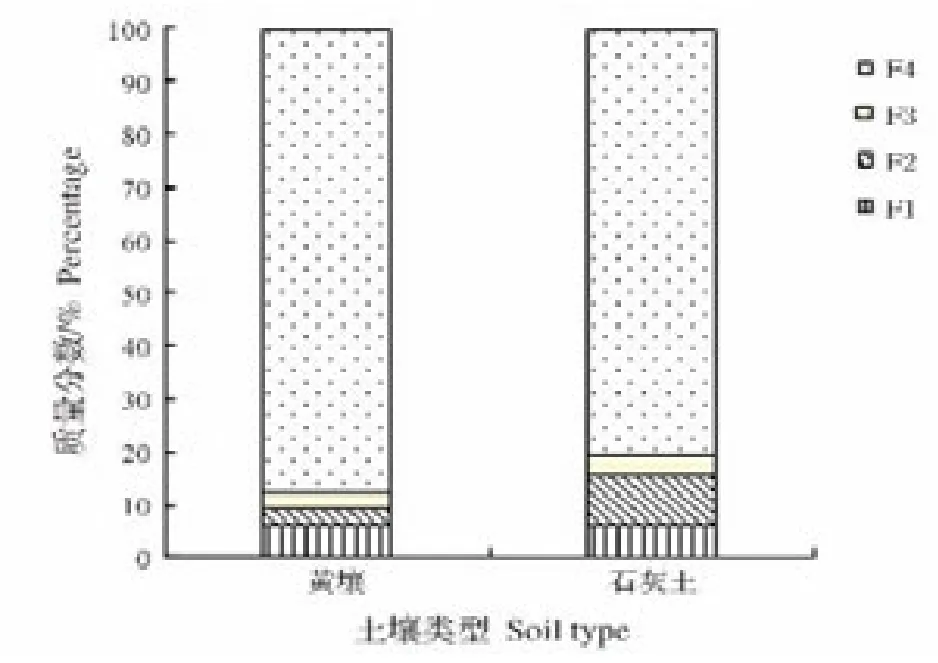
图1 自然条件下黄壤和石灰土中Cd形态分布Fig.1 Chemical speciation of Cd between yellow soils and calcareous soils under unpolluted condition
2 结果与讨论
2.1 自然条件下黄壤和石灰土中Cd形态分布
应用改进的BCR分步连续提取方法,分析了自然条件下即未添加Cd的黄壤和石灰土中酸溶态、可还原态、可氧化态和残渣态4种赋存相态,并通过对不同形态所占比例作图(图1)不难发现:
(1)黄壤中重金属Cd形态分布表现为:F4>F1>F2>F3,也就是 Cd 主要以残渣态形式存在于黄壤中,其所占比例高达87.55%。其次,酸溶态以5.96%的比例优于可还原态。然而可氧化态所占比例很低,不足3%。
(2)未污染的石灰土中仍是以残渣态的含量占绝对优势,占总量的80.56%;可氧化态含量最低,占3.61%;其余两个形态分布与黄壤中的不同,表现为可还原态>酸溶态。
总的来看,黄壤和石灰土中Cd主要以残渣态存在,这符合土壤自然形成过程中Cd大部分形态被结合在土壤矿物中以残渣态形式存在[20]。并且黄壤中Cd残渣态含量高于石灰土,这可能与供试土壤pH、Cd总量有关。pH是土壤化学性质的综合反映,其影响土壤Cd吸附解吸行为,进而影响着Cd残渣态含量。土壤中Cd总量对其残渣态影响受土壤pH、有机质等制约。因而两种供试土壤中Cd残渣态所占比例尚需综合考虑这些因素的影响。然而,可氧化态所占份额最小,这可能与土壤中有机质含量不高,尤其是可溶性有机质(Dissolved Organic Matter,DOM)含量不高有关。因为DOM含有大量的官能团,如-COOH、-OH、-NH2、-C=O等,它们通过与土壤中重金属发生络合或螯合反应,形成有机-金属配合物,起到充当“配位体”和“迁移载体”的作用,从而提高重金属的可溶性。
2.2 模拟污染土壤中Cd赋存形态分布特征
重金属在土壤中的形态分布特征是研究其污染行为的重要内容。不同类型污染土壤中毒性重金属元素Cd各形态分布情况见图,由图2看出:(1)人为添加CdCl2两周后,模拟污染黄壤和石灰土中酸溶态(F1)、可还原态(F2)、可氧化态(F3)Cd所占比例明显高于自然土壤,而残渣态(F4)低于自然土壤。
(2)不同Cd污染程度下,对作物伤害最大的酸溶态均表现为黄壤>石灰土,可还原态和可氧化态表现为黄壤<石灰土,而残渣态总体上趋于黄壤>石灰土。
(3)不同类型土壤中,Cd形态分布有异同。相同的是:① T1和T2处理中,残渣态是主导形态,其含量均高于42%;可氧化态质量分数最低,<8%。②T3处理中,黄壤和石灰土的酸溶态Cd变为主导形态,质量分数分别为48.45%和36.32%;可氧化态质量分数依旧最低,分别为3.83%和5.99%。③随着Cd处理浓度的增加,两种土壤中酸溶态和可还原态Cd质量分数也在增加,而残渣态降低。
不同的是:除T2处理残渣态Cd>酸溶态Cd>可还原态Cd>可氧化态Cd外,两种土壤在不同处理中Cd形态分布顺序不同。①污染黄壤中,T1、T3、T4处理下Cd的形态分布顺序分别为残渣态>酸溶态>可还原态>可氧化态、酸溶态>残渣态>可还原态>可氧化态、酸溶态>可还原态>残渣态>可氧化态。②污染石灰土中,T1、T3、T4处理下Cd的形态分配分别为残渣态>可还原态>酸溶态>可氧化态、酸溶态>可还原态>残渣态>可氧化态、可还原态>酸溶态>残渣态>可氧化态。
整体来看,不管是黄壤还是石灰土,酸溶态和可还原态Cd所占份额随着Cd处理浓度的增加而增加,而且明显高于自然土壤;但是,残渣态质量分数在降低,并且都低于自然土壤。从各处理来看,它们之间黄壤和石灰土中Cd各形态分布顺序不同,但Cd浓度为0.5 mg/kg和1.0 mg/kg时,残渣态占主导地位;浓度较高时,即Cd浓度为2.5 mg/kg时酸溶态开始显示出其优势,两种土壤均以酸溶态为主要形态;浓度达到预设最高浓度5 mg/kg时,黄壤仍以酸溶态为主要形态,石灰土却变为可还原态为主。

图2 模拟污染土壤中Cd赋存形态分布Fig.2 Chemical speciation of Cd in soils simulated different degrees of Cd pollution
土壤重金属形态主要受土壤环境体系中 pH[21-22]、Eh[23]等因子,土壤组分如有机质[24],重金属元素含量[25-26]的影响等。当这些条件发生改变时,重金属各形态所占比例随之发生变化。本研究中,供试黄壤pH、有机质含量均低于石灰土,但Cd总量高于石灰土。一般而言,土壤体系pH降低,Cd活性升高,也就是酸溶态Cd含量增加。不同类型土壤有机质中腐殖酸和胡敏酸所占比例不同,这两种酸与Cd形成的络合物溶解度不同,从而影响土壤中Cd形态特征。外源Cd进入土壤后的形态变化与其添加浓度总量密切相关,较低浓度外源Cd进入土壤后其形态会向背景Cd形态分布状态转变,而当较高浓度Cd进入土壤后向稳定的残渣态转变的过程更加漫长。因此,Cd浓度为0.5 mg/kg和1.0 mg/kg时残渣态占主导地位,浓度为2.5 mg/kg时酸溶态开始显示出其优势。另外,对于污染土壤可以根据它们提出相关的调控措施,从而使重金属的有效性降低,达到减小对环境、作物危害的目的。
2.3 基于RAC的黄壤和石灰土中Cd环境风险评价
土壤中重金属与水相平衡过程中,酸溶态重金属是最易于迁移的存在形态,因而对环境也易于产生风险危害[27]。因而,采用重金属酸溶态占总量比值,也就是风险评估编码(Risk Assessment Code,RAC)评价黄壤和石灰土中Cd对环境的危害风险。RAC是Perin G等[28]为了对环境风险进行定量评价,于1985年基于沉积物中重金属的不同存在形态对其有不同的结合力而提出。RAC定义是重金属的离子可交换态和碳酸盐结合态含量(二者之和也就是本研究中酸溶态含量)占重金属总量的百分比,并将其结果划分为5个等级,RAC<1%、1%~10%、11%~30%、31%~50% 和 >50%所对应的风险级别分别为Ⅰ(无)、Ⅱ(低)、Ⅲ(中)、Ⅳ(高)和Ⅴ(极高)风险。
黄壤和石灰土中Cd环境风险评价结果见图3。自然土壤中,Cd处于低风险水平。模拟污染土壤中,Cd风险程度伴随添加浓度增高而增加。其中,T1处理两种土壤Cd均处于中等风险状态;T2和T3处理黄壤Cd对环境呈现了高风险,T4处理下Cd对黄壤构成了极高风险;石灰土中,T2处理Cd处于中等风险状态,T3和T4处理对环境危害升高到高风险。由于Cd本身是一个活性较强、易于释放的重金属元素[3],其在土壤中化学行为受pH、有机质、本身浓度等影响,因而本研究中黄壤Cd对环境的危害高于石灰土。当黄壤遭受Cd污染时,其对环境所造成的危害风险应予以高度重视。
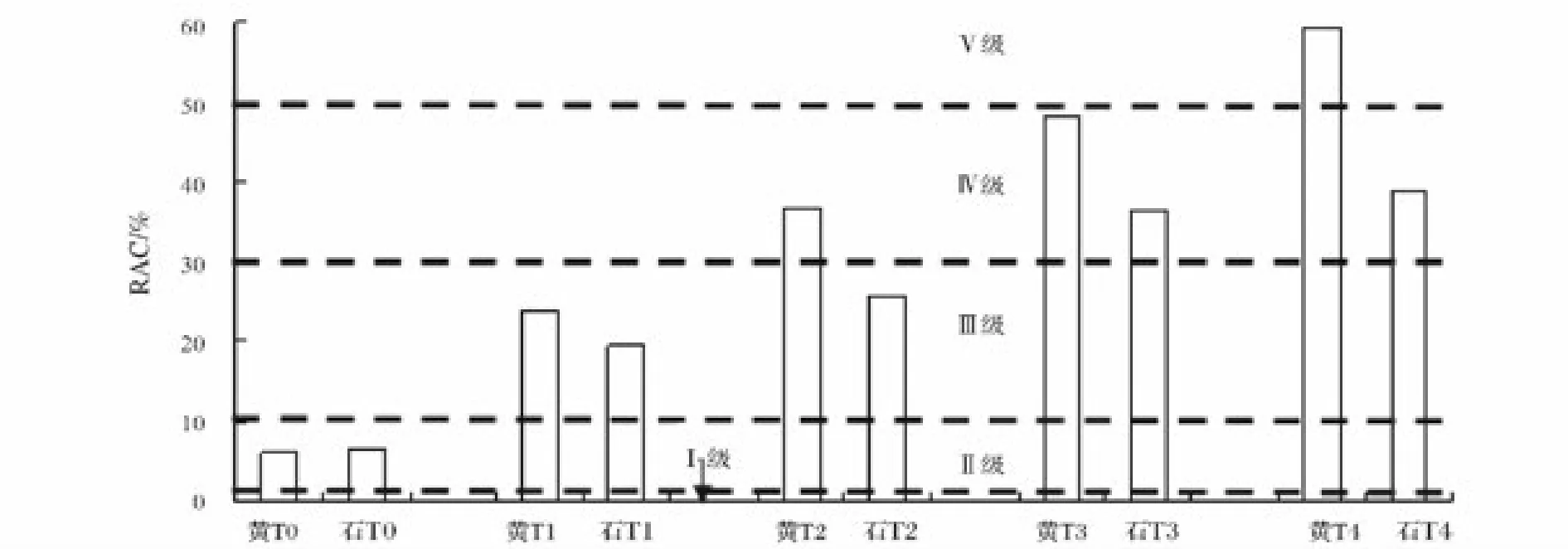
图3 各处理土壤中Cd环境风险程度Fig.3 Environmental risks of Cd in soil under different treatments
3 结论
(1)自然土壤形态分析表明,黄壤和石灰土中Cd绝大部分以非常稳定的残渣态存在,而非稳定态(包含酸溶态、可还原态和可氧化态)所占比例很低。
(2)不同类型污染土壤中Cd形态分布表明,Cd的酸溶态和可还原态所占比例明显高于自然土壤,特别是模拟污染为2.5 mg/kg和5 mg/kg土壤中,二者之和达65%以上。而且相比pH偏高的石灰土,黄壤中酸溶态Cd所占份额更高些。
(3)由风险评价编码法得出,自然土壤中Cd对环境危害处于低风险水平,但是污染土壤中Cd对环境构成中等以上的风险危害,而且随着污染程度加深,其风险性升高。总体上,黄壤中Cd对环境的危害高于石灰土。
(4)不同类型土壤中Cd形态分布及其对环境的危害,与其pH、有机质和Cd含量等均密切相关,尚需进一步探讨研究。
[1]张莉,周康.贵州土壤重金属污染现状与对策[J].贵州农业科学,2005,33(5):114-115.
[2]姜盛君,秦樊鑫,李存雄,等.贵州菜园土壤重金属赋存形态分布及生物有效性分析[J].贵州农业科学,2010,38(04):92-95.
[3]张清海,林绍霞,林昌虎.贵州农业非点源污染土壤重金属含量特征及区域差异性研究[J].中国环境监测,2011,27(1):88-91.
[4]宋琳琳,铁梅,张朝红,等.施用污泥对土壤重金属形态分布和生物有效性的影响[J].应用生态学报,2012,23(10):2701-2707.
[5]李如忠,姜艳敏,潘成荣,等.典型有色金属矿山城市小河流沉积物重金属形态分布及风险评估[J].环境科学,2013,34(3):1067-1075.
[6]章明奎,方利平,周翠.污染土壤重金属的生物有效性和移动性评价:四种方法比较[J].应用生态学报,2006,17(8):1501-1504.
[7]Sundaray S K,Nayak B B,Lin S,et al.Geochemical speciation and risk assessment heavy metals in the river estuarine sediments—A case study:Mahanadi basin,India[J].Journal of Hazardous Materials,2011,186(2/3):1837-1846.
[8]郭鹏然,雷永乾,蔡大川,等.广州城市污泥中重金属形态特征及其生态风险评价[J].环境科学,2014,35(2):684-691.
[9]Tessier A,Campbell PGC,Bisson M.Sequential extraction procedure for the speciation of particulate trace metals[J].Analytical Chemistry,1979,51(7):844-851.
[10]Ure A M,Quevauviller P,Muntau H,et al.Speciation of heavy-metals in soils and sediments-An account of the improvement and harmonization of extraction techniques undertaken under the auspices of the BCR of the commission of the European communities[J].International Journal of Environmental Analytical Chemistry,1993,51(1/4):135-151.
[11]Rauret G,López-Sánchez J F,Sahuquillo A,et al.Improvement of the BCR three-step sequential extraction procedure prior to the certification of new sediment and soil reference materials[J].Journal of Environmental Monitoring,1999,1(1):57-61.
[12]Kaasalainen M,Yli-Halla M.Use of sequential extraction to assess metal partitioning in soils[J].Environmental Pollution,2003,126(2):225-233.
[13]Dundar M S,Altundag H,Eyupoglu V,et al.Determination of heavy metals in lower Sakarya River sediments using a BCR-sequential extraction procedure[J].Environmental Monitoring and Assessment,2012,184:33-41.
[14]张芬,杨长明,潘睿捷.青山水库表层沉积物重金属污染特征及生态风险评价[J].应用生态学报,2013,24(9):2625-2630.
[15]Tokalioglu S,Kartal S,Gueltekin A.Investigation of heavy-metal uptake by vegetables growing in contaminated soils using the modified BCR sequential extraction method[J].International Journal of Environment Analytical Chemistry,2006,86:417-430.
[16]Pueyo M,Mateu J,Rigol A,et al.Use of the modified BCR three-step sequential extraction procedure for the study of trace element dynamics in contaminated soils[J].Environmental Pollution,2008,152:330-341.
[17]李非里,刘丛强,宋照亮.土壤中重金属形态的化学分析综述[J].中国环境监测,2005,21(4):21-27.
[18]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:12-14,106-108.
[19]Jia Y L,Xiao T F,Zhou G Z,et al.Thallium at the interface of soil and green cabbage(Brassica oleracea L.var.capitata L.):Soil– plant transfer and influencing factors[J].Science of the Total Environment,2013,450-451:140-147.
[20]周国华,黄怀曾,何红蓼,等.北京市东南郊自然土壤和模拟污染影响下Cd赋存形态及其变化[J].农业环境科学学报,2003(01):25-27.
[21]Kabra K,Chaudhary R,Sawhney R L.Effect of pH on solar photocatalytic reduction and deposition of Cu(Ⅱ),Ni(Ⅱ),Pb(Ⅱ)and Zn(Ⅱ):Speciation modeling and reaction kineties[J].Journal of Hazardous Materials,2007,149(3):680-685.
[22]Hasman H,Bjerrum M J,Christiansen L E,et al.The effect of pH and storage on copper speciation and bacterial growth in complex growth media[J].Journal of Mcrobiological Methods,2009,78(l):20-24.
[23]齐雁冰,黄标,Darilek J L,等.氧化与还原条件下水稻土重金属形态特征的对比[J].生态环境,2008,17(6):2228-2233.
[24]Nogueira P,Mel O M,Lombardi A T,et al.Natural DOM affects copper speciation and bioavailability to bacteria and ciliate[J].Archives of Environmental Contamination and Toxicology,2009,57(2):274-281.
[25]王美,李书田,马义兵,等.长期不同施肥措施对土壤铜、锌、镉形态及生物有效性的影响[J].农业环境科学学报,2014,33(8):1500-1510.
[26]Davies B E.Inter-relationships between soil properties and the uptake of cadmium,copper,lead and zinc from contaminated soils by radish(Raphanus sativus L.)[J].Water,Air,and Soil Pollution,1992,63(3/4):331-342.
[27]王鸣宇,张雷,秦延文,等.湘江表层沉积物重金属的赋存形态及其环境影响因子分析[J].环境科学学报,2011(11):2447-2458.
[28]Perin G,Craboledda L,Lucchese M,et al.Heavy metal speciation in the sediments of Northern Adriatic Sea.A new approach for environmental toxicity determination[A].In:Lakkas T D(Ed.).Heavy metal in the environment,1985,2:454-456.
