天花粉蛋白基因导入大豆的研究
2015-05-28任清政孙婷婷张匀华
邹 莉,任清政,孙婷婷,文 艺,张匀华
(1.东北林业大学,黑龙江 哈尔滨 150040;2.西藏出入境检验检疫局,西藏 拉萨 850000;3.黑龙江省农业科学院植物保护研究所,黑龙江 哈尔滨 150086)
大豆[Glycinemax(L.)Merrill]是重要的粮食、油料和饲料作物,是植物蛋白的主要来源,在国内外市场上占有十分重要的地位。但是大豆生育期病虫害严重,直接威胁着大豆生产[1]。利用基因工程手段,将具有抗病和抗虫特性的基因转入大豆,使大豆免遭病虫危害,在防治大豆病虫害中表现出很好的发展前景。目前,已通过基因工程手段获得抗虫 ,抗病 ,抗除草剂 ,以及品质得到改良的转基因大豆。但是,相对于其它作物如水稻[18-19]、烟草等,大豆属于较难进行遗传转化的物种[20-21]。近年来,大豆遗传转化系统较为常用的是农杆菌介导的子叶节转化系统。李文霞等[22]对农杆菌介导的大豆子叶节转化系统进行了优化。张福丽等[23]在农杆菌介导的大豆子叶节遗传转化中,通过添加L-半胱氨酸,提高了大豆的转化效率。陈李淼等[24]在子叶节转化系统中,研究了农杆菌浓度与侵染时间的最佳组合配比,乙酰丁香酮的浓度等,为优化大豆子叶节遗传转化系统提供一定的技术支持。
天花粉蛋白(Trichosanthin,TCS)是中草药天花粉的有效成分,它对病毒、真菌和昆虫有直接或间接的抑制和杀灭作用[25]。周长梅[26]采用根癌农杆菌介导法首次将TCS基因导入木本植物葡萄中,并获得了PCR阳性植株。刘静等[27]将TCS基因转化泡桐,并证明了转TCS基因泡桐对丛枝病具有一定的抗性。孙婷婷等[28]利用农杆菌介导法将TCS基因成功转入欧美杨108。到目前为止,将天花粉蛋白基因转入大豆中的研究鲜有报道,本试验通过构建具有TCS启动子及结构基因的植物表达载体,并在大肠杆菌中进行表达。采用农杆菌介导法转化大豆,最终获得转基因植株,以期提高其抗病虫性,为今后进行作物抗性分子育种提供优良的候选基因。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒 大肠杆菌(E.coli)DH5α,根癌农杆菌(Agrobacterium tumefaciens)LBA4404,质粒pT1-3、pCambia1381Xa均由北京大学提供。
1.1.2 植物材料 大豆种子合丰35,由黑龙江省农业科学院提供。
1.1.3 试剂与酶 限制性内切酶、回收试剂盒购自Promega公司,T4 DNA连接酶购自华美公司,地高辛探针标记试剂盒购自Roche公司。其它生化试剂购自北京鼎国公司。
1.1.4 培养基 基本培养基为MSB(MS无机成分+B5有机成分)培养基;诱导培养基:MSB+1.5 mg/L 6-BA+0.2 mg/L IBA;筛选培养基:MSB+1.5 mg/L 6-BA+0.2 mg/L IBA+500 mg/L Cefo+4 mg/L Hyg;生根培养基:1/2MSB+1.5 mg/L IBA;抑菌培养基:MSB+1.5 mg/L 6-BA+0.2 mg/LIBA+500 mg/L Cefo;伸长培养基:MSB+0.75 mg/L 6-BA+0.2 mg/L IBA+500 mg/L Cefo+4 mg/L Hyg。
1.1.5 引物 根据TCS的结构基因设计引物,由“PRIMER5”引物设计软件设计,由上海生工公司合成。所设计的引物如下:上游序列(5′-3′):GGGAAGCTTTGCCATATTGTTTCGATTC;下游序列(5′-3′):GGGCATATGGATGTTAGCTTCCGGTTA。
1.2 植物表达载体pC-tPro-TCS-GUS的构建
用限制性内切酶Sma I和Bgl II酶切质粒pCambia1381Xa,电泳后回收酶切产物,得到载体;用限制性内切酶Sac I酶切质粒pT1-3后补平,再用限制性内切酶Bgl II酶切,得到TCS启动子及结构基因,用T4 DNA连接酶连接到pCambia1381Xa的Sma I和Bgl II位点之间,16℃连接16 h以上,转化E.coli DH5α感受态细胞。提取质粒并进行Kpn I和Bgl II酶切鉴定,将筛选到的阳性克隆进行测序,测序正确的阳性菌株命名为pC-tPro-TCS-GUS。
1.3 克隆TCS基因在大肠杆菌中的表达
将测序正确的重组质粒转化E.coli DH5α,挑取单菌落接种于LB液体培养基(含50 mg/L卡那霉素)中,37℃振荡培养过夜。次日按1%的比例转接后,37℃振荡培养4 h,至OD600值达到0.5~0.6后,加入IPTG至终浓度为0.1 mmol/L,37℃诱导培养5 h,离心收集菌体,并进行SDS-PAGE鉴定。
1.4 大豆的遗传转化和T1代植株的获得
将构建好的植物表达载体用液氨冻融法导入农杆菌中。以合丰35为材料,参考Olhoft等[29]的方法切取并侵染大豆的子叶节。将大豆子叶节在诱导培养基上预培养1 d,用OD600=0.5的菌液侵染30 min,在诱导培养基(含有AS 100μmol/L)上共培养3 d,用MSB液体培养基冲洗以除去外植体表面残留的菌体,将子叶节接种到含有头孢霉素的抑菌培养基上培养6 d,待不定芽长到0.3~1.0 cm时,转入筛选培养基中进行筛选和继代,待抗性苗长约3~5 mm时,移入生根培养基中生根,共获得T0代转基因大豆19株。将PCR-Southern阳性的大豆植株种植于装有蛭石和土壤混合物的塑料桶中,收获T0代转基因大豆种子。2011年5月将T0代种子播种于试验田中,设未转基因大豆为对照,9月底收获T1代种子,晒干阴凉处贮存。
1.5 转 TCS基因大豆 T0和 T1代分子检测
采用CTAB法提取T0代和T1代大豆叶片总DNA,利用TCS结构基因的特异性引物进行PCR扩增。PCR反应条件为:94℃预变性,4 min;循环参数:94℃ 1 min,55℃ 1 min,72℃ 2 min,35个循环;72℃延伸,10 min。
从PCR为阳性的植株中选取转化植株进行PCR-Southern杂交分析。将PCR扩增产物进行0.7%琼脂糖凝胶电泳分离。采用高盐印迹法将凝胶上的DNA转移到尼龙膜上,地高辛标记检测试剂盒进行PCR-Souhern杂交。
2 结果与分析
2.1 植物表达载体pC-tPro-TCS-GUS的鉴定
将构建的植物表达载体pC-tPro-TCS-GUS转化大肠杆菌DH5α,对Kam平板上长出的菌落用PCR进行阳性克隆的筛选。提取重组质粒DNA,用KpnⅠ/BglⅡ双酶消化重组质粒pC-tPro-TCS-GUS,有一外源片段大小与TCS启动子及结构基因大小相等,约2 000 bp(图1),证明TCS启动子及结构基因正确地插入到表达载体pCambia1381Xa的SmaⅠ和BglⅡ位点之间,将筛选的阳性克隆测序,结果与文献报道一致。重组植物表达质粒pC-tPro-TCS-GUS构建成功(图2)。

图1 KpnⅠ/BglⅡ双酶切质粒pC-tPro-TCS-GUS电泳图谱Fig.1 Gel electrophoresis of pC-tPro-TCS-GUS plasmid cut by KpnⅠ /BglⅡ
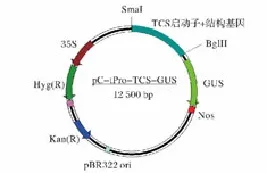
图2 植物表达载体pC-tPro-TCS-GUSFig.2 The plant expression vector pC-tPro-TCS-GUS
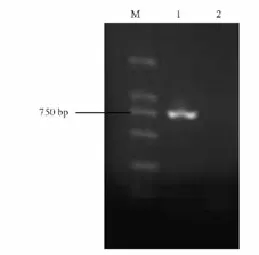
图3 目的基因的PCR扩增产物电泳图谱Fig.3 PCR analysis of pC-tPro-TCS-GUS

图4 天花粉蛋白在大肠杆菌中表达的SDS-PAGE检测Fig.4 SDS-PAGE analysis of TCS expression in E.coli DH5α
2.2 农杆菌工程菌的获得
将植物表达载体pC-tPro-TCS-GUS转化农杆菌LBA4404,提取质粒进行PCR扩增,扩增出约760 bp大小的目的条带(图3),与TCS结构基因大小相符。
2.3 克隆TCS基因在大肠杆菌中的表达
将重组质粒转化E.coli DH5α,经0.1mmol/L的IPTG 诱导培养5 h,4℃,6 000 g,离心收集菌体,进行SDS-PAGE鉴定。结果在相对分子质量约30 KD处有1条明显的条带(图4),与预期的TCS融合蛋白大小一致。结果表明:重组表达质粒pC-tPro-TCS-GUS的TCS基因在大肠杆菌中能够正常表达。
2.4 大豆转化抗性T0代植株的获得
大豆子叶节经农杆菌侵染和共培养后,在含有4 mg/L Hyg的抗性诱导培养基上诱导培养出现抗性不定芽。待抗性不定芽在抗性筛选伸长培养基上长成2~3 cm高的抗性再生苗,将抗性再生苗在不含Hyg的生根培养基上生根,获得再生植株(图5)。本研究转化1 840个外植体,共获得19株抗性再生T0代植株,转化频率为1.033%。

图5 合丰35子叶节经农杆菌介导转化后获得抗性T0代植株转基因植株Fig.5 Production of Hygromycin-resistant T0 plants by Agrobacterium tumefaciens-mediated transformation of Hefeng 35 Cotyledonary node
2.5 T1代植株的获得
将收获的23粒T0代转基因大豆种子播种于试验田中,共出苗18株T1代植株,转基因植株在大田中生长状况良好,豆粒饱满(图6)。9月底收获T1代种子,晒干阴凉处贮存,用于后代抗病虫性检测。

图 6播种40 d后T1代植株生长状况良好Fig.6 T1 plants grown well after sowing 40 d
2.6 转TCS基因大豆 T0和T1代分子检测
采用CTAB法分别提取T0和T1代抗性植株和未转化植株(阴性对照)叶片的总DNA,以含目的基因的质粒为阳性对照进行PCR扩增。由图7和图8电泳结果可以看出,T0和T1代抗性植株DNA扩增出与质粒DNA产物相同的特异性条带,分子量约为760 bp,而阴性对照株则没有扩增出相应的特异条带。初步证实,目的基因pC-tPro-TCS-GUS已转入到大豆基因组中。

图7 T0代转基因植株PCR检测Fig.7 PCR detection of T0 transgenic plants
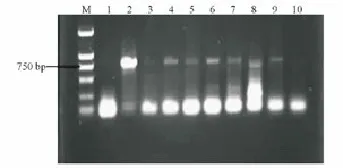
图8 T1代转基因植株PCR检测Fig.8 PCR detection of T1 transgenic plants
将PCR检测为阳性的T0代和T1代抗性植株进行PCR-Southern杂交,结果见图9和图10,表明PCR阳性株DNA扩增片段与质粒DNA扩增特异片段有杂交信号、且处于同一位置,而阴性对照植株则没有杂交信号,说明被检测阳性株扩增出的PCR条带确实为特异性的目标带,证明TCS基因已整合到T0代和T1代大豆植株基因组中。
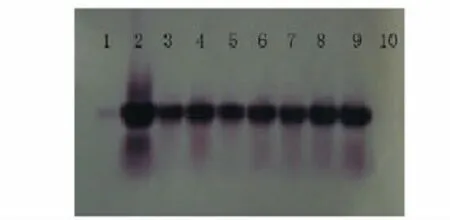
图9 T0代转基因植株的PCR-Southern杂交分析Fig.9 PCR-Southern detection of T0 transgenic plants
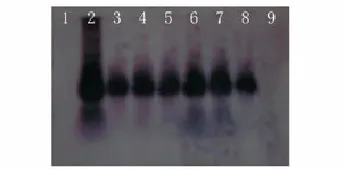
图10 T1代转基因植株的PCR-Southern杂交分析Fig.10 PCR-Southern detection of T1 transgenic plants
3 结论与讨论
天花粉蛋白作为中药,在医药领域的应用已经引起广泛重视,近年来研究发现,该蛋白能抑制艾滋病病毒(HIV)在感染的免疫活性细胞内复制繁衍,降低免疫活性细胞中的艾滋病病毒感染的活性细胞数[25]。本研究所构建的植物表达载体pC-tPro-TCS-GUS带有TCS启动子及结构基因,并且把TCS启动子及结构基因与GUS报告基因的开放阅读框架连接在一起,融和阅读框架的表达产物是一个杂和蛋白,它是否会影响天花粉蛋白的空间结构,改变天花粉蛋白的特性,有待于进一步的研究。
在转化植株鉴定时,对抗性植株进行PCR检测,可初步断定外源基因是否整合到大豆的基因组中,并且此种方法简便、快速,可短时间内对大量抗性植株进行检测。PCR检测可筛选出大量的非转化植株,对已得到的转化植株需进一步用Southern杂交证明其植物体的染色体内是否已整合进目的基因。
通过对TCS基因转移及其在植物中表达的深入研究,可为获得转TCS基因的重要粮食作物和转基因树木提供理论依据;探讨TCS基因对植物病毒、病原真菌和害虫的抑制作用,为利用TCS基因进行植物病虫害防治提供参考依据。
本研究成功构建了植物表达载体pC-tPro-TCS-GUS,并以大豆子叶节为受体材料,采用农杆菌介导法进行了遗传转化,获得了转TCS基因T0代和T1代抗性植株,经PCR、PCR-Southern检测,目的基因已成功导入大豆基因组中,为大豆抗病虫育种提供了基础材料。但目前获得的只是初步的结果,为了获得有应用前景的抗病虫转基因大豆材料,还需尽可能扩大后代群体的规模,从中筛选出TCS基因稳定遗传、抗病虫效果良好的可用于生产实践的转基因大豆新品种。
[1]罗振锋,李启云.转基因大豆产业化现状及展望[J].大豆科学,2005,24(3):220-223.
[2]ParrottW A,All JN,Adang M J,et al.Recovery and evaluation of soybean plants transgenic for a Bacillus thuringiensisvar Kurstaki insecticidal gene[J].In Vitro Cellular & Developmental Biology-Plant,1994:30(7):144-149.
[3]Stewart CN,Adang M J,All JN,et al.Genetic transformation,recovery and characterization of fertile soybean transgenic for synthetic Bacillus thuringiensis cry Iac gene[J].Plant Physiology,1996,112:121-129.
[4]苏彦辉,王慧丽,俞梅敏,等.苏云金芽孢杆菌杀虫晶体蛋白基因导入大豆的研究[J].植物学报,1999,41(10):1046-1051.
[5]周思君,李希臣,刘昭军,等.通过农杆菌介导法将Bt(cryIA)基因导入大豆[J].大豆科学,2001,20(3):157-162.
[6]王萍,王罡,季静,等.大豆体细胞胚胎发生与农杆菌介导的遗传转化[J].遗传,2004,26(5):695-700.
[7]刘德璞,廖林,袁膺,等.导入外源 DNA 获得抗 SMV 大豆品系[J].大豆科学,1997,16(4):277-282.
[8]徐香玲,李兴华,刘伟华,等.Ri质粒介导大豆花叶病毒外壳蛋白基因转化大豆的研究[J].大豆科学,1996,15(4):279-288.
[9]徐香玲,邹联沛,刘伟华,等.向大豆导入几丁质酶基因的初步研究[J].大豆科学,1999,18(2):101-108.
[10]Clemente T E,LaVallee B J,Howe A R,et al.Progeny analysis of glyphosate selected transgenic soybeans derived from Agrobacterium-mediated transformat-ion[J].Crop Science.2000,40(3):797-803.
[11]Zhang Y,Yang B Y,and Chen S Y.Inheritance analysis of herbicide-resistant transgenic soybean lines[J].Acta Genetica Sinica,2006,33(12):1105-1111.
[12]赵桂兰,陈锦清,尹爱萍,等.获得转反义 PEP基因超高油大豆新材料[J].分子植物育种,2005,3(6):792-796.
[13]赵桂兰,刘艳芝,李俊波,等.影响农杆菌介导的大豆基因转化因素的研究[J].大豆科学,2001,20(2):84-88.
[14]龚剑,刘春林,郭纯.人胰岛素A、B链基因表达载体的构建与大豆遗传转化[J].江苏农业科学,2005(2):27-31.
[15]龚学臣,季静,抗艳红,等.八氢番茄红素合成酶基因(PSY)对大豆的遗传转化[J].大豆科学,2005,24(1):30-33.
[16]康小虎,欧阳青,吴存祥,等.转γ-生育酚甲基转移酶基因大豆的获得[J].大豆科学,2004,23(3):236-238.
[17]李明春,卜云萍,王广科,等.深黄被孢霉△6-脂肪酸脱氢酶基因在大豆中的表达[J].遗传学报,2004,31(8):858-863.
[18]Toriyana K,Arimoto Y,Uchimiya H,et al.Transgenic rice plants after direct gene transfer protoplasts[J].Bio Technology,1988,6:1072-1074.
[19]Shimamoto K,Terada R,Lzawa T,et al.Fertile transgenic rice plants regenerated from transformed protoplasts[J].Nature,1989,338:274-276.
[20]刘海坤,卫志明.大豆遗传转化研究进展[J].植物生理与分子生物学报,2005,31(2):126-134.
[21]王萍,王罡,季静,等.大豆转基因体系的研究进展[J].遗传,2004,26(6):969-976.
[22]李文霞,宁海龙,吕文河,等.农杆菌介导大豆子叶节转化系统的优化[J].中国农业科学,2008,41(4):971-977.
[23]张福丽,张怡,周玲,等.L-半胱氨酸对农杆菌介导的大豆子叶节转化的影响[J].东北林业大学学报,2012,40(7):139-141,144.
[24]陈李淼,田星星,单志慧,等.利用农杆菌介导法转化大豆子叶节的影响因素研究[J].大豆科学,2012,31(1):17-23.
[25]胡苹,安成才,李毅,等.原核表达的天花粉蛋白和另外两种蛋白具有体外抗真菌活性[J].微生物学报,1999,39(3):234-240.
[26]周长梅.农杆菌介导法将天花粉蛋白基因导入葡萄的研究[D].哈尔滨:东北农业大学,2002.
[27]刘静,黄艳艳,翁曼丽,等.TCS 基因转化泡桐及抗病能力[J].林业科学,2011,47(5):171-176.
[28]孙婷婷,邹莉,许继飞,等.天花粉蛋白基因导入欧美杨108[J].东北林业大学学报,2014,42(9):73-76.
[29]Olhoft PM,Flagel L E,Donovan CM,et al.Efficient soybean transformation using hygromycin B selection in the cotyledonary-nodemethod[J].Planta,2003,216(5):723-735.
