细菌Ⅶ型分泌系统的研究进展
2015-05-25于俊媛姜北张骁鹏黎庶胡晓梅
于俊媛,姜北,张骁鹏,黎庶,胡晓梅
第三军医大学微生物学教研室,重庆 400038
细菌Ⅶ型分泌系统的研究进展
于俊媛,姜北,张骁鹏,黎庶,胡晓梅
第三军医大学微生物学教研室,重庆 400038
细菌分泌系统参与细菌物质转运,是细菌蛋白或DNA胞外分泌的重要途径,与细菌的生长和致病性密切相关。迄今为止,已发现了Ⅰ~Ⅶ型分泌系统。Ⅰ~Ⅵ型分泌系统存在于革兰阴性菌中,其中Ⅳ型也存在于革兰阳性菌中;Ⅶ型则存在于革兰阳性菌中。Ⅶ型分泌系统是近年来发现的一种特殊分泌系统,能介导病原微生物毒力蛋白分泌,与宿主相互作用,并参与细菌体内锌铁平衡等,在革兰阳性菌的生长代谢及致病过程中发挥重要作用。本文综述细菌Ⅶ型分泌系统的类型、功能及表达调控,以增进对这一新型细菌蛋白分泌机制的认识。
Ⅶ型分泌系统;结核分枝杆菌;金黄色葡萄球菌;蛋白分泌;毒力
细菌分泌系统能介导生物大分子的跨膜转运,与细菌的生存及致病性密切相关。致病菌通过分泌毒力因子等生物大分子在宿主体内定植、繁殖、扩散并致病,非致病菌通过分泌各种效应分子以适应环境变化。以往关于细菌分泌系统的研究主要集中于革兰阴性菌,已发现并命名了Ⅰ~Ⅵ型分泌系统。与革兰阴性菌相比,革兰阳性菌没有结构复杂的外膜,细胞壁结构相对简单[1],蛋白质分泌机制也不同。在革兰阳性菌,具有典型信号肽序列的蛋白可通过Sec途径和Tat(双精氨酸)途径转运至胞外。其中,Sec途径主要介导未折叠蛋白的跨膜分泌,Tat途径则介导折叠蛋白的分泌转运[2,3]。然而,革兰阳性菌分泌的部分蛋白不带典型信号肽序列,不能通过Tat或Sec途径进行胞外转运。近年来研究发现,一种特殊的细菌分泌系统参与了革兰阳性菌不含典型信号肽序列的蛋白跨膜运输,继Ⅰ~Ⅵ型分泌系统之后被命名为Ⅶ型分泌系统(typeⅦsecretion system,T7S system,T7SS)。
1 T7SS的发现及类型
T7SS是新近发现的细菌分泌系统,镶嵌于革兰阳性菌细胞膜中,最先在结核分枝杆菌中发现。结核分枝杆菌细胞壁最外层具有高度疏水、几乎不通透的分枝菌酸膜,而蛋白分泌要跨越分枝菌酸膜就需要一种特殊的蛋白分泌系统。通过比较致病性结核分枝杆菌与减毒卡介苗的基因组,发现RD1序列的缺失是导致其蛋白分泌及毒力差异的遗传学原因。对RD1序列的研究发现,其编码蛋白构成一个蛋白分泌系统,命名为 T7SS[4,5]。序列比对显示,在金黄色葡萄球菌、枯草芽孢杆菌、白喉棒状杆菌、产单核细胞李斯特菌、无乳链球菌等致病性革兰阳性菌的基因组中,均有类似的T7SS编码基因存在(图1)[6];耻垢分枝杆菌[7]、海洋分枝杆菌[8]等非致病性分枝杆菌中也存在T7SS相关基因的同源结构。随着研究的深入,在链霉菌属的植物病原菌疮痂病链霉菌[9]和天蓝色链霉菌[10]中也发现了类似的分泌系统存在。
分枝杆菌T7SS为由多个6 kDa早期分泌性抗原靶(6 kDa early secretory antigenic target,ESAT-6)家族基因串联而成的基因簇,其中有5个同源的大基因座,分别命名为ESX-1(Rv3866~Rv3883c)、ESX-2(Rv3884c~Rv3895c)、ESX-3(Rv0282~Rv0292)、ESX-4(Rv3444c~Rv3450c)和 ESX-5(Rv1782~Rv1798)(图2)。进化分析得知,这5种不同的基因簇是通过基因复制形式产生的,产生的先后顺序是ESX-4、ESX-1、ESX-2、ESX-3、ESX-5[11]。其中,发现最早、研究最深入的是ESX-1,因其参与结核分枝杆菌毒力因子ESAT-6的分泌而受到关注。ESX-5主要与脯氨酸-脯氨酸-谷氨酸(proline-proline-glutamic acid,PPE)蛋白的分泌相关;ESX-3涉及分枝杆菌中的锌铁平衡;而ESX-2和ESX-4的功能至今尚不清楚。

图1 不同种属的T7SS基因结构比对Fig.1 Genetic structures of T7SS in different species
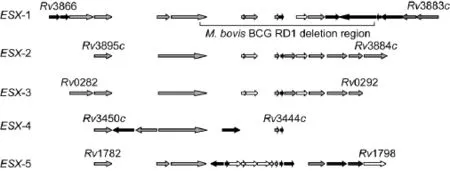
图2 ESX-1~ESX-5基因结构Fig.2 Genetic structures of ESX-1to ESX-5
金黄色葡萄球菌基因组中也存在与结核分枝杆菌ESX基因同源的基因簇,包括8个基因(图3),编码膜蛋白成分(如EssA、EssB、EssD)、效应分子(如EsxA、EsxB)及一些与 EsxA、EsxB分泌相关的蛋白。

图3 已知金黄色葡萄球菌ESS系统编码基因Fig.3 Known coding genes of ESS system in S.aureus
2 T7SS的功能
研究表明,T7SS与细菌毒力相关蛋白分泌、DNA传递、细菌锌铁平衡等功能相关。
2.1 分泌毒力相关蛋白
2.1.1 WXG100蛋白家族WXG100蛋白家族由长度约100个氨基酸的蛋白组成,因其区域中心具有保守的WXG(Try-X-Gly)氨基酸序列结构域而得名。该蛋白家族广泛存在于革兰阳性菌中,其编码基因多位于ESX基因簇上,是T7SS的典型分泌底物。
目前WXG100家族中研究最为广泛的是结核分枝杆菌的毒力因子ESAT-6和培养滤过蛋白10 (culture filtrate protein 10,CFP-10),由ESX-1系统分泌出胞,敲除 ESX-1基因座会导致 ESAT-6和CFP-10分泌阻断,细菌毒力衰减。ESAT-6和CFP-10在分泌时形成异源二聚体,两者的分泌相互依赖[12]。在结核分枝杆菌侵染巨噬细胞过程中,巨噬细胞中脂质稳态受到扰动而形成泡沫现象。胞内泡沫可作为结核分枝杆菌的营养来源并形成利于细菌生存的环境。ESAT-6能介导这一反馈循环[13]。Simeone等[14]研究发现,ESAT-6在结核分枝杆菌进入宿主细胞过程中发挥功能,而ESAT-6的C端截短导致毒力衰减,表明在结核分枝杆菌引起宿主细胞坏死过程中,ESAT-6的C端起重要作用[15]。另外,在结核分枝杆菌体内及体外感染巨噬细胞过程中,ESX-1还可通过诱导Ⅰ型干扰素﹝α干扰素(interferon α,IFN-α)及IFN-β﹞[16]和Ⅱ型干扰素(IFN-γ)[17]的产生影响巨噬细胞的代谢活动来操控宿主的免疫反应,引起巨噬细胞坏死,敲除实验证明这一过程依赖ESAT-6/CFP-10的参与。这些研究表明,在结核分枝杆菌感染宿主细胞过程中,ESX-1及其分泌蛋白ESAT-6对宿主细胞的代谢具有调控作用,而这种调控对结核分枝杆菌侵染宿主细胞起重要作用。
在金黄色葡萄球菌中,与ESAT-6和CFP-10同源的蛋白是EsxA和EsxB。EsxA和EsxB也包含WXG结构域,属于WXG100蛋白家族,合成后通过T7SS转运到胞外而发挥功能。EsxA与金黄色葡萄球菌感染过程中脓肿的形成有关[18]。纯化的EsxA蛋白可作为抗原来检测金黄色葡萄球菌感染患者血清中的EsxA抗体,提示EsxA可用作制备疫苗的抗原[19]。与结核分枝杆菌中ESAT-6和CFP-10共同分泌方式一样,金黄色葡萄球菌中EsxB与EsxA的合成与分泌也是相互依赖的。曾有人推测EsxB与EsxA也能相互作用形成异二聚体;但 Anderson等[20]研究发现,金黄色葡萄球菌T7SS的非典型底物EsxC和EsxD(不属于WXG100蛋白家族)分别能与EsxA、EsxB相互作用形成复合物,EsxC和EsxA还能自身聚合形成复合物,而EsxA和EsxB并不能聚合,表明EsxA与EsxB之间分泌的相关性并非源自它们的直接相互作用,或许有其他分泌因子参与和协同,但具体分子机制尚不清楚。
在对结核分枝杆菌、金黄色葡萄球菌及其他种属细菌WXG100蛋白家族的研究中发现,这种分泌蛋白之间相互聚合形成复合物的现象广泛存在,但这些聚合蛋白之间并不存在明显的序列同源性,而表现出一定肽段折叠方式的相似性。因此,人们推测分泌蛋白之间的相互作用可能是因为某些保守结构基序的存在,但具体是哪种结构基序参与其中,尚有待进一步研究。同时,这种序列多样性可能与感染过程中病原菌的免疫逃逸相关。
2.1.2 脯氨酸-谷氨酸/PPE蛋白脯氨酸-谷氨酸(proline-glutamic acid,PE)/PPE蛋白家族以其特有的P-E、P-P-E序列而命名,还具有多个N端重复序列。PE/PPE蛋白家族是分枝杆菌特有的,在结核分枝杆菌和海洋分枝杆菌等病原菌中的表达量较高。PE/PPE蛋白家族的生理学功能目前还不清楚,研究表明这一家族的某些成员在宿主-病原体相互作用和发病机制等方面发挥功能[21-24]。在分枝杆菌中,PE/PPE家族的蛋白是通过 ESX-5分泌的[25]。研究证明,一种特殊的PPE蛋白——PPE2 (Rv0256c)能阻止活化巨噬细胞中一氧化氮(nitric oxide,NO)(NO及其副产物对细菌具有毒性)的产生,细菌可能通过诱导PPE2蛋白表达阻止侵染细胞过程中产生过量NO来实现自我保护[26]。
2.2 参与细菌间DNA的传递
与T4SS一样,T7SS不仅能参与革兰阳性菌的蛋白分泌,还参与细菌间DNA的传递。在耻垢分枝杆菌接合作用中,通过构建供体菌转座子插入突变体库研究DNA转移调控因子时发现,插入突变体的突变位点是相对集中的,多位于RD1区域,而突变体接合作用频率显著增加,表明在耻垢分枝杆菌接合作用中ESX-1起负调节作用[27]。然而,在受体菌转座子突变文库筛选过程中发现,接合作用缺陷突变体多在ESX-1或与之相关的区域发生突变,证明ESX-1在受体菌中的作用与在供体菌中相反,有促进作用[28]。
2.3 维持体内锌铁平衡
不同于ESX-1和ESX-5,ESX-3通过影响细菌的锌铁平衡与细菌的体外生长和发育密切相关。铁是多种酶的辅因子,还与电子传递及氧代谢相关,而过量的铁和锌对细菌的生长是有毒性的,因此锌和铁的摄入调节对细菌的正常生长和发育具有重要作用。结核分枝杆菌ESX-3的转录与IdeR(铁依赖阻遏物)和Zur(锌吸收调控蛋白)的表达密切相关,对应不同的铁和锌浓度而受到调节,因此推测ESX-3与分枝杆菌胞内二价阳离子特别是体内铁和锌平衡相关[29]。在耻垢分枝杆菌中,ESX-3的调节与铁浓度的变化相关[30]。Serafini等构建的结核分枝杆菌ESX-3条件突变株只能在高浓度锌和铁的条件下及野生株的培养上清液中生长,表明结核分枝杆菌中ESX-3与锌铁摄入的调节相关[31]。最近,Loots等[32]应用代谢组学方法比较耻垢分枝杆菌ESX-3敲除株与野生株的代谢情况,铁在ESX-3敲除株中积累,这可能是因为ESX-3敲除株中铁摄入相关基因表达上调,同时ESX-3敲除导致铁蛋白合成增加或参与细胞内多余铁的输出。ESX-3可能通过对锌铁平衡的调节来实现对分枝杆菌体外生长的影响。
2.4 其他功能
T7SS除参与细菌毒力相关蛋白分泌、DNA传递及调节细菌锌铁平衡外,还有一些其他功能。例如,在链霉菌属的植物病原菌疮痂病链霉菌[9]和天蓝色链霉菌[10]的研究中发现,T7SS分泌产物EsxA/B与其生长周期及孢子的发育形成有关,但敲除疮痂病链霉菌T7SS组分对其致病性没有影响。另外,T7SS与产单核细胞李斯特菌的毒力也没有相关性[33]。从进化角度讲,出现T7SS与毒力不相关的现象可能是由于T7SS最初产生并不是参与毒力因子分泌,只是在进化过程中获得了分泌毒力因子的功能[34]。
3 T7SS的调控相关基因
近年来研究表明,T7SS的功能发挥受构成性基因簇外基因元件的调控。
3.1 ESX-1功能的调节
3.1.1 espA-espC-espD基因簇在分枝杆菌中,espA-espC-espD(Rv3616c-Rv3615c-Rv3614c)基因簇与ESX-1基因簇在基因组中不相邻,但能影响ESX-1功能的发挥。espA-espC-espD基因簇编码的分泌性蛋白为 EspA(Rv3616c)、EspC(Rv3615c)和EspD(Rv3614c)。其中,EspA经ESX-1分泌并与ESAT-6的分泌相互依赖,EspC包含一段EspA和ESAT-6分泌必需的信号序列,EspD能使细胞内EspA和EspC水平保持稳定[35]。对结核分枝杆菌EspA蛋白的氨基酸残基突变研究显示,EspA多个位点氨基酸残基的置换会导致ESAT-6及CFP-10的分泌受阻并引起细菌毒力变化,但不同氨基酸残基对EspA功能的影响有所不同[36]。
3.1.2 MprAB双组分系统MprAB双组分系统包括反应调节子MprA和组氨酸激酶MprB,与结核分枝杆菌持续感染过程相关,并参与结核分枝杆菌胁迫应答[37]。espA基因簇中的几个基因形成一个操纵子,在espA启动子中存在几个MprA结合位点。MprA对espA操纵子有抑制作用,mprAB基因敲除可导致espA及其下游基因过表达[38]。与野生株相比,mprAB突变株(Rv-D981)ESX-1功能异常,EspA和ESAT-6的分泌显著减少[39]。这些实验证明,MprAB双组分系统可通过直接影响espA基因簇的表达而间接调节结核分枝杆菌ESX-1功能。
3.1.3 其他与ESX-1相关的调节子除对ESX-1有直接作用的espA-espC-espD基因簇和起间接调节作用的MprAB双组分系统外,ESX-1还受其他调节子的调控。EspR能结合espA启动子,激活espA操纵子转录,促进ESX-1转录。espR缺失导致espA操纵子及ESX-1转录降低,ESAT-6分泌丧失,毒性降低[40]。PhoPR双组分系统也具有激活espA操纵子的功能;PhoPR还能感知低pH值,与espA操纵子在酸性条件下表达上调相关[41]。另外,CAMP受体蛋白(CAMP receptor protein,CRP)和核酸相关蛋白Lsr2也能抑制espA操纵子的转录[42,43]。
3.2 金黄色葡萄球菌中ESX分泌系统的调节
EsxA是由金黄色葡萄球菌ESX分泌系统分泌的毒力相关因子。最近有研究表明,esxA转录受一个与σB相关的级联单位的调节,该级联单位包含副调节子SarA、双组分系统ArlRS和SpoVG。SarA或σB失活条件下,esxA转录上调,但在 arlR和spoVG突变体中表达受抑制,表明SarA或σB抑制esxA表达,而ArlR和SpoVG则对esxA转录起促进作用。SpoVG是一个σB依赖元素,通过抵消σB引起的SarA活动抑制esxA转录[44]。另外,在agr基因突变株中,esxA转录减少,但这种转录量降低对其他esx基因簇相关基因的表达情况目前还没有报道。
4 结语
革兰阳性菌T7SS是近年来发现的细菌分泌系统。目前,对这一新型分泌系统的研究主要集中在一些重要的病原微生物,如结核分枝杆菌的ESX-1和ESX-5、金黄色葡萄球菌的ESS系统等方面。相关研究大多处于初级阶段,对其认识极其有限。T7SS确切的亚基组成、行使蛋白外排功能的具体机制及其在细菌生长与繁殖及致病中的作用等均有待深入研究。这些研究结果不仅促进人们对结核分枝杆菌、金黄色葡萄球菌等革兰阳性菌生长和代谢及致病机制的认识,还可为相应感染性疾病的预防、诊断及新药物的开发提供新思路及潜在靶标。
[1] Schneewind O,Missiakas DM.Protein secretion and surface display in Gram-positive bacteria[J].Philos Trans R Soc Lond B Biol Sci,2012,367(1592):1123-1139.
[2] Natale P,Brüser T,Driessen AJ.Sec-and Tat-mediated protein secretion across the bacterial cytoplasmic membrane—distinct translocases and mechanisms[J].Biochim Biophys Acta,2008,1778(9):1735-1756.
[3] Beeckman DS,Vanrompay DC.Bacterial secretion systems with an emphasis on the chlamydial typeⅢ secretion system[J].Curr Issues Mol Biol,2010,12(1):17-41.
[4] Pym AS,Brodin P,Majlessi L,Brosch R,Demangel C,Williams A,Griffiths KE,Marchal G,Leclerc C,Cole ST.Recombinant BCG exporting ESAT-6 confers enhanced protection against tuberculosis[J].Nat Med,2003,9(5):533-539.
[5] Abdallah AM,Gey van Pittius NC,Champion PA,Cox J,Luirink J,Vandenbroucke-Grauls CM,Appelmelk BJ,Bitter W.TypeⅦ secretion—mycobacteria show the way[J].Nat Rev Microbiol,2007,5(11):883-891.
[6] Pallen MJ.The ESAT-6/WXG100 superfamily—and a new Gram-positive secretion system[J]?Trends Microbiol,2002,10 (5):209-212.
[7] Converse SE,Cox JS.A protein secretion pathway critical for Mycobacterium tuberculosis virulence is conserved and functional in Mycobacterium smegmatis[J].J Bacteriol,2005,187(4): 1238-1245.
[8] Abdallah AM,Verboom T,Hannes F,Safi M,Strong M,Eisenberg D, Musters RJ, Vandenbroucke-Grauls CM,Appelmelk BJ,Luirink J,Bitter W.A specific secretion system mediates PPE41 transport in pathogenic mycobacteria[J].Mol Microbiol,2006,62(3):667-679.
[9] Fyans JK,Bignell D,Loria R,Toth I,Palmer T.The ESX/ typeⅦ secretion system modulatesdevelopment,butnot virulence,of the plant pathogen Streptomyces scabies[J].Mol Plant Pathol,2013,14(2):119-130.
[10] Akpe San Roman S,FaceyPD,Fernandez-MartinezL,Rodriguez C,Vallin C,Del Sol R,Dyson P.A heterodimer of EsxA and EsxB is involved in sporulation and is secreted by a typeⅦ secretion system in Streptomyces coelicolor[J].Microbiology,2010,156(Pt 6):1719-1729.
[11] Gey Van Pittius NC,Gamieldien J,Hide W,Brown GD, Siezen RJ, Beyers AD. The ESAT-6 gene cluster of Mycobacterium tuberculosis and other high G+C Gram-positive bacteria[J].Genome Biol,2001,2(10):RESEARCH0044.
[12] Stoop EJ,Bitter W,van der Sar AM.Tubercle bacilli rely on a typeⅦarmy for pathogenicity[J].Trends Microbiol,2012,20 (10):477-484.
[13] Singh V,Jamwal S,Jain R,Verma P,Gokhale R,Rao KV.Mycobacterium tuberculosis-driven targeted recalibration of macrophage lipid homeostasis promotes the foamy phenotype[J].Cell Host Microbe,2012,12(5):669-681.
[14] Simeone R,Bobard A,Lippmann J,Bitter W,Majlessi L,Brosch R,Enninga J.Phagosomal rupture by Mycobacterium tuberculosis results in toxicity and host cell death[J].PLoS Pathog,2012,8(2):e1002507.
[15] Houben D,Demangel C,van Ingen J,Perez J,Baldeón L,Abdallah AM,Caleechurn L,Bottai D,van Zon M,de Punder K,van der Laan T,Kant A,Bossers-de Vries R,Willemsen P,Bitter W,van Soolingen D,Brosch R,van der Wel N,Peters PJ.ESX-1-mediated translocation to the cytosol controls virulence of mycobacteria[J].Cell Microbiol,2012,14(8):1287-1298.
[16] Stanley SA,Johndrow JE,Manzanillo P,Cox JS.The typeⅠIFN response to infection with Mycobacterium tuberculosis requires ESX-1-mediated secretion and contributes to pathogenesis[J].J Immunol,2007,178(5):3143-3152.
[17] Wong KW,Jacobs WR Jr.Mycobacterium tuberculosis exploits human interferon γ to stimulate macrophage extracellular trap formation and necrosis[J].J Infect Dis,2013,208(1): 109-119.
[18] Burts ML,Williams WA,DeBord K,Missiakas DM.EsxA and EsxB are secreted by an ESAT-6-like system that is required for the pathogenesis of Staphylococcus aureus infections[J].Proc Natl Acad Sci USA,2005,102(4):1169-1174.
[19] Zhou HQ,Du H,Zhang HF,Shen HY,Yan RH,He Y,Wang M,Zhu X.EsxA might as a virulence factor induce antibodies in patients with Staphylococcus aureus infection[J].Braz J Microbiol,2013,44(1):267-271.
[20] Anderson M,Aly KA,Chen YH,Missiakas D.Secretion of atypical protein substrates by the ESAT-6 secretion system of Staphylococcus aureus[J].Mol Microbiol,2013,90(4): 734-743.
[21] Chen T,Xie JP.Roles of PE_PGRS family in Mycobacterium tuberculosis pathogenesis and novel measures against tuberculosis[J].Microb Pathog,2010,49(6):311-314.
[22] Nair S,Pandey AD,Mukhopadhyay S.The PPE18 protein of Mycobacterium tuberculosis inhibits NF-κB/rel-mediated proinflammatory cytokine production by upregulating and phosphorylating suppressor of cytokine signaling 3 protein[J].J Immunol,2011,186(9):5413-5424.
[23] Bhat KH,Chaitanya CK,Parveen N,Varman R,Ghosh S,Mukhopadhyay S.Proline-proline-glutamic acid(PPE)protein Rv1168c of Mycobacterium tuberculosis augments transcription from HIV-1 long terminal repeat promoter[J].J Biol Chem,2012,287(20):16930-16946.
[24] Nair S,Ramaswamy PA,Ghosh S,Joshi DC,Pathak N,Siddiqui I,Sharma P,Hasnain SE,Mande SC,MukhopadhyayS.The PPE18 of Mycobacterium tuberculosis interacts with TLR2 and activates IL-10 induction in macrophage[J].J Immunol,2009,183(10):6269-6281.
[25] Abdallah AM,Verboom T,Weerdenburg EM,Gey van Pittius NC,Mahasha PW,Jiménez C,Parra M,Cadieux N,Brennan MJ,Appelmelk BJ,Bitter W.PPE and PE_PGRS proteins of Mycobacterium marinum are transported via the typeⅦ secretion system ESX-5[J].Mol Microbiol,2009,73(3):329-340.
[26] Bhat KH,Das A,Srikantam A,Mukhopadhyay S.PPE2 protein of Mycobacterium tuberculosis may inhibit nitric oxide in activated macrophages[J].Ann NY Acad Sci,2013,1283:97-101.
[27] Flint JL,Kowalski JC,Karnati PK,Derbyshire KM.The RD1 virulence locus of Mycobacterium tuberculosis regulates DNA transfer in Mycobacterium smegmatis[J].Proc Natl Acad Sci USA,2004,101(34):12598-12603.
[28] Coros A,Callahan B,Battaglioli E,Derbyshire KM.The specialized secretoryapparatus ESX-1 is essential for DNA transfer in Mycobacterium smegmatis[J].Mol Microbiol,2008,69(4):794-808.
[29] Maciag A,Dainese E,Rodriguez GM,Milano A,Provvedi R,Pasca MR,Smith I,Palù G,Riccardi G,Manganelli R.Global analysis of the Mycobacterium tuberculosis Zur(FurB)regulon[J].J Bacteriol,2007,189(3):730-740.
[30] Maciag A,Piazza A,Riccardi G,Milano A.Transcriptional analysis of ESAT-6 cluster 3 in Mycobacterium smegmatis[J].BMC Microbiol,2009,9:48.
[31] Serafini A,Boldrin F,Palù G,Manganelli R.Characterization of a Mycobacterium tuberculosis ESX-3 conditional mutant: essentiality and rescue by iron and zinc[J].J Bacteriol,2009,191(20):6340-6344.
[32] Loots DT,Meissner-Roloff RJ,Newton-Foot M,Gey van Pittius NC.A metabolomics approach exploring the function of the ESX-3 typeⅦ secretion system of M.smegmatis[J].Metabolomics,2013,9(3):631-641.
[33] Way SS,Wilson CB.The Mycobacterium tuberculosis ESAT-6 homologue in Listeria monocytogenes is dispensable for growth in vitro and in vivo[J].Infect Immun,2005,73(9):6151-6153.
[34] 孙林,霍如松,焦新安.结核分枝杆菌Ⅶ型分泌系统的研究进展[J].中国人兽共患病学报,2010,26(8):772-775.
[35] Fortune SM,Jaeger A,Sarracino DA,Chase MR,Sassetti CM,Sherman DR,Bloom BR,Rubin EJ.Mutually dependent secretion of proteins required for mycobacterial virulence[J].Proc Natl Acad Sci USA,2005,102(30):10676-10681.
[36] Chen JM,Zhang M,Rybniker J,Basterra L,Dhar N,Tischler AD,Pojer F,Cole ST.Phenotypic profiling of Mycobacterium tuberculosis EspA point mutants reveals that blockage of ESAT-6 and CFP-10 secretion in vitro does not always correlate with attenuation of virulence[J].J Bacteriol,2013,195(24): 5421-5430.
[37] He H,Hovey R,Kane J,Singh V,Zahrt TC.MprAB is a stress-responsive two-component system that directly regulates expression of sigma factors SigB and SigE in Mycobacterium tuberculosis[J].J Bacteriol,2006,188(6):2134-2143.
[38] Pang XH,Vu P,Byrd TF,Ghanny S,Soteropoulos P,Mukamolova GV,Wu S,Samten B,Howard ST.Evidence for complex interactions of stress-associated regulons in an mprAB deletion mutant of Mycobacterium tuberculosis [J].Microbiology,2007,153(Pt4):1229-1242.
[39] Raghavan S,Manzanillo P,Chan K,Dovey C,Cox JS.Secreted transcription factor controls Mycobacterium tuberculosis virulence[J].Nature,2008,454(7205):717-721.
[40] Pang X,Samten B,Cao GX,Wang X,Tvinnereim AR,Chen XL,Howard ST.MprAB regulatestheespA operon in Mycobacterium tuberculosis and modulates ESX-1 function and host cytokine response[J].J Bacteriol,2013,195(1):66-75.
[41] Walters SB,Dubnau E,Kolesnikova I,Laval F,Daffe M,Smith I.The Mycobacterium tuberculosis PhoPR two-component system regulates genes essential for virulence and complex lipid biosynthesis[J].Mol Microbiol,2006,60(2):312-330.
[42] Rickman L,Scott C,Hunt DM,Hutchinson T,Menéndez MC,Whalan R,Hinds J,Colston MJ,Green J,Buxton RS.A member of the cAMP receptor protein family of transcription regulators in Mycobacterium tuberculosis is required for virulence in mice and controls transcription of the rpfA gene coding for a resuscitation promoting factor[J].Mol Microbiol,2005,56 (5):1274-1286.
[43] Gordon BR,Li Y,Wang L,Sintsova A,van Bakel H,Tian S,Navarre WW,Xia B,Liu J.Lsr2 is a nucleoid-associated protein that targets AT-rich sequences and virulence genes in Mycobacterium tuberculosis[J].Proc Natl Acad Sci USA,2010,107(11):5154-5159.
[44] Schulthess B,Bloes DA,Berger-Bächi B.Opposing roles of Sigma B and Sigma B-controlled SpoVG in the global regulation of esxA in Staphylococcus aureus[J].BMC Microbiol,2012,12:17.
Bacterial typeⅦ secretion system
YU Jun-Yuan,JIANG Bei,ZHANG Xiao-Peng,LI Shu,HU Xiao-Mei
Department of Microbiology,The Third Military Medical University,Chongqing 400038,China
Bacterial secretion systems are responsible for the secretion of bacterial produced moleculars or DNA,and closely related to the growth and pathogenicity of bacteria.So far,seven types of secretion systems have been identified.TypesⅠ-Ⅵ exist in Gram-negatives and typesⅣ andⅦ exist in Gram-positives.TypeⅦ secretion system(T7SS)is identified recently.It is involved in the secretion of virulence-associated proteins,the interaction between pathogens and hosts,and the balance of zinc/iron ions,and is implicated in growth and pathogenesis of Gram-positive bacteria.The classification,regulation and biological functions of T7SS are reviewed in the present paper.
Type Ⅶ secretion system; Mycobacterium tuberculosis; Staphylococcus aureus; Protein secretion;Virulence
.HU Xiao-Mei;E-mail:hxmay2008@163.com
2014-06-16)
重庆市自然科学基金(cstc2011jjA10050、CSTC 2011BB5026)
胡晓梅
