马纳维诺与西夫韦肽体外联合抗人类免疫缺陷病毒感染的效果评价
2015-05-25贲银银朱景玙徐建青张晓燕
贲银银,朱景玙,徐建青,张晓燕
上海市公共卫生临床中心,上海 201508
马纳维诺与西夫韦肽体外联合抗人类免疫缺陷病毒感染的效果评价
贲银银*,朱景玙*,徐建青,张晓燕
上海市公共卫生临床中心,上海 201508
本文旨在探讨人类免疫缺陷病毒1型(HIV-1)CC趋化因子受体5(CCR5)辅助受体拮抗剂马纳维诺(MRV)与膜融合抑制剂西夫韦肽(SFT)在抗HIV感染中的协同作用。利用TZM-bl细胞系检测SFT和MRV单用或联用对3种CCR5噬性(SVPB16、SVPC12和CRF01_AE)HIV假病毒的半数有效浓度(EC50)。采用CalcuSyn软件对2种药物的协同性进行预测,联合指数(CI)<1为有协同作用,CI=1为有相加效应,CI>1为有拮抗作用。同时,应用噻唑蓝(MTT)法对MRV和SFT的细胞毒性进行评价。结果显示,2种药物单用时对SVPB16、SVPC12和CRF01_AE的EC50:SFT为0.91、0.17、0.71 nmol/L,MRV为4.84、0.47、0.45 nmol/L。针对这3种假病毒,联用比单用EC50均有所降低,SFT(0.45、0.09、0.15 nmol/L)降低1~4倍,MRV (1.52、0.12、0.11 nmol/L)降低2~3倍。2种药物联用对3种假病毒抑制率达90%时的CI值分别为0.28、0.59和0.36。等效线法显示两者之间存在良好的协同作用。综上所述,联用MRV与SFT在不产生细胞毒性的情况下具有良好的协同抗HIV效果。
人类免疫缺陷病毒;药物协同作用;半数有效浓度;马纳维诺;西夫韦肽
高效抗反转录病毒治疗 (highly active antiretroviral therapy,HAART)显著改善了人类免疫缺陷病毒(human immunodeficiency virus,HIV)/艾滋病(acquired immunodeficiency syndrome,AIDS)患者的生存状态。其主要原因是联用靶向病毒复制周期不同阶段的抗病毒药物可协同发挥更高的抗病毒效果;同时,减少了单品种药物的使用剂量而降低了毒副作用与易发耐药的问题。目前,研发不同作用机制的抗病毒药物联用组合,已成为抗病毒药物研究领域的发展趋势。马纳维诺(maraviroc,MRV)是CC趋化因子受体5〔chemokine(C-C motif)receptor 5,CCR5〕的拮抗剂,可阻止HIV利用CCR5作为辅助受体进入CD4+T细胞,是目前唯一批准进入临床试验的CCR5辅助受体拮抗剂,在动物实验及临床试验中均显示出良好的抗病毒效果[1-3]。美国国立卫生研究院在全球组织协调了多中心临床试验,对MRV与反转录酶抑制剂如dapivirine(TMC120)、恩曲他滨(emtricitabine)及替诺福韦(tenofovir,TFV)的联合抗病毒效果进行了评价[4]。西夫韦肽(sifuvirtide,SFT)为针对HIV包膜蛋白gp41的新一代膜融合抑制剂,在体外实验中显示出良好的安全性、稳定性及生物学活性[5],且临床试验Ⅱb期结果显示,SFT结合HAART 24周后,可将59%的HIV感染者体内病毒载量降至检测线以下,并有效提升89%患者的CD4细胞数[6]。本研究对MRV与SFT在抗HIV感染中的协同作用效果进行了评估。
1 材料与方法
1.1 材料
MRV购自上海百谊生物科技有限公司,SFT购自天津扶素生物技术有限公司。子宫颈癌细胞系TZM-bl细胞为前期实验室培养。
1.2 试剂与仪器
DMEM高糖培养基、新生牛血清购自美国Thermo公司,噻唑蓝(methylthiazolyl tetrazolium,MTT)细胞毒性检测试剂盒购自美国Sigma公司,荧光素酶底物购自美国Promega公司。Synergy 2多功能酶标仪购自美国BioTek公司,Victor 3多功能酶标仪购自德国PerkinElmer公司,CO2细胞培养箱购自美国Thermo公司。
1.3 方法
1.3.1 细胞存活率计算采用高于实验中2种药物使用的最高浓度来进行细胞毒性评价。单用SFT和MRV的浓度分别为40 nmol/L和50 nmol/L,联用浓度为20 nmol/L(SFT)和50 nmol/L(MRV)。将对应浓度的药物加入96孔板中,每孔加入1×104个TZM-bl细胞,37℃、5%CO2培养箱中孵育48 h;每孔加入20 μl 10%MTT液,37℃、5%CO2培养箱中孵育3~4 h;吸去上清液,每孔加入200 μl二甲基亚砜(dimethyl sulfoxide,DMSO),振荡10 min后在490 nm 处读取光密度(optical density,OD),存活率 =(OD实验组-OD本底)/(OD阳性对照-OD本底)×100%,数据以mean±SD表示。
1.3.2 体外单用SFT和MRV抑制HIV感染采用3种HIV包膜假病毒SVPB16、SVPC12及CRF01 _AE进行体外抗病毒实验。在实验孔中分别加入SFT和MRV,将SFT和MRV进行3倍倍比稀释,SFT初始浓度为33.7 nmol/L,MRV初始浓度为41.7 nmol/L(SVPC12和CRF01_AE)和125 nmol/ L(SVPB16),共8个稀释度。将TZM-bl细胞按1 ×104个/孔加入96孔板中,每孔分别按100倍半数组织培养感染量(50%tissue culture infective dose,TCID50)加入3种不同假病毒。同时设只有细胞的空白对照孔及加入细胞和假病毒的阳性对照孔。每组设3个重复。37℃、5%CO2培养箱中孵育48 h;吸去上清液,每孔加入30 μl裂解液,振荡器振荡10 min;加入50 μl荧光素酶底物,置化学发光检测仪中,用BrighGlo程序读取发光值。抑制病毒感染率=(阳性对照荧光值-实验孔荧光值)/(阳性对照荧光值 -空白对照荧光值)×100%。最后用CalcuSyn软件计算每种化合物的半数有效浓度(50%effective concentration,EC50)。
1.3.3 体外联用SFT与MRV抑制HIV感染抑制HIV假病毒SVPB16的SFT与MRV联用浓度比为3∶1,SFT起始浓度为12 nmol/L;抑制SVPC12的浓度比为5∶7,SFT起始浓度为5 nmol/L;抑制CRF01_AE的浓度比为7∶5,SFT起始浓度为14 nmol/L。将2种药物按对应浓度混合后进行3倍倍比稀释,一共8个稀释度。每孔加入100 TCID50的假病毒及1×104个TZM-bl细胞,37℃、5%CO2培养箱中孵育48 h;吸去上清液,每孔加入30 μl裂解液,振荡器振荡10 min;加入50 μl荧光素酶底物,置化学发光检测仪中,用BrighGlo程序读取发光值。
1.3.4 协同效果的分析联用SFT与MRV的协同效应可根据等效线法判断。该方法以剂量为导向,等效线法的坐标轴表示每种药物的剂量,X轴和Y轴所选剂量与每种药物所能产生的抑制率(Fa值)相对应。直线(图中斜边)连接X轴与Y轴上能产生相同Fa值的相应剂量,如果联合用药的点落在直线上,那么这一Fa处效应为相加;如果落在斜边左下方,这一Fa处效应为协同;如果落在右上方,那么这一Fa处效应为拮抗。
2 结果
2.1 细胞毒性评价
如图1所示,SFT和MRV不管是单用还是联用,均能保证TZM-bl的存活率在95%以上。单用40 nmol/L SFT时细胞存活率为(96.7±0.1)%,单用50 nmol/L MRV时细胞存活率为(96.8± 0.2)%,联用后细胞存活率为(96.4±0.1)%。
2.2 体外单用SFT和MRV抑制HIV感染的评价
如表1所示,当单用时,SFT和MRV的EC50分别为0.91[0.66,1.26]、4.84[3.65,6.41]nmol/L (SVPB16);0.18[0.09,0.33]、0.47[0.27,0.82]nmol/L(SVPC12);0.71[0.57,0.87]、0.45[0.24, 0.84]nmol/L(CRF01_AE)。

图1 SFT和MRV单用或联用后TZM-bl细胞的存活率Fig.1 The cytotoxicity of sifuvirtide and maraviroc,alone or combined,in TZM-bl cells
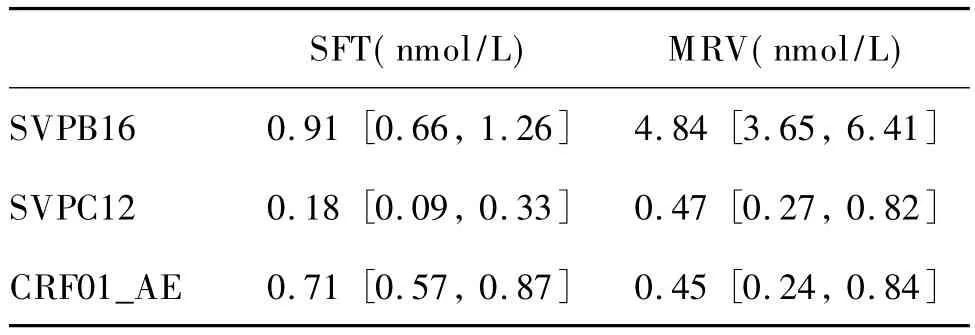
表1 SFT和MRV单用时的EC50Tab.1 The EC50of sifuvirtide and maraviroc using alone
2.3 体外联用SFT与MRV抑制HIV感染的评价
从剂量-效应曲线可看出,SFT与MRV联用可使有效剂量减少(图2)。感染SVPB16包膜假病毒时,与单用SFT比较,联用后EC50降低1倍(0.45 nmol/L vs.0.91 nmol/L),表明SFT与MRV联用强于SFT单用。相对应,联用后MRV的EC50降低2倍 (1.52nmol/L vs.4.84nmol/L)。对于SVPC12包膜假病毒,SFT和MRV的EC50分别降低1倍和3倍;而对于CRF01_AE假病毒,则分别降低4倍和3倍(表2)。

表2 SFT和MRV单用或联用时的EC50Tab.2 The EC50ofsifuvirtide maraviroc, alone or combined
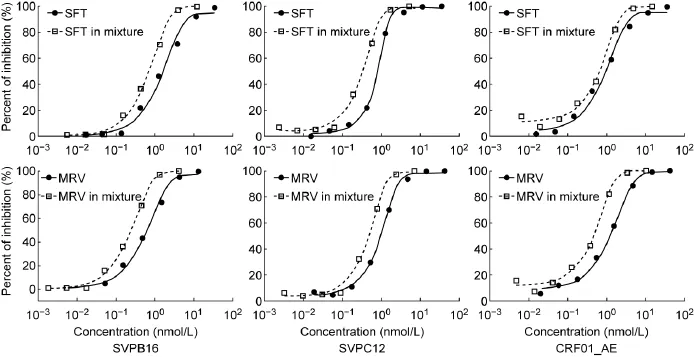
图2 SFT和MRV单用或联用抑制假病毒感染的效果Fig.2 The antiviral activity of sifuvirtide and maraviroc,alone or combined
2.4 体外联用SFT与MRV的协同分析
采用Fa-联合指数(combined index,CI)曲线法和等效线法判断SFT与MRV联用的协同效果。如表3所示,在联用SFT与MRV后抑制率达50%、75%及90%时,计算CI值,3种假病毒的CI值均<1。在等效线法中同样可观察到,在抑制率达50%、75%及90%时,联合用药的点全部落在直线的下方。2种方法均证明,对 SVPB16、SVPC12及CRF01_AE这3种假病毒,SFT与MRV联用具有很好的协同作用。

表3 不同抑制率下SFT和MRV的CI值Tab.3 The CI value of sifuvirtide and maraviroc at different inhibition ratio
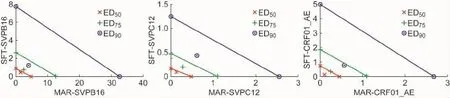
图3 等效线法对SFT与MRV联用结果的分析Fig.3 The synergistic effect of sifuvirtide and maraviroc
3 讨论
性途径传播已成为HIV-1传播的主要途径,杀微生物制剂在控制AIDS患者、HIV感染者经性传播中越来越受重视[7-9]。目前,一些抗反转录病毒药物作为抗HIV药物已进入临床试验,但由于药物毒性、耐药性及高昂费用等原因,单用这些药物受到一定限制[10-13]。相关研究表明,当联用2种或多种抗HIV药物时,可达到更好抑制HIV-1传播的目的[14,15]。联用比单用不但达到更好的保护效果,而且每种药物的使用浓度明显降低,表明药物之间具有较好的协同作用[16]。MRV与反转录酶抑制剂(如替诺福韦)联用就显示出了较好的协同作用[4]。MRV与SFT作为趋化因子拮抗剂和膜融合抑制剂,临床使用效果很好,但两者联用能否在药物用量及抑制效果方面有明显改善尚不明确,因此本课题组探索了联用MRV与SFT体外抗病毒感染的协同作用。结果显示,针对SVPB16、SVPC12和CRF01_ AE这3种HIV假病毒,当抑制率达50%时药物联用浓度均低于单用浓度,且表现出协同作用。其中对SVPB16假病毒的抑制率达50%时,联用浓度比单用浓度分别降低了2倍(MRV)和1倍(SFT)。药物使用浓度降低一方面降低成本,为后续推广提供方便;另一方面降低药物毒副作用,提高安全性。本研究中细胞毒性检测结果表明,MRV与SFT的应用不会对细胞生长造成明显影响,抑制病毒感染的结果为药物的实际抑制效果。综上所述,体外联用MRV与SFT具有较好的协同作用,能提高抗HIV效果,为以后药物联用提供了理论支持。
[1] Neff CP,Ndolo T,Tandon A,Habu Y,Akkina R.Oral preexposure prophylaxis by anti-retrovirals raltegravir and maraviroc protects against HIV-1 vaginal transmission in a humanized mouse model[J].PLoS One,2010,5(12):e15257.
[2] Massud I,Aung W,Martin A,Bachman S,Mitchell J,Aubert R,Solomon Tsegaye T,Kersh E,Pau CP,Heneine W,García-Lerma JG.Lack of prophylactic efficacy of oral maraviroc in macaques despite high drug concentrations in rectal tissues[J].J Virol,2013,87(16):8952-8961.
[3] Pirrone V,Thakkar N,Jacobson JM,Wigdahl B,Krebs FC.Combinatorial approaches to the prevention and treatment of HIV-1 infection[J].Antimicrob Agents Chemother,2011,55(5): 1831-1842.
[4] Microbicide Trails Netwrok.Ongoing,planned and completed trials of the microbicide trials network[EB/OL].http://www.mtnstopshiv.org/node/873.
[5] Li L,Ben Y,Yuan S,Jiang S,Xu J,Zhang X.Efficacy,stability,and biosafety ofsifuvirtide gel as a microbicide candidate against HIV-1[J].PLoS One,2012,7(5):e37381.
[6] Ghosh RK,Ghosh SM,Chawla S.Recent advances in antiretroviral drugs[J].Expert Opin Pharmacother,2011,12 (1):31-46.
[7] Nuttall J,Romano J,Douville K,Galbreath C,Nel A,Heyward W,Mitchnick M,Walker S,Rosenberg Z.The future of HIV prevention: prospects for an effective anti-HIV microbicide[J].Infect Dis Clin North Am,2007,21(1):219-239.
[8] Nutan,Gupta SK.Microbicides:a new hope for HIV prevention[J].Indian J Med Res,2011,134(6):939-949.
[9] Cutler B,Justman J.Vaginal microbicides and the prevention of HIV transmission[J].Lancet Infect Dis,2008,8(11): 685-697.
[10] Vanpouille C,Arakelyan A,Margolis L.Microbicides:still a long road to success[J].Trends Microbiol,2012,20(8):369-375.
[11] Doncel GF,Clark MR.Preclinical evaluation of anti-HIV microbicide products:New models and biomarkers[J].Antiviral Res,2010,88(Suppl 1):S10-S18.
[12] Jansson J,Wilson DP,Carr A,Petoumenos K,Boyd MA.Currently available medications in resource-rich settings may not be sufficient for lifelong treatment of HIV[J].AIDS,2013,27 (8):1245-1251.
[13] Chou TC,Talalay P.Quantitative analysis of dose-effect relationships:the combined effects of multiple drugs or enzyme inhibitors[J].Adv Enzyme Regul,1984,22:27-55.
[14] Velasco-Hernandez JX,Gershengorn HB,Blower SM.Could widespread use of combination antiretroviral therapy eradicate HIV epidemics[J]?Lancet Infect Dis,2002,2(8):487-493.
[15] Soriano V,Arastéh K,Migrone H,Lutz T,Opravil M,Andrade-Villanueva J,Antunes F,Di Perri G,Podzamczer D,Taylor S,Domingo P,Gellermann H,de Rossi L;ARTEN investigators. Nevirapine versus atazanavir/ritonavir, each combined with tenofovir disoproxil fumarate/emtricitabine,in antiretroviral-naive HIV-1 patients:the ARTEN Trial[J].Antivir Ther,2011,16(3):339-348.
[16] Vermeire K,Princen K,Hatse S,De Clercq E,Dey K,Bell TW,Schols D.CADA,a novel CD4-targeted HIV inhibitor,is synergistic with various anti-HIV drugs in vitro[J].AIDS,2004,18(16):2115-2125.
Evaluation of anti-human immunodeficiency virus activity of maraviroc combined with sifuvirtide in vitro
BEN Yin-Yin*,ZHU Jing-Yu*,XU Jian-Qing,ZHANG Xiao-Yan
Shanghai Public Health Clinical Center,Shanghai 201508,China
The present paper aims to explore the synergistic effect of maraviroc(MRV)[an inhibitor of human immunodeficiency virus type 1(HIV-1)co-receptor chemokine(C-C motif)receptor 5(CCR5)]and sifuvirtide (SFT)(HIV-1 entry inhibitor)on HIV infection.Three HIV-1 pseudovirus strains including SVPB16,SVPC12 and CRF01_AE subtypes were used to infect TZM-bl cells in vitro.The effects of MRV and SFT,alone or combined,on the HIV-1/TZM-bl infection system were investigated,and their 50% effective concentration (EC50)values were calculated.The synergistic effect of SFT and MRV was predicted by CalcuSyn software according to the combined index(CI)values.The CI values indicated a synergistic effect when <1,an antagonistic effect when>1,and an additive effect when equal to 1.The cytotoxic effects of MRV and SFT,alone or combined,were also evaluated by methylthiazolyl tetrazolium(MTT)method.When used alone,the EC50values of SFT were 0.91,0.17 and 0.71 nmol/L against SVPB16,SVPC12 and CRF01_AE pseudoviruses,respectively;and the EC50values of MRV were 4.84,0.47 and 0.45 nmol/L,respectively.When SFT and MRV were used in combination,the EC50values of them were reduced by two to four times for SFT(0.45,0.09 and 0.15 nmol/L),and two to three times for MRV(1.52,0.12 and 0.11 nmol/L).The results calculated by isobologram software indicated that there was a good synergistic effect between SFT and MRV.It is suggested that combination of SFT and MRV has a good synergistic effect on HIV-1 infection in vitro with no significant cell toxicity.
Human immunodeficiency virus; Synergistic effect; 50% effective concentration; Maraviroc;Sifuvirtide
.ZHANG Xiao-Yan,E-mail:zhangxy066@gmail.com*同为第一作者
2014-10-18)
“十二五”国家科技重大专项(2013ZX10001006)
张晓燕
