MiR-375增加肿瘤坏死因子对人口腔鳞癌细胞杀伤活性及机制研究
2015-05-24邱磊
邱磊
MiR-375增加肿瘤坏死因子对人口腔鳞癌细胞杀伤活性及机制研究
邱磊
目的 探讨microRNA-375(miR-375)对肿瘤坏死因子(TNF-α)杀伤人口腔鳞癌细胞生物效应的影响。方法 将人口腔鳞癌细胞Cal27用miR-375模拟物转染后用TNF-α治疗,采用MTT法检测治疗后Cal27细胞的增殖情况;通过流式细胞术检测Cal27细胞治疗后的凋亡情况;通过流式细胞术检测Cal27细胞内DNA的含量,测定凋亡特征性subG1期的细胞比值;定量PCR法检测治疗后Cal27细胞抗凋亡蛋白Bcl-2、Bcl-xl、cIAP2、cFLIPL的表达。结果 miR-375+TNF-α组对Cal27细胞增殖的抑制率为(37.8±5.2)%,凋亡率为(20.5±3.8)%,TNF-α组分别为(6.2±2.7)%、(1.0±0.3)%,两组比较,差异有统计学意义(P<0.05);miR-375+TNF-α组,Cal27细胞的cIAP2、cFLIPL表达较TNF-α组显著下降(2.15±0.16比6.87±0.42、1.54±0.10比3.98±0.25)(P<0.05),Bcl-2,Bcl-xl表达不变。结论 miR-375降低cIAP2、cFLIPL的表达,提高人口腔鳞癌Cal27细胞对TNF-α的敏感性,提高凋亡率。
人口腔鳞癌细胞Cal27;miR-375;TNF-α;细胞凋亡;cIAP2;cFLIPL
肿瘤坏死因子(TNF-α)是一种炎症细胞因子并且具有抗肿瘤的作用[1],大剂量TNF-α有较好的抗肿瘤疗效,但大剂量TNF-α毒副作用也大,患者往往无法耐受,所以提高肿瘤细胞对TNF-α的敏感性以降低TNF-α的剂量,将提高TNF-α的临床应用前景。Mir-375是microRNA家族中的一员,文献[2-3]报道,肿瘤细胞中转染MiR-375模拟物可以降低肿瘤细胞的增殖,目前尚无将MiR-375作为药物增敏剂的报道。为此,笔者应用TNF-α治疗用miR-375转染后的人口腔鳞癌细胞Cal27,观察miR-375能否提高口腔鳞癌细胞对TNF-α的敏感性,使低剂量的TNF-α呈现出显著杀伤肿瘤细胞的作用。现报道如下。
1 材料与方法
1.1 细胞来源 人口腔鳞癌Cal27细胞系购自于美国ATCC(产品号:CRL-2095),培养在DMEM培养基中,含10%胎牛血清,100U/L青霉素和100mg/mL链霉素,培养环境为37℃恒温且通入5%的CO2。
1.2 实验试剂 DMEM培养基购自于Gibco公司,胎牛血清(FBS)购于杭州四季青生物工程有限公司,TNF-α、二甲亚砜(DMSO)、噻唑蓝(MTT)、碘化丙啶(PI)购于Sigm-Aldrich,PI和AnnexinⅤ凋亡试剂盒购自美国ebioscience,miR-375模拟物购于广州锐博生物有限公司,转染试剂Lipofectamine2000、Trizol购自Invitrogen公司,实时荧光定量PCR逆转录试剂盒购于TOYOBO公司,SYBR Green购于TaKaRa。
1.3 MTT试验 将Cal27细胞按1×103/孔接种于96孔板,加入200μL含10%FBS的DMEM培养,设置3个复孔,按Lipofectamine2000操作说明书在培养体系中分别加入0nM、40nM、0nM、40nM的miR-375模拟物培养48h,然后再分别加入0ng/mL、0ng/mL、10ng/mL、10ng/mL的重组TNF-α培养24h,之后加5mg/mL MTT 20μL,继续培养4h。弃上清,往孔中加150μL DMSO,震荡使紫色絮状物完全溶解,570nm波长下用酶标仪检测OD值,细胞生长的抑制率以以下公式计算:抑制率=(OD对照组-OD实验组)/ OD对照组×100%。
1.4 细胞凋亡试验 按Lipofectamine2000操作说明书在Cal27细胞中分别加入 0nM、40nM、0nM、40nM的miR-375模拟物培养48h,然后再分别加入0ng/mL、0ng/mL、10ng/mL、10ng/mL的重组TNF-α培养24h,按照试剂说明书将PI和annexin-V加入细胞中孵育20min,采用流式细胞术检测肿瘤细胞的凋亡。细胞凋亡性死亡率用PI、annexin-V双阳性细胞占所有细胞比值表示。
1.5 细胞周期试验 按Lipofectamine 2000操作说明书在Cal27细胞中分别加入 0nM、40nM,0nM、40nM的miR-375模拟物培养48h,然后再分别加入0ng/mL、0ng/mL、10ng/mL、10ng/mL的重组TNF-α培养24h,之后收集细胞用PBS(磷酸盐缓冲液)洗2次,用70%乙醇在4℃固定过夜,之后用PBS清洗1次,加入(50μg/mL)RNA酶,100μg/mL PI在暗处染色30min,流式细胞术检测细胞周期,检测subG1期细胞所占比率。
1.6 定量PCR试验 按Lipofectamine2000操作说明书在Cal27细胞中分别加入0nM、40nM、0nM、40nM的miR-375模拟物培养48h,然后再分别加入0ng/mL、0ng/mL、10ng/mL、10ng/mL的重组TNF-α培养24h,之后各组细胞用Trizol试剂裂解,然后按逆转录试剂说明书制备cDNA,加SYBR Green按定量PCR的一般程序进行扩增。实验数据用2-ΔΔCt法分析[4],结果用实验组与对照组目标基因表达量的相对值来表示,引物设计见表1。
2 结果
2.1 miR-375联合TNF-α对Cal27细胞抑制作用用miR-375或10ng/mL的TNF-α单独治疗Cal27肿瘤细胞,对肿瘤细胞的抑制率分别为(4.1±2.1)%、(6.2±2.7)%。将Cal27细胞先用miR-375处理后再加TNF-α,肿瘤细胞抑制率提高至(37.8±5.2)%。与两个单独用药组比较,差异有统计学意义(P<0.01),见表2。
2.2 miR-375联合TNF-α对Cal27细胞凋亡的诱导作用 单用miR-375或10ng/mL TNF-α几乎不能诱导Cal27细胞进入凋亡性死亡,然而当miR-375合用TNF-α时,Cal27细胞发生了显著性的凋亡。当细胞进入凋亡时,细胞内通常DNA发生降解,细胞内DNA含量低于G1期,在细胞周期图上表现为subG1峰[5]。我们用流式细胞术PI染色法检测Cal27细胞的细胞周期,发现Cal27细胞单用miR-375或10ng/mL的TNF-α治疗时,subG1期细胞很少,然而当miR-375合用TNF-α治疗Cal27细胞时,subG1期细胞显著增加,见表2。

表1 RT-qPCR引物设计
表2 miR-375联合TNF-α对Cal 27细胞抑制作用和诱导凋亡作用(±s)
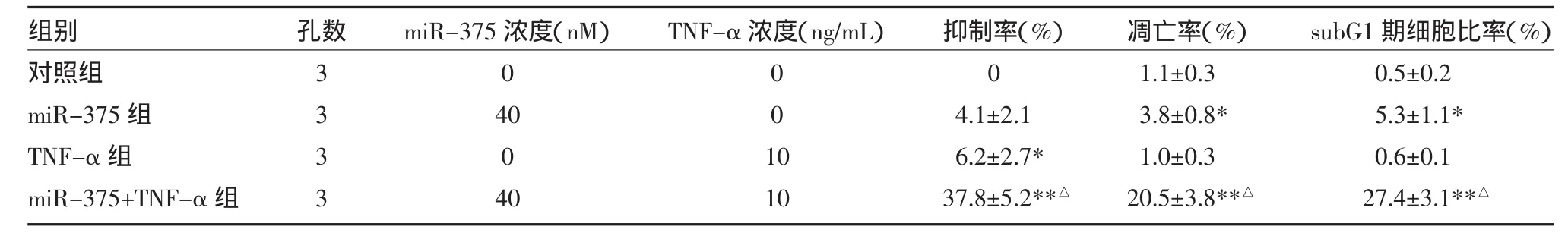
表2 miR-375联合TNF-α对Cal 27细胞抑制作用和诱导凋亡作用(±s)
注:与对照组比较,*P<0.05,**P<0.01;与miR-375组和TNF-α组比较,△P<0.01
组别对照组miR-375组TNF-α组miR-375+TNF-α组孔数3333 miR-375浓度(nM)0 40 0 40 TNF-α浓度(ng/mL)001 0 10抑制率(%)0 4.1±2.1 6.2±2.7* 37.8±5.2**△凋亡率(%)1.1±0.3 3.8±0.8* 1.0±0.3 20.5±3.8**△subG1期细胞比率(%)0.5±0.2 5.3±1.1* 0.6±0.1 27.4±3.1**△
表3 miR-375及TNF-α对Cal27细胞抗凋亡蛋白表达的影响(相对表达量,±s)

表3 miR-375及TNF-α对Cal27细胞抗凋亡蛋白表达的影响(相对表达量,±s)
注:与TNF-α组比较,*P<0.05
组别对照组miR-375组TNF-α组miR-375+TNF-α组孔数3333 miR-375浓度(nM)0 40 0 40 TNF-α浓度(ng/mL)001 0 10 Bcl-2 1.0±0.02 0.98±0.04 1.56±0.08 1.40±0.13 Bcl-xl 1.0±0.03 1.03±0.02 1.87±0.11 1.90±0.14 cIAP2 1.0±0.02 0.88±0.03 6.87±0.42 2.15±0.16* cFLIPL 1.0±0.04 0.72±0.03 3.98±0.25 1.54±0.10*
2.3 miR-375调控抗凋亡蛋白cIAP2和cFLIPL的表达 在细胞培养体系中单用TNF-α可诱导Cal27细胞Bcl-2、Bcl-xl、cIAP2和cFLIPL的表达,而与miR-375合用相比于单用TNF-α,细胞内cIAP2和cFLIPL的表达显著下降(P<0.05),但对Bcl-2和Bcl-xl的表达没有影响,见表3。
3 讨论
microRNA(miRNA)是细胞内自然存在的一种非蛋白编码的小RNA,长度约为19~25个碱基,它能与有互补序列的mRNA特异性结合并造成该mRNA的降解或抑制mRNA的翻译,从而调节细胞的蛋白表达[6],研究发现肿瘤细胞与正常细胞相比,miRNA的表达往往发生改变以促进肿瘤的生长和转移[7-8]。MicroRNA-375是细胞内源性的蛋白表达调节因子,最早研究发现葡萄糖通过信号途径下调miR-375的转录来诱导胰岛细胞分泌胰岛素并促进胰岛细胞的增殖[9]。后来研究则发现了miR-375在多种肿瘤模型特别是鳞状细胞癌中含量均显著下调,当在鳞状细胞癌中转染miR-375模拟物后,肿瘤的生长受到抑制,证实了肿瘤的发生与miR-375的减少有关[10-11]。这些研究表明miR-375具有抗肿瘤的作用,可能成为一种潜在的肿瘤治疗手段和肿瘤治疗预后的指标。TNF-α是一种十分强力的肿瘤抑制性细胞因子,能与细胞的死亡受体结合并打开线粒体膜通道释放细胞色素C等凋亡诱导物质,并造成肿瘤细胞死亡[12]。但是低剂量的TNF-α能激活核转录因子NF-κB,从而诱导细胞抗凋亡蛋白如Bcl-2、Bcl-xl、cIAP2和cFLIPL的表达,促进肿瘤细胞的增殖[13-15]。因此,我们必须加大TNF-α的用药剂量。然而临床上也发现大剂量的TNF-α对机体有较大毒性反应,因此找到一种化学增敏剂来提高TNF-α杀伤肿瘤细胞的能力并降低TNF-α的使用剂量减少毒副反应具有十分重要的意义。在本研究中我们发现miR-375能通过下调抗凋亡蛋白cIAP2和cFLIPL的表达来提高TNF-α对Cal27的杀伤活性,同时两者联合应用也大大提高TNF-α对Cal27的凋亡诱导效应。研究结果提示miR-375联合TNF-α可能在人口腔鳞癌辅助治疗中有广阔的应用前景。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics.2012[J].CA Cancer J Clin,2012,62(1):10-29.
[2]Song K,Zhu F,Shang ZJ,et al.Tumor necrosis factor-alpha enhanced fusions between oral squamous cell carcinoma cells and endothelial cells via VCAM-1/VLA-4 pathway[J].Exp Cell Res,2012,318(14):1707-1715.
[3]Xu Y,Jin J,Zhuo W,et al.Snail-Regulated MiR-375 Inhibits Migration and Invasion of Gastric Cancer Cells by Targeting JAK2[J].PLoS One,2014,9(7):e99516.
[4]Yoda S,Soejima K,Betsuyaku T,et al.Claudin-1 is a novel target of miR-375 in non-small-cell lung cancer[J].Lung Cancer,2014,85(3):366-372.
[5]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)Method[J].Methods,2001,25(4):402-408.
[6]Paul-Samojedny M,Suchanek R,Kowalski J,et al.Knockdown of AKT3(PKB γ)and PI3KCA Suppresses Cell Viability and Proliferation and Induces the Apoptosis of Glioblastoma Multiforme T98G Cells[J].Biomed Res Int,2014,2014:768181.
[7]Essandoh K,Fan GC.Role of Extracellular and Intracellular MicroRNAs in Sepsis[J].Biochim Biophys Act,2014,1842(11):2155-2162.
[8]Cho WC.Micro RNAs as therapeutic targets for lung cancer[J].Expert Opin Ther Targets,2012,14(10):1005-1008.
[9]Rossbach M.MicroRNAs in cancer therapy[J].Expert Opin Ther Targets,2012,16(8):743-755.
[1 0]Bolmeson C,Esguerra JL,Cilio CM,et al.Differences in isletenriched miRNAs in healthy and glucose intolerant human subjects[J].Biochem Biophys Res Commun,2011,404(1):16-22.
[1 1]Leidner R,Ravi L,Streppel M,et al.The microRNAs,MiR-31 and MiR-375,as candidate markers in Barrett’s esophageal carcinogenesis[J].Genes Chromosomes Cancer,2012,51(5):473-479.
[1 2]Wang F,Li Y,Xie X,et al.miR-375 is down-regulated in squamous cervical cancer and inhibits cell migration and invasion via targeting transcription factor SP1[J].Am J Pathol,2011,179(5):2580-2588.
[1 3]Lee CH,Jeon YT,Kim SH,et al.NFkappaB as a potential molecular target for cancer therapy[J].Biofactors,2007,29(1):19-35.
[1 4]Arkan MC,Greten FR.IKK-and NF-kappaB mediated functions in carcinogenesis[J].Curr Top Microbiol Immunol,2011,349:159-169.
[1 5]Wang H,Cho CH.Effect of NF-kappaB signaling on apoptosis in chronic inflammation-associated carcinogenesis[J].Curr Cancer Drug Targets,2010,10(6):593-599.
(收稿:2014-08-19 修回:2014-10-14)
MiR-375 Increases The Cytotoxicity of Tumor Necrosis Factor in Oral Squamous Cells and Its Mechanism
Qiu Lei.Ningbo Maternal and Child Health Hospital of Beilun,NingBo(315800),China
Objective To explore the effect of miR-375 on the proliferation of Cal27 cells treated with tumor necrosis factor α(TNF-α)and its mechanism.Methods Cal27 cells were transfected with miR-375 mimic and then treated with TNF-α.Cell proliferation was measured by using the MTT assay.Apoptosis of tumor cells and subG1 peak were determined by flow cytometry.The expression of anti-apoptosis proteins Bcl-2,Bcl-xl,cIAP2 and cFLIPL were evaluated by qPCR.Results MiR-375 mimic combined with TNF-α increased inhibition rate of Cal27 cell proliferation(37.8±5.2)and inhibition rate of Cal27 cell apoptosis(20.5±3.8)compared with TNF-α alone group(6.2±2.7,1.0±0.3),both with significant difference(P all<0.05).The expression of cIAP2 and cFLIPL in Cal27 cells treated with miR-375 mimic and TNF-α significantly decreased(2.15±0.16 vs 6.87±0.42;1.54±0.10 vs 3.98±0.25;P all<0.05),while the expression of Bcl-2,Bcl-xl remained unchanged.Conclusion MiR-375 may enhance the sensitivity of Cal27 cells toward TNF-α via decreasing the expression of cIAP2 and cFLIPL.
human oral squamous carcinoma cell;Cal27;miR-375;TNF-α;apoptosis;cIAP2;cFLIPL
浙江省宁波市北仑区妇幼保健院检验科(宁波 315800)
