不同剂量右美托咪定对妇科腹腔镜手术患者全麻苏醒期躁动和寒战的影响
2015-05-23宋娟李青方向志葛亚丽
宋娟,李青,方向志,葛亚丽
(1江苏省中西医结合医院、江苏省中医药研究院,南京210028;2江苏省苏北人民医院)
近年来国内外资料显示,右美托咪定不仅具有镇静作用,而且具有较好的抗寒战以及预防苏醒期躁动作用[1~3];但对于不同剂量右美托咪定预防全麻患者苏醒期躁动和寒战的效果以及是否会延长苏醒时间的研究较少。为此,本研究对不同剂量右美托咪定对妇科腹腔镜手术患者全麻苏醒期躁动和寒战的预防作用进行了探讨。
1 资料与方法
1.1 临床资料 选取2013年2月~2014年6月江苏省中西医结合医院择期全麻腹腔镜下行子宫肌瘤切除术患者120例,年龄20~60岁,体质量40~70 kg,ASA分级I~Ⅱ级。采用随机数字表法均分为四组:等容生理盐水组(S组)、右美托咪定0.5 μg/kg组(D0.5组)、右美托咪定0.75 μg/kg组(D0.75组)、右美托咪定1.0 μg/kg组(D1.0组)。120例均排除以下患者:①术前有明显焦虑紧张、有语言沟通障碍者;②有消化道溃疡病史、肾脏病史、代谢性疾病史、慢性疼痛史、精神类疾病史者;③长期使用镇痛药物及非类固醇消炎药过敏史者;④Ⅱ~Ⅲ度房室传导阻滞、窦性心动过速或过缓者。本研究经医院伦理委员会审查批准,患者签署知情同意书。
1.2 方法
1.2.1 麻醉方法 患者术前禁食8 h、禁饮4 h,术前0.5 h肌注阿托品0.5 mg和苯巴比妥钠0.1 g。入室后进行常规监测,开放静脉通道。麻醉诱导前30 min,S组泵注生理盐水,D0.5组泵注右美托咪定 0.5 μg/kg,D0.75 组泵注右美托咪定 0.75 μg/kg,D1.0组泵注右美托咪定1.0 μg/kg,泵注时间均大于10 min。快速静脉诱导,依次静注咪唑安定0.04 mg/kg、舒芬太尼 0.4 μg/kg、丙泊酚 2 mg/kg、罗库溴铵1 mg/kg;快速气管插管后机械控制通气。麻醉维持:吸入七氟醚0.7~1.0 MAC,持续静脉泵注瑞芬太尼0.1~0.2 μg/(kg·min)、丙泊酚3~6 mg/(kg·h),间断静注顺—阿曲库铵。术中持续监测 BP、ECG、SpO2、PETCO2和七氟醚呼气末浓度,维持BP在基础值±20%以内,PETCO235~45 mmHg。手术室的室温统一设定为21~22℃,手术期间不使用暖风机、变温毯或加温输液器。当MAP低于基础值的1/3或SBP低于90 mmHg时,经静脉注射麻黄素6 mg;若HR低于50次/min,则静脉给予阿托品0.5 mg。术毕前5 min停用七氟醚,氧流量保持在2 L/min。术毕停止输注丙泊酚和瑞芬太尼,接静脉镇痛泵。
1.2.2 观察指标 术毕送入麻醉恢复室,记录苏醒时间(停止麻醉用药到呼之睁眼的时间)、清醒拔管时间(停止麻醉用药到拔除气管插管时间)和麻醉后监测治疗室(PACU)停留时间。记录患者苏醒期的 Wrench 寒战分级[4]、躁动行为分级[5]和 Ramesay镇静评分[6]。观察患者恶心、呕吐、头晕等不良反应情况,随访至术后24 h。当寒战评级大于0级时,给患者面罩吸氧、暖风机并静脉给予布托菲诺0.5~1 mg。当躁动分级为1~3级并且尚未达到拔管标准则静脉给予丙泊酚30~50 mg。拔管后患者寒战评级1级以下,躁动分级0级,镇静评分≤2分时方可离开PACU。
1.2.3 统计学方法 采用SPSS19.0统计软件,计量资料以±s表示,组间比较采用单因素方差分析;等级资料(ASA分级、Wrench寒战分级、躁动分级)采用秩和检验。P≤0.05为差异有统计学意义。
2 结果
2.1 四组手术及麻醉情况 四组手术时间(切皮至手术结束)、麻醉时间(麻醉诱导开始到手术结束)、麻醉药用量及输液情况差异均无统计学意义(P均>0.05)。见表1。
表1 四组手术及麻醉情况比较(n=30,±s)
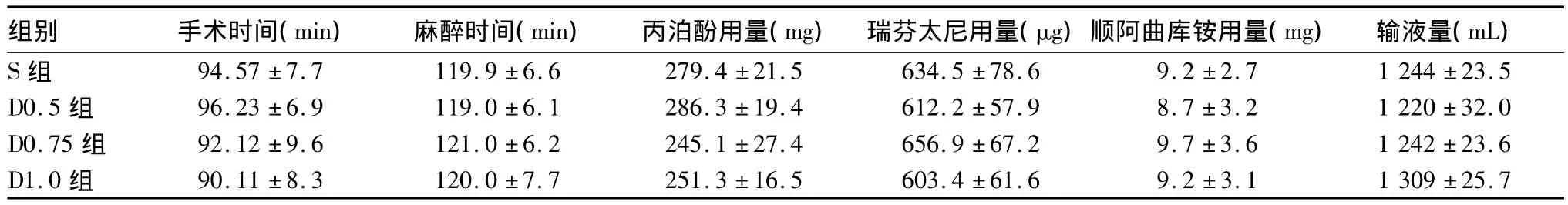
表1 四组手术及麻醉情况比较(n=30,±s)
注:组间各项指标比较,P均>0.05。
组别 手术时间(min) 麻醉时间(min) 丙泊酚用量(mg) 瑞芬太尼用量(μg)顺阿曲库铵用量(mg) 输液量(mL)S组 94.57±7.7 119.9±6.6 279.4±21.5 634.5±78.6 9.2±2.7 1 244±23.5 D0.5组 96.23±6.9 119.0±6.1 286.3±19.4 612.2±57.9 8.7±3.2 1 220±32.0 D0.75组 92.12±9.6 121.0±6.2 245.1±27.4 656.9±67.2 9.7±3.6 1 242±23.6 D1.0组 90.11±8.3 120.0±7.7 251.3±16.5 603.4±61.6 9.2±3.1 1 309±25.7
2.2 四组术后苏醒时间、拔管时间及PACU停留时间 见表2。
表2 四组术后苏醒时间、拔管时间及PACU停留时间比较(n=30,min,±s)

表2 四组术后苏醒时间、拔管时间及PACU停留时间比较(n=30,min,±s)
注:与 S组比较,*P<0.05;与 D1.0组比较,△P<0.05;与D0.5组比较,▲P <0.05。
组别 苏醒时间 拔管时间 PACU 停留时间S组18.3±1.5 21.8 ±1.8 30.0±1.8 D0.5组 19.6±1.2*△ 21.0±1.0△ 30.0±1.2△D0.75组 20.1±1.5*△ 21.0±1.2△ 27.0±1.3*△▲D1.0组 23.0±1.5* 26.0±1.4* 32.0±1.6*
2.3 四组躁动、Wrench分级及Ramesay镇静评分躁动、Wrench寒战分级见表3。S组、D0.5组、D0.75组、D1.0组 Ramesay评分分别为(2.61±0.31)、(2.79 ±0.23)、(2.65 ±0.33)、(3.46 ±0.29),D1.0组Ramesay镇静评分明显大于S组(P<0.05)。
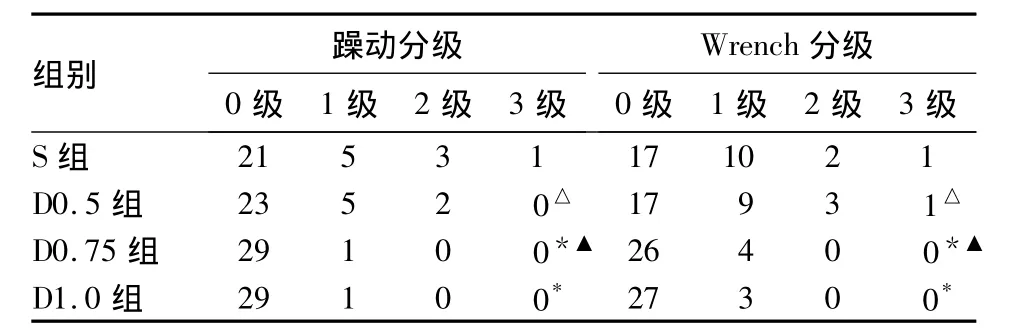
表3 四组苏醒期躁动分级及Wrench分级(n=30,例)
2.4 四组不良反应发生率 术后四组均未发生心律失常、呼吸抑制等并发症。术后恶心呕吐发生分别为S组3例、D0.5组2例、D0.75组2例、D1.0组3例。四组不良反应发生率比较差异无统计学意义(P >0.05)。
3 讨论
术后寒战和躁动不仅可引起患者不适,同时可能给患者带来严重危害。寒战可以增加氧耗,使CO2产生增多,儿茶酚胺大量释放,增加眼内压、颅内压升高和心脏不良事件的风险,其发生机制主要与低体温相关。非低体温型寒战,患者体温正常,外周血管扩张[7],发生机制尚不清楚,可能与疼痛相关[8]。躁动可能导致患者切口裂开、出血和心律失常等意外。低氧血症、麻醉药未代谢完全以及各种不良刺激等多种因素都可引起术后躁动。目前研究表明,疼痛刺激可能是全麻患者苏醒期躁动的最主要相关因素[6]。
右美托咪定作为一种高选择性α2受体激动剂,其对 α2、α1受体选择比率为1 620∶1[9],其与脑干蓝斑核(负责调解觉醒与睡眠)的α2受体结合可产生镇静、催眠、抗焦虑作用;与脊髓后角α2受体结合,可抑制疼痛信号向脑的传导或抑制感觉神经递质的释放而产生镇痛效应[10]。Bicer等[11]研究认为,静脉预防性给予1.0 μg/kg右美托咪啶可以降低术后寒战的发生率,其效果与0.5 μg/kg曲马多相同。Blaine等[12]研究同样表明,静脉给予 0.5 μg/kg 右美托咪定可以有效治疗儿童术后寒战。徐凯等[10]研究表明,在神经外科手术结束前静注右美托咪定0.5 μg/kg可有效减少全麻苏醒期躁动的发生。但不同剂量右美托咪定对寒战与躁动有何影响目前尚无定论。因此本研究对比不同剂量右美托咪定预防妇科腹腔镜手术患者全麻苏醒期躁动与寒战的作用。
本研究发现,妇科腹腔镜手术患者手术结束前预注0.75、1.0 μg/kg右美托咪定均可以很好地预防苏醒期躁动及寒战的发生。但是,1.0 μg/kg右美托咪定预防用药显著延长了患者PACU恢复时间,影响恢复质量。本研究中D0.75组与D1.0组躁动分级、Wrench寒战分级明显低于S组,表明右美托咪定可以有效预防妇科腹腔镜手术患者全麻苏醒期的躁动和寒战。这与孙艺娟等[13]研究结果一致。右美托咪定可以降低寒战阈值,可能是其降低寒战发生的主要机制之一[14]。右美托咪定具有镇静、抗焦虑及良好的镇痛效果,显著降低术后疼痛等不良刺激,可能是其寒战及躁动发生率较低的另一原因。与Kim等[2]研究结果一致,0.5 μg/kg小剂量右美托咪定没有降低全麻苏醒期躁动及寒战的发生,可能与小剂量右美托咪定镇痛效果较弱有关。
研究显示,右美托咪定可以产生剂量依赖性的镇静作用[15]。本研究结果显示,尽管四组全麻药用量和肌松药用量无统计学差异,D1.0组苏醒时间、拔管时间及PACU停留时间明显长于其他各组,Ramesay镇静评分较高,表明高剂量右美托咪啶可产生过度镇静,不利于患者术后苏醒期恢复。尽管D0.75组苏醒时间长于S组,但其PACU停留时间短于S组。与右美托咪定D1.0组和D0.75组比较,S组和D0.5组入PACU后处于寒战和躁动状态较多,难以安静,常需给予布托菲诺和丙泊酚来抑制寒战和躁动,导致拔管时间及PACU停留时间较长。因此,妇科腹腔镜手术患者麻醉诱导前泵注0.75 μg/kg右美托咪定可以有效预防苏醒期躁动及寒战的发生,缩短患者PACU停留时间。
[1]Johnston KD,Rai MR.Conscious sedation for awake fibreoptic intubation:a review of the literature[J].Can J Anaesth,2013,60(6):584-599.
[2]Kim YS,Kim YI,Seo KH,et al.Optimal dose of prophylactic dexmedetomidine for preventing postoperative shivering[J].Int J Med Sci,2013,10(10):1327.
[3]Patel A,Davidson M,Tran M,et al.Dexmedetomidine infusion for analgesia and prevention of emergence agitation in children with obstructive sleep apnea syndrome undergoing tonsillectomy and adenoidectomy[J].Anesth Analg,2010,111(4):1004-1010.
[4]刘才华,袁莉莉,王世英,等.布托啡诺治疗经皮肾镜取石术中寒战效果观察[J].山东医药,2011,51(39):55-56.
[5]Boyer J.Treating agitation with dexmedetomidine in the ICU[J].Dimens Crit Care Nurs,2009,28(3):102-109.
[6]康茵,赵国栋,李真,等.帕瑞昔布钠预防妇科腹腔镜患者全麻苏醒期躁动和寒战的临床观察[J].临床麻醉学杂志,2010(7):566-568.
[7]牟传琳,万效梅.不同剂量丙帕他莫对胃癌根治术老年患者麻醉恢复期躁动与寒战的影响[J].山东医药,2013,53(40):55-57.
[8]Horn EP,Schroeder F,Wilhelm S,et al.Postoperative pain facilitates nonthermoregulatory tremor[J].Anesthesiology,1999,91(4):979.
[9]Grant SA,Breslin DS,MacLeod DB,et al.Dexmedetomidine infusion for sedation during fiberoptic intubation:a report of three cases[J].J Clin Anesth,2004,16(2):124-126.
[10]徐凯,郑文泽,胡毅平.右美托咪定预防神经外科手术全麻苏醒期躁动的临床观察[J].重庆医学,2014,43(1):120-121.
[11]Bicer C,Esmaoglu A,Akin A,et al.Dexmedetomidine and meperidine prevent postanaesthetic shivering[J].Eur J Anaesthesiol,2006,23(02):149-153.
[12]Blaine Easley R,Brady KM,Tobias JD.Dexmedetomidine for the treatment of postanesthesia shivering in children[J].Paediatr Anaesth,2007,17(4):341-346.
[13]孙艺娟,罗辉,黄希照,等.不同剂量右美托咪定预防妇科腹腔镜手术患者全麻后寒战的临床观察[J].实用医学杂志,2014,30(12):1976-1978.
[14]刘剑锋,马凤亚,蒋平.右美托咪啶对宫外孕腹腔镜术后寒战的影响[J]. 江苏大学学报 (医学版),2013,23(05):428-431.
[15]Bekker A,Sturaitis M,Bloom M,et al.The effect of dexmedetomidine on perioperative hemodynamics in patients undergoing craniotomy[J].Anesth Analg,2008,107(4):1340-1347.
