全身放射线照射对B16F10黑色素瘤小鼠的影响
2015-05-23王冰屈朋欢王艳华崔乃鹏蔡建辉陈保平
王冰,屈朋欢,王艳华,崔乃鹏,蔡建辉,陈保平
(1河北大学附属医院,河北保定071000;2河北大学医学部;3华北油田华苑医院;4河北省人民医院)
肿瘤的发生、发展过程与机体的免疫调节功能密切相关,采用过继性细胞回输为主要方法的免疫治疗是目前公认的肿瘤治疗新成就。由于肿瘤微环境中复杂多变的免疫抑制网络限制了免疫治疗的实际效果[1],目前临床上常用干扰肿瘤微环境的方法是全身化疗[2]。但是,以环磷酰胺为代表的化疗药物本身对恶性肿瘤就有治疗效果,对免疫治疗的效果判定存在干扰。根据既往的研究结果[3,4],荷瘤小鼠经清髓剂量全身放射线照射(TBI)后免疫力极度下降甚至消失,需经骨髓移植才能继续存活以完成进一步的实验观察。2013年9月~2013年12月,我们通过观察不同剂量TBI后荷瘤鼠的生存及肿瘤生长情况,筛选出适宜的全身照射剂量,使动物模型既能获得肿瘤微环境的干扰又能在不应用骨髓移植的前提下保证生存,为进一步的实验提供基础。
1 材料与方法
1.1 材料 雌性C57BL/6小鼠(6~8周龄,体质量18~20 g)购自河北省实验动物中心(许可证编号:SCXK冀2008-1-003);B16F10黑色素瘤细胞株购自中国科学院上海细胞生物学研究所;RPMI1640培养基购自Gibco公司;胰蛋白酶购自HyClone公司;胎牛血清购自杭州四季青生物工程材料有限公司。
1.2 方法
1.2.1 B16F10黑色素瘤细胞培养及荷瘤小鼠模型制备 B16F10黑色素瘤细胞株在含10%胎牛血清的RPMI-1640培养液中,于37℃、5%CO2饱和湿度的条件下培养,常规胰蛋白酶消化传代。取对数生长期的细胞,经0.25%胰蛋白酶消化,PBS清洗后制备成活细胞悬液,台盼蓝染色法检测细胞活力>95%,调整细胞浓度为1×106/mL用于实验。取0.2 mL活细胞悬液皮下接种于C57BL/6小鼠背部皮下,建立黑色素瘤小鼠模型。对照组小鼠于背部皮下注射等量生理盐水。
1.2.2 移植肿瘤组织学检查 细胞接种7 d后,颈脱位法处死小鼠,剪去皮肤,观察皮下移植肿瘤的形态、质地和活动度等;游离肿瘤组织,常规固定、石蜡包埋后切片进行HE染色,于光镜下观察。
1.2.3 荷瘤小鼠放疗耐受实验 细胞接种第7天,将荷瘤小鼠随机分为4组:TBI 5 Gy组、TBI 7 Gy、TBI 7 Gy组后加骨髓移植组、荷瘤无照射组(0 Gy TBI),每组各10只。使用60Co作为荷瘤小鼠的放射源,剂量率为0.5 Gy/min,源皮距为80 cm。第3组在TBI 24 h后经尾静脉注射1×106个健康C57BL/6小鼠新鲜骨髓细胞。
1.2.4 移植肿瘤生长曲线的绘制及荷瘤小鼠生存期记录 每3~4 d用游标卡尺测量各组荷瘤小鼠皮下移植肿瘤的大小,记录肿瘤结节最大长径与平均短径(垂直方向横径的平均值),肿瘤面积=最大长径×平均短径,绘制肿瘤生长曲线。观察各组小鼠一般状况,记录生存期。
1.2.5 荷瘤小鼠外周血白细胞水平测定 荷瘤小鼠放疗前后用眼球取血法取外周全血,用Coulter细胞计数仪检测白细胞水平,并绘制变化曲线。
1.2.6 统计学方法 利用SAS统计分析软件进行统计学处理,各组间比较采用单因素方差分析;应用Kaplan-Meier法进行生存分析并绘制生存曲线,各组生存曲线比较采用LogRank检验。P≤0.05为差异有统计学意义。
2 结果
2.1 B16F10恶性黑色素瘤小鼠模型的建立 将B16F10活细胞悬液接种于C57BL/6小鼠皮下第7天,可见移植肿瘤轻微突出皮面,直径4~5 mm,呈黑色;肿瘤血供丰富,周围可见新生血管形成,有包膜或假包膜。HE染色结果显示,肿瘤组织中可见呈结节样生长的B16F10移植肿瘤细胞团,呈圆形或椭圆形,周围有丰富的新生毛细血管。
2.2 TBI对荷瘤小鼠肿瘤生长的影响 各组荷瘤小鼠肿瘤生长曲线如图1。4组小鼠分别进行不同剂量的60Co放射线照射处理,总剂量分别为0、5、7 Gy及7 Gy+骨髓移植,定期测量肿瘤生长面积。与0 Gy TBI相比,接受5 Gy TBI、7 Gy TBI及7 Gy TBI+骨髓移植处理的荷瘤小鼠其肿瘤生长面积无统计学差异(P均>0.05)。
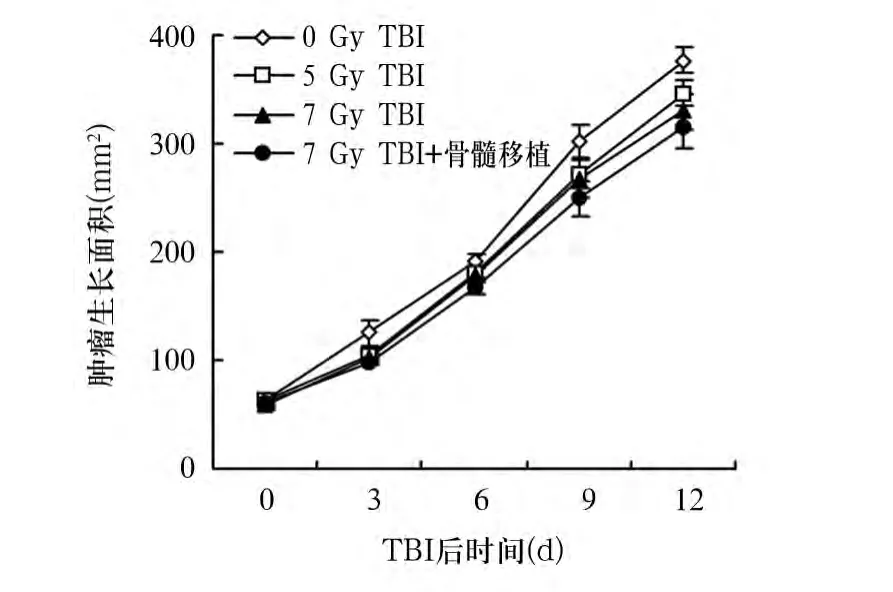
图1 各组荷瘤小鼠移植肿瘤生长曲线
2.2 TBI对小鼠生存期的影响 经不同剂量60Co放射线照射后,观察各组小鼠一般状况至4周。各组小鼠的生存期比较无统计学差异(P=0.843)。见图2。
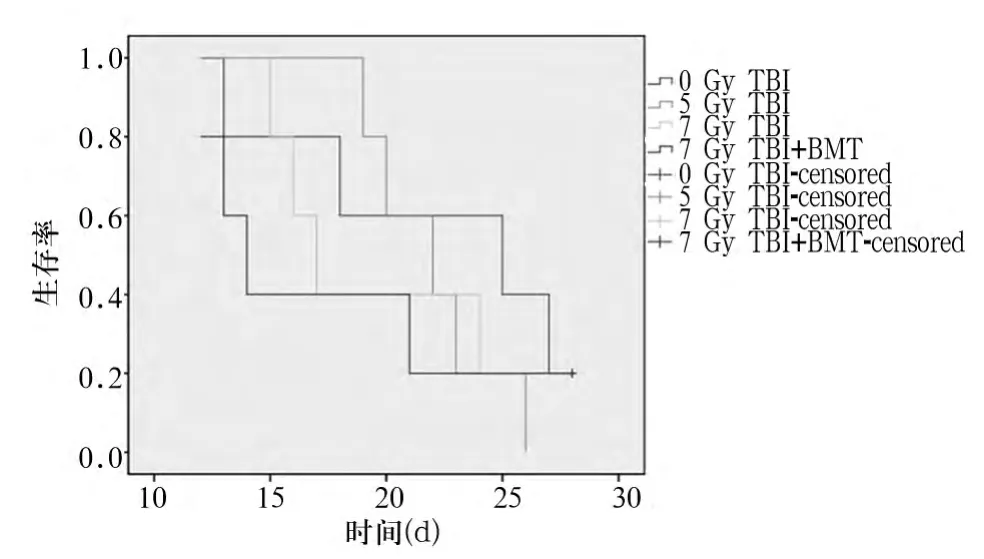
图2 各组荷瘤小鼠生存曲线
2.4 TBI对荷瘤小鼠外周血白细胞水平的影响荷瘤小鼠外周血白细胞水平高于对照组小鼠(P<0.05)。当给予7 Gy TBI后,与放疗前比较,荷瘤小鼠白细胞水平放疗后下降了86%~96%(P<0.05)。见图3。
3 讨论
肿瘤生物治疗是目前公认的治疗恶性肿瘤的主要手段之一,主要包括细胞过继回输免疫治疗、细胞因子、基因治疗和肿瘤疫苗治疗等方法[5~9]。然而肿瘤组织自身产生的机体免疫耐受及对局部免疫微环境的抑制成为影响肿瘤生物治疗疗效的关键。如何打破机体对肿瘤的免疫耐受和改变肿瘤微环境使之产生有利于肿瘤免疫治疗的趋势是目前亟待解决的主要问题。
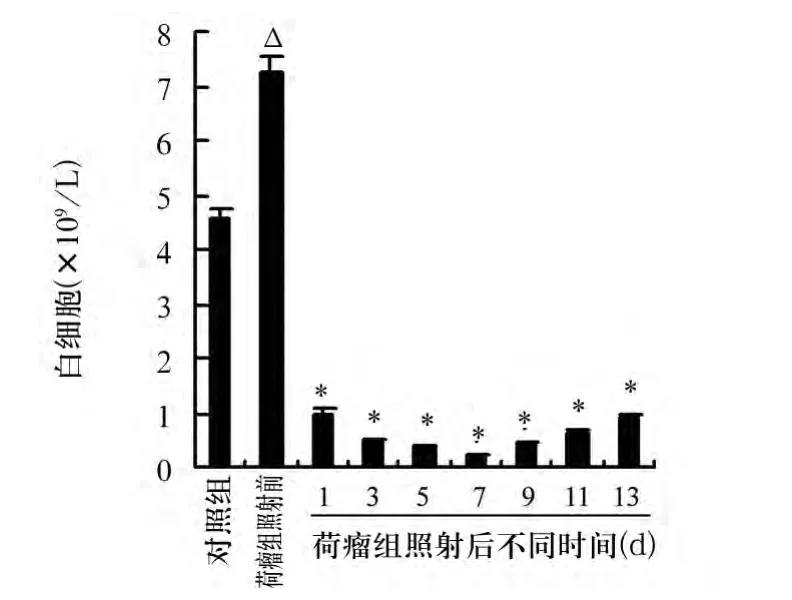
图3 TBI对荷瘤小鼠外周血白细胞水平的影响
恶性黑色素瘤发病隐匿,对放化疗均不敏感,其整体生存率和治愈率并不令人满意,尤其是针对晚期恶性黑色素瘤,目前还没有行之有效的治疗方法[10]。近年来,恶性黑色素瘤免疫治疗的研究备受关注。然而如何打破机体对肿瘤的免疫耐受和改变肿瘤微环境,并使经体外活化免疫治疗效应细胞在肿瘤局部微环境内对肿瘤产生更佳的杀伤效果仍是目前面临的主要问题[11]。已有研究表明,使用化疗或放疗预处理后再应用免疫治疗手段可提高免疫治疗的效果,但其作用机制及疗效判定目前仍不明确[2]。
本研究采用B16F10恶性黑色素瘤细胞株皮下种植的方法制备恶性黑色素瘤小鼠移植肿瘤模型,采用不同剂量TBI作用于荷瘤小鼠,以观察不同剂量TBI对荷瘤小鼠生存、移植肿瘤生长的影响,筛选出既能干扰小鼠肿瘤微环境又能在不应用骨髓移植的前提下保证小鼠存活的适宜TBI剂量,为后续免疫细胞过继回输治疗奠定基础。研究结果显示,通过皮下接种B16F10黑色素瘤细胞的方法成功建立了恶性黑色素瘤小鼠模型。与0 Gy TBI相比,给予不同剂量TBI(5 Gy、7 Gy TBI或7 Gy TBI+骨髓移植)处理的荷瘤小鼠移植肿瘤大小无统计学差异,表明5 Gy或7 Gy照射未能影响小鼠恶性黑色素瘤移植肿瘤的生长。进一步观察不同剂量TBI对荷瘤小鼠存活的影响,结果显示,不同剂量照射组与无照射相比荷瘤小鼠生存期无统计学差异。同时,使用60Co作为放射源,在较低的剂量率(0.5 Gy/min)照射下,即使总剂量达到7 Gy,荷瘤小鼠在不给予同种异体骨髓回输移植的前提下,仍能长期在清洁饲养条件下存活,生存期与给予骨髓移植组相比无统计学差异。这些结果表明,给予7 Gy TBI处理同时不给予骨髓移植,荷瘤小鼠耐受性较好,且该剂量TBI不影响肿瘤生长,此为进一步细胞过继免疫治疗的疗效评价提供了必要的基础。
此外,为了观察7 Gy TBI处理对荷瘤小鼠免疫能力的影响,本研究进一步测定了放疗前后荷瘤小鼠外周血白细胞水平。结果显示,白细胞水平在放疗第1天就迅速下降,并能在第7天降至最低值,表明7 Gy TBI可有效抑制荷瘤小鼠的免疫水平,此为进一步效应细胞免疫治疗提供了条件。
[1]Zhou J,Shen X,Huang J,et al.Telomere length of transferred lymphocytes correlates with in vivo persistence and tumor regression in melanoma patients receiving cell transfer therapy[J].J Immunol,2005,175(10):7046-7052.
[2]Hatiboglu MA,Kong LY,Wei J,et al.The tumor microenvironment expression of p-STAT3 influences the efficacy of cyclophosphamide with WP1066 in murine melanoma models[J].Inter J Cancer,2012,131(1):8-17.
[3]Koh AJ,Novince CM,Li X,et al.An irradiation-altered bone marrow microenvironment impacts anabolic actions of PTH[J].Endocrinology,2011,152(12):4525-4536.
[4]Cao X,Wu X,Frassica D,et al.Irradiation induces bone injury by damaging bone marrow microenvironment for stem cells[J].Proc Natl Acad Sci U S A,2011,108(4):1609-1614.
[5]Soto BL,Hank JA,Van De Voort TJ,et al.The anti-tumor effect of resveratrol alone or in combination with immunotherapy in a neuroblastoma model[J].Cancer Immunol Immunother,2011,60(5):731-738.
[6]Rapoport AP,Aqui NA,Stadtmauer EA,et al.Combination immunotherapy using adoptive T-cell transfer and tumor antigen vaccination on the basis of hTERT and survivin after ASCT for myeloma[J].Blood,2011,117(3):788-797.
[7]Pai CC,Kuo TF,Mao SJ,et al.Immunopathogenic behaviors of canine transmissible venereal tumor in dogs following an immunotherapy using dendritic/tumor cell hybrid[J].Vet Immunol Immunopathol,2011,139(2-4):187-199.
[8]Stewart TJ,Smyth MJ.Improving cancer immunotherapy by targeting tumor-induced immune suppression[J].Cancer Metastasis Rev,2011,30(1):125-140.
[9]Ochi T,Fujiwara H,Yasukawa M.Requisite considerations for successful adoptive immunotherapy with engineered T-lymphocytes using tumor antigen-specific T-cell receptor gene transfer[J].Expert Opin Biol Ther,2011,11(6):699-713.
[10]Kammerer PW,Shabazfar N,Palarie V,et al.Therapy and prognosis of extraoral malignant melanoma metastasizing to the jaw:case report and literature review[J].J Oral Maxillofac Surg,2011,69(4):1229-1234.
[11]Boni A,Muranski P,Cassard L,et al.Adoptive transfer of allogeneic tumor-specific T cells mediates effective regression of large tumors across major histocompatibility barriers[J].Blood,2008,112(12):4746-4754.
