HBx基因转染对人肝癌细胞系HepG2细胞增殖的影响
2015-05-23史光军类成刚陈增银
史光军,类成刚,陈增银
(1青岛市市立医院,山东青岛266001;2青岛市城阳人民医院)
HBx由HBV基因组编码,具有多种调控功能,能激活多个与肿瘤侵袭相关的原癌基因及转录因子,是肝细胞癌发病的独立危险因素[1~3]。2008年3月~2013年3月,我们利用脂质体转染法转染人肝癌细胞系HepG2细胞,并用流式细胞仪、荧光显微镜观察细胞增殖情况,探讨HBx基因与肝癌细胞增殖的关系。
1 材料与方法
1.1 材料 肝癌细胞株HepG2细胞(购自中科院上海细胞库)、脂质体(购自长沙赢润生物科技有限公司)、Annexin V-FITC(购自美国GeneCopoeia中国分公司)、SP试剂盒(购自福州迈新生物科技有限公司)、2%戊二醛(中国医药集团上海化学试剂公司),寡核苷酸引物根据HBx基因的序列自行设计引物(由长沙赢润生物公司合成)。
1.2 方法
1.2.1 重组X质粒转染HepG2细胞 HepG2细胞生长于含10%胎牛血清的MEM中,以脂质体转染的方法分别将重组X质粒、未重组X质粒转染入HepG2细胞中,命名为转染HBx细胞组、转染空载体细胞组,另设未转染HepG2细胞组,每组8例。具体步骤如下:选取对数生长期HepG2细胞,胰酶消化接种于直径25 cm培养瓶,细胞数为1×106/L,6 h后细胞即可贴壁,继而进行转染。37℃预热的无血清培养基加入 DNA 5 μg、Trans Fast Reagent 15 μL,立即涡旋混匀,室温下静置10~15 min。小心移出培养细胞的培养基,稍涡旋混匀脂质体/DNA混合物,轻轻加入培养瓶中,37℃孵育24 h,轻轻加入含血清的培养基(完全培养基)4 mL,不必移去脂质体/DNA混合物,37℃继续孵育48 h。
1.2.2 流式细胞仪检测HepG2细胞增殖活性 ①悬浮细胞离心(2 000 r/min离心5 min),贴壁细胞用不含EDTA的胰酶消化收集。②用PBS洗涤细胞2次,调整待测细胞的浓度为5×105~1×106/mL;取1 mL细胞,1 000 r/min 4℃离心10 min,弃上清。③加入1 mL冷的PBS,轻轻振荡使细胞悬浮,1 000 r/min 4℃离心10 min,弃上清,重复步骤2次。④加入500 μL的 Binding Buffer悬浮细胞。⑤加入5 μL Annexin V-FITC 混匀后,加入5 μL Propidium Iodide,混匀;避光室温反应15 min或4℃反应30 min。⑥室温、避光反应5~15 min。⑦加入300 μL Binding Buffer,在 1 h 内上机检测。50 mL PBS(0.01 mol/L,pH 7.4)过滤,4℃避光保存备用。分别将转染HBx细胞组、转染空载体细胞组、未转染HepG2细胞组细胞用含10%胎牛血清的MEM稀释成1×104/mL,接种于6孔培养板。待细胞完全贴壁后,换为不含胎牛血清的MEM,继续培养24 h:每孔加入 Annexin V-FITC 50 μL(5 mg/mL),继续培养4 h。小心吸掉培养孔内的上清液,每孔加入75 μL DMSO,振荡10 min,至结晶充分溶解。在492 nm波长下测定各孔的A值,代表各孔细胞增殖情况。
1.2.3 荧光显微镜观察各组细胞增殖比率 滴一滴上述染色后的细胞悬液于载玻片上,并用盖玻片盖上细胞。对于贴壁细胞来说,也可直接用盖玻片来培养细胞并诱导细胞凋亡,其步骤为:①将细胞于盖玻片上生长,用适当的凋亡诱导剂诱导细胞凋亡,并设立阴性对照组;②用PBS洗涤细胞两次;③在500 μL 的 Binding Buffer中加入 2 μL Annexin VFITC、5 μL Propidium Iodide,混匀;④将上述溶液滴加于盖玻片表面,使长有细胞的盖玻片表面均匀覆盖;⑤避光、室温反应5 min。将盖玻片倒置于载玻片上,于荧光显微镜下滤光片观察Annexin V-FITC荧光信号。
1.2.4 统计学方法 采用SPSS13.0统计软件,计量数据用±s表示,多组间数据比较采用单因素方差分析。计数资料以百分比表示,数据比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组细胞一般情况 转染HBx细胞组的HepG2细胞在37℃孵育72 h,生长较其他两组的肝癌细胞密集。转染空载体细胞组和未转染HepG2细胞组的细胞未见异常增殖。PCR扩增结果提示,转染HBx的HepG2细胞组中有X基因表达,表达的灰度值为0.926±0.105;而空载转染组和未转染HepG2细胞组中均未见有X基因的表达;三组间比较有统计学差异(P<0.05))
2.2 各组流式细胞仪增殖分析及荧光显微镜图像观察情况 流式细胞仪增殖分析显示,转染HBx细胞组的HepG2细胞较多处于增殖期(G2期细胞占5.68%)(见图1)。荧光显微镜图像显示,转染HBx细胞组的HepG2细胞于37℃孵育72 h处于增殖期的细胞比率为47%,转染空载体细胞组处于增殖期的细胞比率为28%,未转染HepG2细胞组处于增殖期的细胞比率为25%。转染HBx细胞组处于增殖期的细胞比率与其他两组比较有统计学差异(P均<0.05)。见图2。
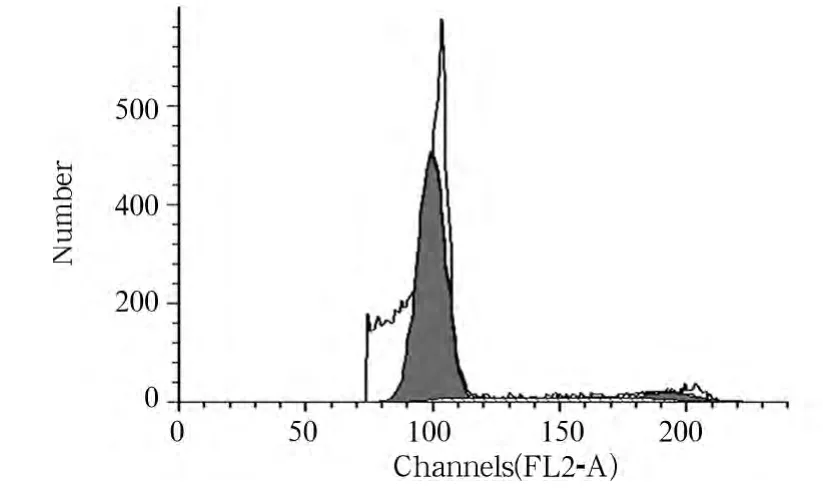
图1 转染HBx细胞组HepG2细胞流式增殖情况
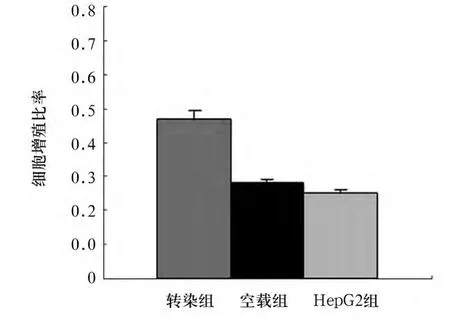
图2 荧光显微镜下各组细胞增殖比率
3 讨论
HBV慢性感染是世界范围内原发性肝细胞癌(HCC)的主要发病原因之一,HBx基因致HCC发生的机制是目前研究的热点。HBx基因存在于HBV基因的第4个阅读框,为第1374~1838位核苷酸,长约465 bp。HBx基因在HBV中高度保守,其编码的HBx蛋白分子量约为17 kD,具有强大的生物学功能,包括反式激活病毒基因组和宿主细胞基因的转录、增强转录因子DNA结合特性、抑制p53蛋白活性、抑制细胞DNA的修复、参与细胞信号传导途径和细胞凋亡的调节等。这些功能可能与HCC 的发生具有密切的关系[4,5]。Zhu 等[6]检测 30例HCC患者,证实了HCC组织中存在HBx蛋白的表达;杨盛力等[7]对21例HCC采用免疫组化方法进行检测,发现肝癌细胞组织中HBx呈弥漫性表达。一些体内及体外研究也发现HBx可诱导细胞的恶性转化甚至参与癌变发生[8,9]。因此,观察HBx对体外细胞增殖的影响,可为进一步研究HBx致HCC的发生机制提供依据和线索。
本实验以脂质体转染的方法成功将X基因转染入HepG2细胞,并与转染空载体细胞组和未转染HepG2细胞组进行对照。发现转染HBx细胞组较其他两组的肝癌细胞密集,而转染空载体细胞组和未转染HepG2细胞组的细胞未见异常增殖。PCR扩增结果提示转染HBx的HepG2细胞组中有X基因的表达,而空载转染组和未转染HepG2细胞组中均未见有X基因的表达。说明HBx具有促细胞增殖作用,可能参与肝细胞恶性转化并促进其增殖。进一步用流式细胞仪分别检测三组细胞增殖情况,结果发现,转染HBx细胞组的HepG2细胞较多处于增殖期。荧光显微镜图像显示转染HBx细胞组的HepG2细胞处于增殖期的比率较其他两组明显升高。
HBx生物学效应十分复杂,有学者认为HBx主要通过反式激活机制调节细胞的增殖凋亡,参与调控细胞周期和细胞信号转导途径促进肿瘤发生[10]。随着人们对HBxAg研究的不断深入,发现X基因是高度保守的序列,但HCC却常伴有X基因突变,HCC与HBx基因的持续表达有密切关系。突变发生于缺乏核酸错配校正能力的病毒复制期或HBV整合和重排过程,突变X基因产生变异HBx。目前已能够用一种显色方法检测突变HBx的转活化功能,其转活化能力升高或降低因突变类型而异。自然发生的X基因突变经历肿瘤细胞选择,通过改变HBx的生物学功能,尤其是丧失诱导凋亡能力使肝细胞长期存活,在其他致癌因素作用下发生癌变[11,12]。X基因插入宿主DNA活化原癌基因或灭活抑癌基因中,是HCC启动和演进的主要原因之一。X基因整合对人HCC发生的作用可能略有不同。约90%HBsAg阳性的HCC患者整合有HBV基因,整合部位多在DR1、DR2及两者之间的黏性末端,因此 X基因大多保留且伴 3'端截短。在mRNA检测中发现,HCC选择性表达X基因,而不表达S、C基因。推测细胞恶性转化是由于X基因及其增强子促进下游EGFR基因转录活化高表达所致。Diamantis等[13]采用RT-PCR方法检测了48例HCC组织中HBV基因在RNA水平的表达情况。其中,HBs基因表达者检出2例,HBc基因检出7例,而HBx基因检出40例。从RNA和蛋白质两个水平上都有证据说明HBx基因的表达与HCC的发生有密切关系。
[1]Su Q,Schoder CH,WJ,et al.Expression of hepatitis B virus x protein in HBV-infected human livers and hepatocellular carcinoma[J].Hepatology,1998,27(4):1109-1120.
[2]Hoare J,Henkler F,Dowling JJ,et al.Subcellular localization of the X protein in HBV infected hepatocytes[J].Med Viral,2001,64(4):419-426.
[3]李伟,刘传苗,赵守松.原发性肝细胞癌患者肝组织中乙型肝炎病毒X基因的变异[J].实用医学杂志,2009,25(2):180-181.
[4]Arbuthnot P,Kew M.Hepatitis B virus and hepatocellular carcinoma[J].Int J Exp Pathol,2001,82(2):77-100.
[5]Huang J,Deng Q,Wang Q,et al.Exome sequencing of hepatitis B virus-associated hepatocellular carcinoma[J].Nat Genet,2012,44(10):1117-1121.
[6]Zhu M,London WT,Duan B,et al.The value of hepatitis B X antigen as a prognostic marker in the development of hepatocellular carcinoma[J].Int J Cancer,1993,55(4):571-576.
[7]杨盛力,张万广,陈孝平,等.Pin1在肝硬化和肝癌组织中的表达及其与乙型肝炎病毒X蛋白的关系[J].腹部外科,2007,20(4):240-242.
[8]程斌,林松挺,杨玉珍,等.乙型肝炎病毒x影响肝细胞增殖与凋亡的初步研究[J].临床内科杂志,2008,25(2):132-134.
[9]Chen L,Hu L,Li L,et al.Dysregulation of β-catenin by hepatitis B virus X protein in HBV-infected human hepatocellular carcinomas[J].Front Med China,2010,4(4):399-411.
[10]李程,王永康,王昌源,等.乙型肝炎病毒X抗原表达与肝细胞凋亡的相关性[J].中华肝脏病杂志,2013,21(4):252-256.
[11]王海平,陈孝平,何松清,等.调节胞内HBx的表达对肝细胞凋亡的影响[J].中华肝脏病杂志,2003,11(7):440.
[12]Toh ST,Jin Y,Liu L,et al.Deep sequencing of the hepatitis B virus in hepatocellular carcinoma patients reveals enriched integration events,structural alterations and sequence variations[J].Carcinogenesis,2013,34(4):787-798.
[13]Diamantis ID,McGandy CE,Chen TJ,et al.Hepatitis B X-gene expression in hepatocellular carcinoma[J].J Hepatology,1992,15(8):400-403.
