流式细胞技术检测人异体血液回输方法研究
2015-05-23河春姬张力思徐友宣吴侔天
河春姬,杨 声,董 颖,张力思,景 晶,徐友宣,吴侔天
1 前言
异体血液回输是指向人体内输入血型相同的异体血液的方法,例如,A型血的人输入他人提供的A型血液。这一方法在20世纪初被确立下来,随后,普遍应用于临床治疗。由于异体血液回输能够迅速增加红细胞数量,增强机体氧气运输,提高有氧运动能力,20世纪60年代,已有运动员通过使用血液回输等血液兴奋剂提高体育运动成绩。在1988年汉城奥运会上,血液回输作为血液兴奋剂正式被国际奥委会(IOC)列入禁用范围。近年来,由于对促红细胞生成素和血液替代品兴奋剂检测水平的不断进步,使得采用血液回输方法作弊再度流行[8]。
一直以来,研究人员都没有找到理想的方法来检测兴奋剂异体血液回输,一是,用以往的临床检验技术无法区分是否输入异体同型血液;二是,与受体红细胞总数相比输入的供体红细胞比例很低,且红细胞的数量和寿命随着时间推移而缩减;再者,红细胞属于无核的终末分化的细胞,无法利用现有的遗传学检测技术根据核内遗传物质脱氧核糖核酸(DNA)来鉴定其归属。
澳大利亚学者Nelson提出,应用流式细胞术的血型血清学方法检测运动员使用异体血液回输,其原理是根据个体之间红细胞血型抗原谱的差异,通过红细胞免疫荧光标记方法,应用流式细胞技术来检测是否存在异体红细胞[11,13,12]。2008年 ,Giraud、Arndt等 在 前 人 研 究 的 基 础 上进一步验证并发展了该方法[10,6]。
流式细胞术是集激光技术、流体力学、细胞免疫学等于一体的生物技术,可对流过光学或电子检测器的单个细胞进行连续的多参数分析,近年在输血医学中有较广泛的应用。与普通红细胞凝集实验相比,流式细胞仪的最大特点是能够根据不同的红细胞抗原免疫荧光标记,快速、灵敏、定量分析红细胞表面抗原表达情况,将异体红细胞群区分开,并以图形、数据形式直观的将检测结果呈现出来。
人类血型抗原是一个庞大的家族。1900年奥地利维也纳大学卡尔·兰德斯坦纳发现了人类红细胞ABO血型,从此揭开了血型的神秘面纱。国际输血协会(ISBT)将目前已知并已证实的339个红细胞血型抗原归为33个血型系统、7个血型集合及2个血型系列。随着新的血型抗原被发现,这些数字也不断增长[4]。临床异体输血的原则是同型输血,但通常只对血样进行ABO血型和Rh血型的检验,即使是对其他血型有特殊要求,也几乎不可能找到拥有完全相同红细胞血型抗原的供者(同卵双生除外)。当人体接受了异体输血后,体内就会存在红细胞表面抗原性状表达不同的两种红细胞群,因此,若能证明不同红细胞群的存在就能判断是否异体输血。
本研究参考国外相同领域先进实验技术和方法,采用流式细胞技术对异体血液回输的检测方法进行了适用性验证研究,以证明使用流式细胞技术检测异体血液回输的可靠性和可操作性。
2 材料与方法
2.1 实验对象及样品制备
本实验对象为半年内未接受过输血的健康中国人12名,抽取静脉血2.5ml,使用ABO血型检测试剂检测其ABO血型。其中A型血2人,B型血6人,O型血3人,AB型血1人,RhD血型均为阳性。
样品制备人员将A、B、O血型相同且测定的8种血型抗原至少有2种不相同的单一血样制备成体外混合血样。混合血样依据红细胞数按一定比例混合,混合比例分别为95%/5%、97%/3%、98.5%/1.5%、99.5%/0.5%,各 比例混合血样的例数分别为8例,8例,8例,10例。样品制备人员将所有单一和混合血样编号后发放给检测人员进行检测分析。
2.2 仪器和试剂
本实验所用检测仪器为美国Beckman Coulter公司生产的FC500型号流式细胞仪。使用抗体为瑞士DiaMed公司生产的单克隆抗体产品,以及SEROTEC公司生产的FITC荧光标记的羊抗人免疫球蛋白。
2.3 实验方法
用细胞稳定液将EDTA抗凝的新鲜血稀释后,加入单克隆抗体,使之与相应的红细胞表面抗原结合,并用荧光素标记的示踪抗体标记红细胞表面抗原抗体复合物。使用流式细胞仪对红细胞表面特定血型抗原的表达情况进行数据采集和分析。通过对此方法检测的特异性和灵敏度、信噪比和污染携带率、检测样品稳定性和操作稳定性等方面的检测,验证流式细胞仪检测异体血液回输方法的准确性和可操作性。
3 实验结果
3.1 抗原检测特异性和灵敏度
经检测,这46例血样的检测判定结果为:12例单一血样全部被检出单峰并被准确判为阴性(表1)。8例95%/5%和8例97%/3%比例混合的血样均被检测出两个以上双峰,所有应为混合双峰的样品均被准确检出;8例98.5%/1.5%比例混合的血样在应出现双峰的样品图中能被识别为双峰,但个别抗体双峰分离效果不佳,需进行抗体优化程序后方能被判定为双峰;10例99.5%/0.5%比例混合的血样中,只有4例样品被判断为含2个以上双峰,其他混合样品由于混合比例低于抗体检测限而无法判定(图1)。

表1 本研究12个单一血样8种血型抗原的表达情况一览表Table 1 The Phenotypes of Eight Blood Antigens in Twelve Samples
3.2 仪器信噪比和污染携带率
3.2.1 仪器信噪比
以8种抗体在95%/5%混合红细胞样品中只加入荧光示踪抗体时,表达区域的红细胞数占已设定的红细胞区域内细胞总数的百分比作为噪音,以3倍噪音作为该抗体的检测限(表2)。

图1 本研究红细胞c抗原表型柱状图Figure 1. Histograms of RBC Antigen c
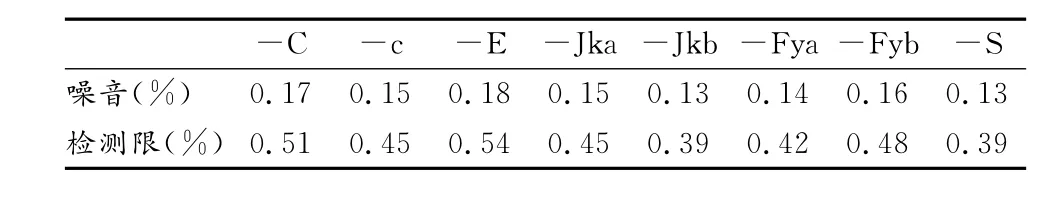
表2 本研究8种抗体检测的噪音和检测限一览表Table 2 Noise and Limit of Detection for Eight Blood Antigens
3.2.2 污染携带率
根据流式细胞仪检验要求,在完成一次样品检测后立即检测一支纯水空白管,记录30s内红细胞设定区域内检测到的颗粒数(N),重复200次,将检测到的颗粒数相加,用此数值除以红细胞设定区域内的细胞收集总数(A),并与重复次数作比,乘以100%得到污染携带率(CR)。公式为:

计算所得结果符合仪器厂商推荐的污染携带率小于1%的要求,说明仪器连续进样检测不同样品不会因进样器污染而导致假阳性结果的出现。
3.3 样品稳定性
在8例97%/3%混合的血样和12例单一血样中分别任意挑选1例,分别分装在4个离心管中,冰箱4℃保存。在制备血样的第1、5、14、28天分别对这两例血样进行血型抗原检测,测定血液样品随时间变化的稳定性。结果显示,经过4周的冷藏存放,混合和单一血样图的锋形及相对位置无显著变化,检测结果稳定。
3.4 操作稳定性
在46例血样中选出6个样品,其中包含单一血样和各比例混合血样。将其分装成3份,分别由3位检测人员完成对血型抗原的检测,验证不同操作者对检测结果判定的一致性。结果显示,3位检测人员的检测及判断结果一致。
4 讨论
4.1 方法验证
本实验应用流式细胞术的血型血清学方法对46例血样进行红细胞血型抗原的检测,其中,12例单一血样的特异性验证结果全部为阴性,符合世界反兴奋剂机构关于兴奋剂检测方法的检测结果应满足100%阴性率和0%的假阳性率的特异性要求[14]。
对方法灵敏度的验证结果显示,3%及以上比例少量混合的红细胞被检出率达到100%。当少量混合的红细胞比例降低时,部分样品某些抗原表达与非表达的红细胞群分离效果不好,出现融合峰或拖尾峰影响判断,此时进行抗体优化程序可以解决或改善峰形问题。而当混合比例进一步降低至0.5%少量混合时,除了峰形问题外,由于定量结果低于抗体检测限而使混合血样检出率明显降低。造成这一结果的原因可能有:1)红细胞血型抗原密度和抗原性强弱不同,导致其与抗体结合能力存在差异;2)每种抗体效价不同,检测限也有高低,其检出能力由检测限值最高的抗体决定;3)这8种抗体分别为单克隆抗体IgM和IgG,由于抗体结构特点,结合了IgM抗体的红细胞更易聚集,造成单细胞悬液制备不完全,聚集的多细胞被检测为单细胞,导致定量结果低于检测限,因此,尽管有的检测人员能够从柱状图上观察到微弱的双峰,但由于测定到的混合比例低于检测限而不能将其判定为阳性。此外,流式细胞仪状态也会对检测结果造成影响,导致少量混合的红细胞信号无法被检测人员识别。
噪音和污染携带率影响了流式细胞仪的检测能力,通过每次上机检测前对仪器的校正以及对噪音和污染携带率的计算,来评估仪器状态。仪器噪音过大,会掩盖微弱的双峰信号,导致假阴性结果的判定,而污染携带率过高则可能导致假阳性结果。因此,在检测过程中对仪器状态的确认是必要的。定期的维护和保养可以减少仪器本身对结果的影响。
人体血量约为4~5L,其中,循环血量约占总血量的4/5。有研究显示,循环系统血红蛋白增加5%可以提高运动能力[9],输血量太少则达不到增加血红蛋白量进而提高有氧耐力的目的。由于异体输血伴随感染、溶血、血液粘稠、疾病传播等高风险因素,采用极少量输入多个供血者血液的可能性较小,因而,此方法的检测灵敏度能够满足兴奋剂检测的需要。通常红细胞在人体内的寿命约120天,这意味着,在异体输血后,理论上最多可以有长达3至4个月的检测窗口期能够检测到异体血液回输。相比传统兴奋剂只有几天的检测窗口期来说,该方法能够大大提高兴奋剂检查的效率。
用细胞稳定液稀释的混合血样在冷藏条件下至少可存放4周,以此模拟运动员进行异体输血后一段时间体内不同红细胞群的比例关系。在4周内,不同操作人员对相同样品测得的混合红细胞群比例无明显变化,说明此方法稳定性好,可操作性高。
4.2 阳性判定
根据世界反兴奋剂机构(WADA)对于免疫抗原法检测兴奋剂的要求,异体血液回输阳性判定的标准为:在1份血样中,当有2个或2个以上特定红细胞抗原存在多于1种表型时,判定为异体血液回输阳性(AAF);当只有1个特定红细胞抗原存在多于1种表型时,判定为可疑(ATF)[14]。正常情况下,每个人体内所有红细胞抗原的表达是唯一的,即要么表达,要么不表达,当体内某种红细胞抗原同时存在表达与不表达的情况时(如图1a),即存在两种不同的红细胞群,提示有异体输血。当然上述判定还需要排除嵌合体血型情况。
嵌合体血型多发生在异型输血、异卵双生、双精受精和异型骨髓移植后。异型输血、异型骨髓移植属于获得性嵌合(人工嵌合),异卵双生、双精受精是遗传嵌合,属于先天性嵌合。先天性嵌合,指在胚胎或妊娠时期形成的嵌合。先天性嵌合分两种情况,一种是由于妊娠早期异卵双生子之间存在血管交叉吻合,一方的造血干细胞经由吻合的血管通路进入到另一方体内,在获得性免疫耐受的基础上,不同来源的造血干细胞分别产生两群不同表型的红细胞。另一种是在受精过程中,由2个卵细胞和2个精子相互结合而产生四倍体,四倍体受精卵继续分裂就可能产生多种不同来源的细胞系。嵌合体现象会导致血型遗传不符合经典遗传规律。此外,某些疾病也会导致嵌合体现象[2,3,5]。因此在采用本方法检测发现异体血液回输阳性时,运动员需进行嵌合体血型鉴定,以排除先天性嵌合情况。
4.3 红细胞血型抗原
血型是血液系统的一种遗传多态性。传统的血型概念指的就是红细胞血型,是指能以抗体来分类的红细胞抗原表型。红细胞血型抗原是红细胞表面的化学构型,其形成的物质基础是红细胞膜上的蛋白质及结合到脂质和蛋白质上的糖分子。根据生化特性不同,红细胞血型抗原可分为两类,一类是由糖分子结构决定的血型抗原,如ABO、Hh,Lewis,P,I等血型;另一类是由蛋白质结构决定的血型抗原,如 Rh,MNS,Kell,Kidd,JK等血型。人类血型抗原由血型基因决定,同时受调控基因或修饰基因控制,具有个体差异性和种族差异性。
WADA对于流式细胞术检测异体血液回输的方法中涉及到的红细胞血型抗原的选择未做明确规定,一般以红细胞血型抗原表型在人群中表达的比例作为选择依据,在人群中表达型和不表达型均占有一定比例的血型抗原可作为候选抗原。表3列出了不同研究、赛事及机构选择的血型抗原种类和数量。可以看出,尽管各研究根据人群表达情况不同,选择的血型抗原有所差异,但是都包括本文研究的这8种基本的血型抗原。

表3 不同研究选择的红细胞血型抗原一览表Table 3 Choice of Blood Antigens in Different Research
本研究选择了8种公认的在人群中有适当比例分布的血型抗原进行中国人样本的检测分析的结果发现,受试的11名中国人中最多有3人存在ABO血型及其他8种血型抗原表型完全一致的情况。换句话说,假如这3个人相互之间进行异体输血,且排除了红细胞血型抗原密度的个体差异时,将不能被检测为阳性。理想状态下,能够检测的候选红细胞血型抗原种类越多,检测的假阴性率就越低,但对于大样本量的实际兴奋剂检测工作来说,可操作性较差。因此,科学地选择红细胞抗原种类进行检测,可以有效提高兴奋剂检测效率。李晟玮[1]对Rh、Kell、Duffy、Kidd、Lewis、P、MNS和Luth等系统中的21个候选血型抗原进行了检测,发现其中 Leb、E、Jka、Jkb、M、C、e、c等血型抗原更适合于检测中国人群异体血液回输,并发现增加检测血型抗原的数量,能够有效减少异体输血检测假阴性发生的概率。意大利的Donati等人也有类似报道,他们发现,在8种基本血型抗原的基础上增加另外5种(e,s,K,Lea,Leb)血型抗原后,能够提高混合血样的检出率[7]。然而,在实际兴奋剂检测工作中,实验室检测人员无法得知所检测样品的运动员个人信息,这为根据不同种族运动员选择不同血型抗原的个性化的检测手段的实施带来一定难度。因此,在近两届奥运会异体血液回输的兴奋剂检测中,都只选择了这8种基本血型抗原进行检测。
5 小结
利用流式细胞技术能够很好的检测和区分小比例混合后血液中存在的不同红细胞群,有效检测运动员非法使用异体回输血液兴奋剂。目前,这一方法已通过了世界反兴奋剂机构和中国合格评定国家认可委员会认可,并已应用于常规检测和奥运会等大型赛事的异体血液回输兴奋剂检测中。
[1]李晟玮.血液兴奋剂异体同型输血检测方法的研究[D].北京:北京体育大学,2009.
[2]柳燕,赵珍敏,林源.2例亲权鉴定案中的嵌合体STR谱分析[J].中国司法鉴定,2012,(4):68-76.
[3]喻琼,郑岩.嵌合体血型的研究进展[J].中国输血杂志,2010,23(2),146-148.
[4]张印则,徐华,周华友.红细胞血型原理与检测策略[M].北京:人民卫生出版社,2014.
[5]朱培元,严京梅,薛敏,等.双精子嵌合体致ABO血型正反定型不符1例[J].临床输血与检验,2014,16(1):28-30.
[6]ARNDT P A,KUMPEL B M.Blood doping in athletes-detection of allogeneic blood transfusions by flow cytofluorometry[J].Am J Hematol,2008,83(8):657-667.
[7]DONATI F,STAMPELLA A,DE LA TORRE X,et al.Investigation on the application of DNA forensic human identification techniques to detect homologous bloodtransfusions in doping control[J].Talanta,2013,15(110):28-31.
[8]MELIOLI G,D’ONOFRIO G.Blood doping:present procedures and detection techniques[J].Expert Rev Endocrinol Metabolism,2006,1(6):793-800.
[9]GLEDHILL N.Blood doping and related issues:a brief review[J].Med Sci Sports Exe,1992,(12):182-189.
[10]GIRAUD S,ROBINSON N,MANGIN P,et al.Scientific and forensic standards for homologous blood transfusion anti-doping analyses[J].Forensic Sci Int,2008,179(1):23-33.
[11]NELSON M,ASHENDEN M,LANGSHAW M,et al.Detection of homologous blood transfusion by flow cytometry:a deterrent against blood doping[J].Haematologica,2002,87(8):881-882.
[12]NELSON M,COOPER S,NAKHLA S,et al.Validation of a test designed to detect blood-doping of elite athletes by homologous transfusion[J].Aus J Med Sci,2004,25(1):27-33.
[13]NELSON M,POPP H,SHARPE K,et al.Proof of homologous blood transfusion through quantification of blood group antigens[J].Haematologica,2003,88(11):1284-1295.
[14]WADA-ISL-2012.International standard for laboratory[S].
