胸腔镜腹腔镜联合食道癌手术与开放手术治疗效果比较
2015-05-20朱一蒙
朱一蒙
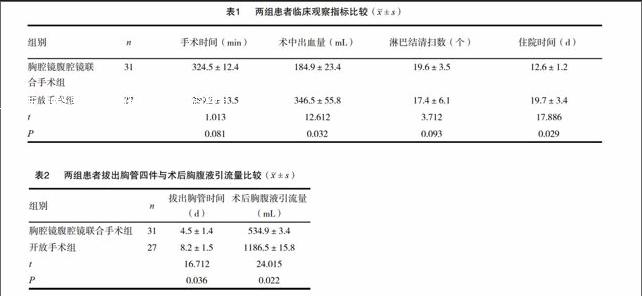
[摘要] 目的 探讨胸腹腔镜联合食道癌手术的临床疗效和安全性,讨论与开放手术临床疗效的差异。 方法 回顾性分析2004年8月~2014年8月我院的58例食管癌患者,其中应用胸腔镜腹腔镜联合食道癌手术的31例,应用传统开放手术的27例,比较两组患者的手术情况,如手术时间、术中出血量、术中淋巴结清扫数、术后引流时间、住院时间和术后疼痛时间,以及术后并发症发生情况。 结果 胸腔镜腹腔镜联合手术组的患者手术时间和术后引流时间较开放手术组短(P<0.05);术中出血量较开放手术组少(P<0.05);术后的疼痛评分较开放手术组低(P<0.05);两组手术方式中淋巴结的清理数与住院时间无统计学差异(P>0.05);术后胸腔镜腹腔镜手术组的并发症发生率显著低于开放手术组(P<0.05)。 结论 胸腔镜腹腔镜联合手术治疗食道癌较传统开放手术治疗方法具有创伤小、时间短、并发症少等优点,可提高患者的生活质量,值得进一步研究和临床推广应用。
[关键词] 胸腔镜;腹腔镜;食道癌;开方手术;效果
[中图分类号] R735.1 [文献标识码] B [文章编号] 2095-0616(2015)04-143-04
食道癌(esophageal carcinoma)是一种由于食管黏膜上皮细胞病变而形成恶性肿瘤,主要以局部入侵为主。我国食道癌的高发人群主要是50~69岁的中老年人,而且发病率和死亡率均较高[1],男性的发病率要较女性高。食道癌主要发病位置以食道中段居多,其次是下段,而上段较少,主要临床表现为进行性吞咽梗阻感胸骨后闷胀和疼痛感。食道癌中期患者主要以手术为主,放、化疗为辅的治疗方法,而晚期患者则以放、化疗为主,手术为辅的治理方法。食道癌的主要治疗手段是手术切除,清扫加二野或三野淋巴结是手术切除治疗法的首选[2],近年来我过食道癌手术治疗取得很大的进展,术后5年以上生存率可以达到25%~41%[3]。开放手术切除食管创伤很大,且术后并发症和死亡率都很高[4],对患者的身体状况和心理承受能力都是一个非常大的考验。因此食道癌微创手术逐渐受到重视和应用。胸腔镜腹腔镜联合食管癌切除手术是针对食道癌手术治疗法的主要微创手术方法,该方法与开放手术相比具有创伤小、恢复快及安全性高等优点[5-6]。因此,本院拟比较胸腔镜腹腔镜联合手术方法和开放手术对食道癌患者手术情况的优缺点,探讨分析胸腹腔镜联合食道癌手术的临床疗效和安全性,为临床判断更适合的手术方法提供参考,现研究报道如下。
1 资料与方法
1.1 一般资料
回顾分析我院2008年8月~2014年8月期间,58例食管癌患者,其中应用胸腔镜腹腔镜联合食道癌手术的31例,应用传统开放手术27例。其中男26例,女32例;年龄48~75岁,平均年龄(61.3±5.1)岁。其中,食道胸上段癌症为23例,胸中段癌症为18例,食道下段癌症为17例。肿瘤直径2.1~3.9cm。患者经超声、CT等影像学检查结果确诊为食道管鳞状细胞癌,现象为肿瘤无浸润、未显示远处迁移,纵膈无淋巴结肿大,无胸内淋巴结转移压迫表征,无严重的心肺功能不全,主要器官无功能障碍。所有病例无胸、腹部手术史。患者的性别、年龄、肿瘤位置、肿瘤直径、病理类型均无统计学差异。
1.2 手术方法
术前留置胃管以及进行肠胃减压,两组患者均采用气管插管全身麻醉。首先进行腹腔操作:头高脚低30°左右卧位,选择脐下方约1cm处作为切口,切开皮肤,置入气腹针以建立人工气腹,使腹腔维持腔内压力在2000Pa左右。置入Trocar再接入腹腔镜,镜头向下;于腹直肌两侧,脐上3cm处和左右锁骨中线肋缘下方3cm左右出作4个操作孔置入直径为1cm和5mm的Trocar。由远至近探查腹腔:观察脏器、大网膜及盆腔有无粘连、腹水、腹膜后肿大的淋巴结、异常结节及肿块。左游离胃大弯用超声刀,在距胃网膜右血管弓外2cm位置处切开,保留胃网膜右血管弓,分离大网膜至结肠脾曲段,分别切断胃网膜左动脉、胃短动脉、胃后动脉、胃脾韧带及胃膈韧带直至贲门左侧。用无痛钳提拉肝左叶,切开小网膜,分离肝胃韧带,保留胃右血管,上端到贲门右侧,下端到幽门处。将胃向上提起,将胃左血管暴露出来,小心打开血管鞘,清扫胃左血管淋巴结,用血管夹双重夹闭后,切断胃左血管。先提起肝左叶,显露两侧膈肌,部分切断双侧膈肌脚,并将食管周围腹膜反折,以扩大食管裂孔;再进入纵膈,分离食管下段5~8cm处,暂时不与胸腔相通。检查有无活动性出血,清点器械敷料以防遗留,最后缝合腹部切口。
其次进行胸腔操作:将患者取左侧90度卧位,选择右胸第7肋间腋中线作为穿刺点,置入Trocar和胸腔镜,用单肺通气,并在第5肋间腋后线作1.5cm常的切口,该位置入分离钳;于腋后线第七肋间作1.5cm长的主操作孔,该位置入超声刀;于腋前线第5肋间作1.5cm长的操作孔,置入肺拉钩,根据患者的肿瘤位置、身材及肥瘦等实际情况选择适当的主操作点。寻找肿瘤病灶,仔细探查肿瘤的活动情况、外侵情况及淋巴结情况,如见肿瘤已经明显外侵而且有固定转移方向,应及时中转为开胸手术或者放弃手术。如发现严重致密的粘连则应沿肩胛下角线方向延长腋后线第五肋间切开5~7cm长的切口,用电凝钩或这超声刀对粘连进行分离。用抓拉钩将肺向前侧拉开,自下而上用电凝钩或超声刀切开食管表面,分开胸膜及奇静脉上下方胸膜,并游离奇静脉,注意奇静脉后方深面小血管分支用闭合夹双重结扎,超声刀切断奇静脉。从远离食管肿瘤的位置开始分离食管,用套纱带牵引将食管向上提起。周围组织浸润较轻则表明肿瘤活动,容易分离,反之则浸润严重,在浸润腔镜下较难分离,则需要转为开胸手术。用超声刀游离食道管,并将食道管病变段一并游离,从胸顶到膈肌食管裂孔,然后清扫纵隔、食道管旁和隆突下及左右喉返神经旁淋巴结。游离食道管下段时,应注意胸导管的走向,分离病变位置时,应注意分清与主动脉肺门血管及气管,不要损伤胸导管。食道管处严密止血后,用环钳扩大膈肌裂孔约5cm,此时胸腔与腹腔相连通。endprint
在肩胛下角线方向延长到腋后线第五肋间处5~7cm切口,用小牵开器撑开切口,卵圆钳分离和扩大食道管膈肌的裂孔,将胸段食管及胃向胸膜顶方向轻柔并牵拉;然后将胃拉向胸腔到小切口处,在肿瘤上方5~7cm处或右胸膜顶处用荷包钳作食管缝合。置入25mm管状吻合器钉入砧头后,收紧结扎。切断食道管,装入标本袋并移出。用 ENDOGIA 沿小弯侧向幽门方向作切割,形成约长于原食管长度5cm左右的胃管。在管状胃顶端作3cm长的切口,切开管状胃末端,向幽门方向放入吻合器使之与食管进行吻合,用ENDOGIA闭合切除包括胃顶端切口在内的多余管状胃。留置鼻空肠管及胃管,完成手术。术中注意放置胸腔引流。
术后进行常规方法处理,ICU监护1d,并进行常规的胃肠减压和禁食,2d后给予场内营养。患者肠胃功能恢复,肛门排气后可以拔出胃管,以流质事物为主向半流质过度,患者行走无不适之后可以申请出院。
3 讨论
食道癌是世界最常见的六大恶性肿瘤之一,在全世界范围内主要的高发地区集中位于东北亚、中亚、南非和东非;而我国的高发区主要集中在广东潮汕地区、河南、河北山西和山西等地区。当今食道癌的确切病因并不明了,但是导致该病的危险因素可能包括遗传因素、营养不良、缺乏某微量元素、亚硝胺的慢性刺激或不良的饮食习惯等。根据1980年Earlam 和CunhaMelo[7]报道食道癌的开放手术术后死亡率高达29%,给人们的日常生活带来了严重的影响。目前,随着科学发展和技术的日趋成熟,食道癌术后死亡率有了明显的下降,但是仍不足以成为食道癌临床治疗的金标准。现阶段,微创手术,即胸腔镜腹腔镜联合治疗食道癌手术逐渐受到重视。
Lukerich等[8]于2000年首次报道胸腔镜腹腔镜联合食道管切除手术。但因器械限制、术者对腔镜操作能力局限,以及跨科室手术合作,造成胸科医生行腹腔镜操作难度增大,因此胸腔镜腹腔镜食道癌切除手术出现实施治疗时间较晚,导致胸腔镜腹腔镜食道癌手术发展较为缓慢。胸腔镜腹腔镜联用早期的手术方法包括:腹腔镜+食管裂孔+颈部[9]、腹腔镜+开胸[10]、胸腔镜+开腹[11]、腹腔镜+开胸+颈部[12]、胸腔镜+开腹+颈部[13]。胸腔镜腹腔镜联合食道癌手术难度大,技术要求高。实施手术者不但要熟练地掌握胸部相关解剖结构以及胸腔镜下操作,还要掌握腹部解剖结构和腹腔镜下腹部的操作。
本组研究中,通过对两组食道癌患者分别实施在胸腔镜腹腔镜联合治疗和传统开放手术治疗,胸腔镜腹腔镜联合治疗手术组患者术中出血量、术后胸腹液引流液量、住院时间拔出胸管时间等方面与传统开放手术组相比明显优越,差异具有统计学意义(P<0.05)。
综上所述,运用胸腔镜腹腔镜联合进行微创手术具有非常大的临床优势,临床治疗过程和治疗效果明显,具有很好的安全性,是食道癌患者的有效、安全、可靠治疗方法,并且发展前景广阔,具有重大临床推广应用价值[14]。
[参考文献]
[1] 王茜,景学安,李栋.食管癌危险因素流行病学研究进展[J].泰山医学院学报,2007,28(12):999-1002.
[2] 刘伟,张仁泉,于在诚,等.胸腹腔镜联合手术治疗食管癌[J].临床医学,2011,31(3):1-3.
[3] 陈慧勇. 两种淋巴结清扫方式治疗胸段食管癌术后 5年生存率的 Meta分析[D]. 广州:暨南大学, 2011:34-35.
[4] Atkins BZ,Shah AS,Hutcheson KA,et al. Reducing hospital morbidity and mortality following esophagectomy[J]. The Annals of Thoracic Surgery,2004,78(4):1170-1176.
[5] 李庆贤. 胸腔镜腹腔镜联合食管癌手术与开放手术治疗效果比较[D]. 汕头: 汕头大学硕士学位论文, 2011:212-213.
[6] Schoppmann SF,Prager G,Langer F, et al. Fifty-five minimally invasive esophagectomies:a single centre experience[J]. Anticancer research,2009,29(7):2719-2725.
[7] Earlam R,Cunha Melo JR. Oesophageal squamous cell carcinoma:I. A critical review of surgery[J]. British Journal of Surgery,1980,67(6):381-390.
[8] Luketich JD,Schauer PR,Christie NA,et al. Minimally invasive esophagectomy[J]. The Annals of thoracic surgery,2000,70(3):906-911.
[9] DePaula AL,Hashiba K,Ferreira EAB,et al. Laparoscopic transhiatal esophagectomy with esophagogastroplasty[J]. Surgical Laparoscopy Endoscopy & Percutaneous Techniques,1995,5(1):1-5.
[10] Kent MS,Schuchert M,Fernando H,et al. Minimally invasive esophagectomy:state of the art[J]. Diseases of the Esophagus,2006,19(3):137-145.
[11] Smithers BM,Gotley DC,Martin I,et al. Comparison of the outcomes between open and minimally invasive esophagectomy[J].Annals of surgery,2007,245(2):232.
[12] Benzoni E,Terrosu G,Bresadola V,et al. A comparative study of the transhiatal laparoscopic approach versus laparoscopic gastric mobilisation and right open transthoracic esophagectomy for esophageal cancer management[J]. Journal of Gastrointestinal and Liver Diseases,2007,16(4):395.
[13] Song SY, Na KJ, Oh SG, et al. Learning curves of minimally invasive esophageal cancer surgery[J]. European Journal of Cardio-Thoracic Surgery,2009,35(4):689-693.
[14] 陈臻,吴晓丹,王枫.胸腔镜联合腹腔镜食管癌切除术的临床效果分析[J].中国医药科学,2014,4(19):159-161.
(收稿日期:2014-10-18)endprint
