FAK基因沉默促进舌癌细胞失巢凋亡及抑制转移的实验研究*
2015-05-20刘华联江宏兵承翼南徐天舒邢树忠
刘华联 ,江宏兵 ,承翼南 ,徐天舒 ,邢树忠
(1常州市第一人民医院口腔科,江苏213001;2江苏省口腔医院·南京医科大学附属口腔医院)
作为一种非受体酪氨酸激酶,粘着斑激酶可通过多种信号分子通路在细胞的运动、迁徙、血管生成等方面发挥重要作用[1-4]。我们通过前期对舌癌原发灶及转移淋巴结的病理分析发现,黏着斑激酶在颊、舌癌等口腔恶性肿瘤中高表达。且表达主要集中在肿瘤生长前沿区及转移区癌细胞中,与颈淋巴结转移的密切相关[5]。本实验以舌癌细胞Tca8113为研究对象,通过设计针对FAK的siRNA,下调舌癌细胞中FAK的表达,进而观察体外实验中FAK对舌癌细胞失巢凋亡及侵袭及迁移能力的影响。
1 材料与方法
1.1 材料 Tca8113舌癌细胞系由南京医科大学口腔医学院惠赠,LipofectamineTM2000转染试剂(美国invitrogen公司),鼠抗人FAK抗体、HRP标IgG二抗、羊抗人β-actin单克隆抗体(北京中杉金桥),G418(美国GIBCO公司),蛋白显色试剂盒(美国PIERCE 公司),Poly-HEMA、Transwell小室(美国SIGMA公司)。
1.2 方法
1.2.1 siRNA序列设计合成及鉴定:此部分工作已在前期研究中完成,设计针对FAK的siRNA命名Tca-FAK,对照组命名为NON-siRNA[6]。
1.2.2 基因转染及筛选:细胞培养皿中接种约3×105个Tca8113细胞,常规培养24小时。100μL无血清无三抗的RPMI 1640培养的培养液溶解5μL LipofectamineTM2000和2μg质粒DNA,然后将混合物加入Tca8113细胞中。在37℃、5%CO2条件下继续培养5 h后,换入含10%新生牛血清的常规RPMI 1640培养基。继续培养24小时,改用含G418 400 mg/L的RPMI 1640培养基进行筛选培养。经反复筛选2~3周后,收集具有G418抗性的细胞克隆增殖。实验组及对照组分别命名为Tca-FAK、Tca-NON。未做任何处理的舌癌细胞命名为Tca8113。
1.2.3 免疫细胞化学法:将已消毒的玻片放置于培养皿中,密度为2×106/L的细胞接种于培养板中进行爬片6小时待细胞贴壁后,95%乙醇固定,过氧化酶阻断剂30min、羊血清30min处理后加FAK单抗过夜。然后加入兔抗鼠IgG及SABC复合物,每个步骤间均以PBS(pH:7.14)轻微振洗。最后DAB显色、脱水、透明、封片。实验以PBS代替一抗做为对照参考。
1.2.4 Western blot实验:常规收获细胞,提取蛋白上样,12mA 2h电泳,300mA、30~60min 转膜。使用10%脱脂奶封闭,1∶2 00浓度鼠抗人FAK抗体 4℃条件下孵育24 h。PBS重复洗3次,加HRP标IgG二抗,37℃下杂交1h,PBS重复洗6次,显影定影并检测膜上印迹。
1.2.5 悬浮培养:无水乙醇溶解poly-HEMA(10g/L),于6孔培养皿加3mL poly-HEMA溶解液。待乙醇挥发后,同样方法和剂量加2遍poly-HEMA溶液,PBS清洗处理过的培养皿3遍备用。常规收获贴壁细胞,以含有10%新生牛血清的RPMI 1640培养液重悬细胞。然后每个培养孔中加入约1×106细胞,常规37℃、5%CO2条件下培养16小时。
1.2.6 流式细胞仪检测细胞凋亡:将单细胞悬液加入2mL圆底离心管中离心,弃上清液。加入PBS 1mL离心洗涤1次,然后加入70%乙醇(预冷)5mL,4℃冰箱固定30分钟。上机检测前离心去乙醇,碘化丙啶染色15min。
1.2.7 划痕试验:于6孔板培养皿中常规培养细胞,6小时后待细胞贴壁生长后,200μL灭菌吸样枪头细胞划痕,在倒置显微镜下观察机械划并照相。48小时后,再次将培养皿在倒置显微镜,观察划痕并照相。每次照相在高倍镜下选取5个视野,同时使用测微尺测量划痕间隙的距离。
1.2.8 侵袭实验:于细胞操作台内将50μL 200mg/L的Matrigel加入Transwell小室内,风干后置于细胞操作台内备用。使用前用RPMI1640培养液清洗,选择3孔,每孔分别加入100μL密度为2×106个/mL细胞悬液。将小室侵入24孔板含小牛血清1640培养基中,常规5%CO2、37°C培养箱内培养24h。取出Transwell小室,甲醇固定,龙胆紫染色及中性树脂封片。在光学显微镜下选择5个视野,计算透膜细胞总数。最后以透膜细胞的相对数来表示Tca8113细胞的侵袭能力。
1.2.9 细胞活性检测:收获实验组及对照组的细胞,台盼蓝染色,细胞计数器计算出染色细胞,以此计算出细胞活性率。实验重复3次,取均数进行比较。
1.3 统计学处理 数据处理采用SPASS统计软件,计量指标采用均数±标准差(x¯±s)表示,差异性比较采用t检验和重复测量方差分析,P<0.05表示差异有统计学意义。
2 结 果
2.1 基因沉默结果鉴定 激光共聚焦显微镜下观察发现转染外源性质粒后细胞形态发生变化,细胞皱缩,细胞碎片增多。FAK siRNA和NON-siRNA质粒因携带红色荧光标记和绿色荧光标记。成功转染后Tca-FAK组细胞中可见红色荧光表达,Tca-NON中可见绿色荧光表达,表明外源性质粒顺利转染入Tca8113细胞(图1a,b)。免疫细胞化学(图1c)及Western-blot(图1e)结果显示:Tca8113细胞中FAK表达为强阳性,外源性质粒转染后Tca-FAK组FAK表达较转染前明显下降,Tca-NON组细胞中FAK表达无明显变化。表明RNAi成功实现FAK的下调(图 1c,d,e)。
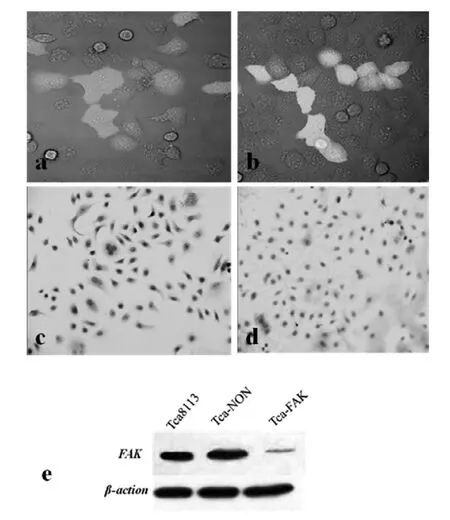
图 1 基因沉默鉴定结果(a、b:400×;c、d:200×)
2.2 FAK基因沉默对舌癌细胞Tca8113增殖和凋亡影响 3组细胞在单层贴壁状态下培养16小时后,细胞活力检测及流式细胞仪结果显示:Tca-FAK及Tca-NON组细胞的活力较Tca8113组细胞有轻微的下降,凋亡片段也有轻微的增加,但各组间数据比较差异无统计学意义,表明FAK基因沉默对舌癌细胞的增殖和凋亡无明显影响。见表1。

表1 FAK基因沉默前后舌癌细胞活性及凋亡分析(x¯±s,%)
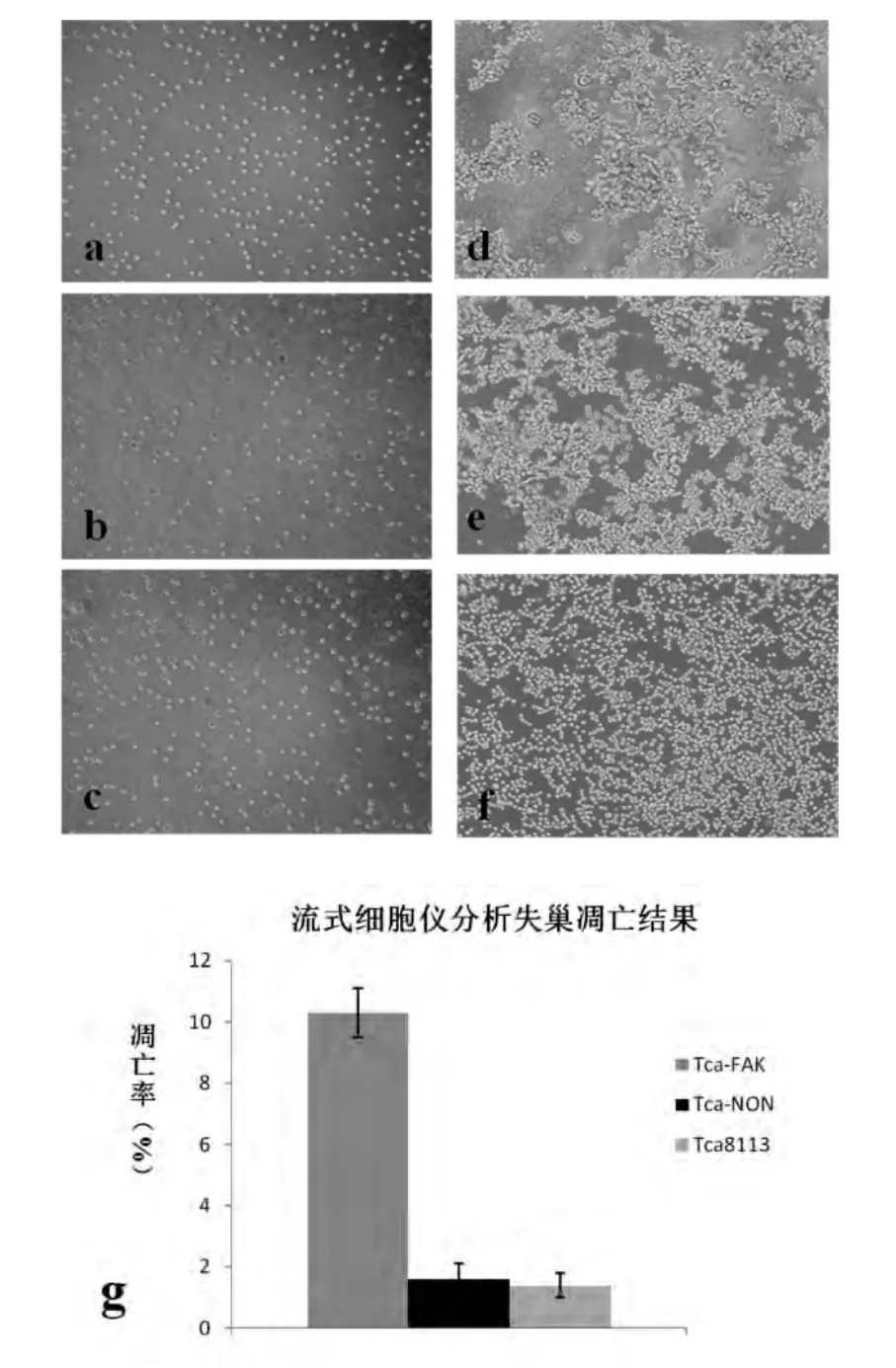
图2 FAK基因沉默促进舌癌细胞Tca8113失巢凋亡
2.3 FAK基因沉默对舌癌细胞Tca8113迁移能力影响 细胞化痕实验结果显示:48小时后对照组(Tca-NON)细胞迁移距离为(0.91+0.05)mm,实验组(Tca-FAK)细胞迁移距离为(0.30+0.03)mm,肿瘤细胞迁移能力明显降低(P<0.01),如图3。

为了进一步观察FAK基因沉默对Tca8113失巢凋亡的影响,我们采用polyHEMA培养基剥夺细胞的贴壁培养条件,诱导细胞悬浮生长。不同于贴壁培养状态下细胞的单层生长方式,16小时后,显微镜下观察到,Tca8113细胞及Tca-NON组细胞呈现集聚性生长的方式(图2d,e),但Tca-FAK组细胞并未出现明显的集聚性生长状态(图2f)。流式细胞仪分析细胞凋亡结果显示:Tca-FAK的凋亡片段显著高于对照组及Tca8113组(P<0.01),表明FAK基因沉默可促进舌癌细胞的失巢凋亡(图2g)。

图3 FAK基因沉默对舌癌细胞Tca8113迁移能力的影响
2.4 FAK基因沉默对舌癌细胞Tca8113侵袭能力影响 体外Transwell小室实验结果显示:对照组细胞侵袭透膜数为211.4+5.3个,而FAK基因沉默后的Tca8113细胞,侵袭能力明显下降,仅为64.6+3.0(P<0.01)。见图 4。

图4 FAK基因沉默对舌癌细胞Tca8113侵袭能力影响
3 讨 论
做为一种非受体酪氨酸激酶,粘着斑激酶可通过多种信号分子通路在细胞的运动、迁徙、血管生成等方面发挥重要作用[1-4]。课题组人员前期通过对舌癌原发灶及转移淋巴结的病理分析发现:黏着斑激酶在颊、舌癌等口腔恶性肿瘤中高表达,且主要集中在肿瘤生长前沿区及转移区癌细胞中,与颈淋巴结转移的密切相关[5]。
为了验证FAK在舌癌侵袭转移中作用,初期体外实验中,课题组成功构建针对FAK的靶向RNA(small interfering RNA,siRNA)质粒表达载体,免疫细胞化学及western-blot蛋白印迹检测到舌癌细胞Tca8113中FAK表达明显下调。进一步实验,课题组通过划痕和Transwell小室侵袭试验来观察FAK基因沉默前后舌癌细胞侵袭和迁移能力的变化。实验结果显示FAK基因沉默后,Tca8113细胞的侵袭和迁移能力均得到明显抑制(P<0.01),初步显示FAK信号通路在舌癌细胞侵袭和迁移中的作用。
锚着依赖性生存(anchor-dependent survival)是正常实体组织细胞具有的特点之一,一旦在脱黏附状态下就会发生凋亡,即失巢凋亡(anoikis)。发生转移的癌细胞则具失巢凋亡抗性,即在脱黏附状态下可以一种特殊的形式生存,这也是癌细胞可发生远处转移的生物学机制之一。目前已有学者通过体外实验证实失巢凋亡抗性在口腔癌、胰腺腺癌等的转移中起到关键性的作用[3-4,7-8]。为验证FAK信号通路在舌癌细胞增殖及凋亡中作用,本实验第一阶段在60mm培养皿上,将FAK基因干扰前后的细胞进行单层贴壁培养,细胞活性检测和流式细胞仪分析发现,基因干扰前后舌癌细胞Tca8113的活性及凋亡比较差异均无统计学意义。至于其中轻微的差异,笔者认为可能是基因片段转染入肿瘤细胞后,因负荷增加而导致其活性及凋亡有轻微差异。总结第一阶段实验结果,我们认为单层贴壁培养状态下,FAK信号通路改变对舌癌细胞的增殖和凋亡无明显影响。第二阶段,在相同条件下我们将基因沉默前后的细胞,在poly-HEMA处理过的60mm培养皿上进行相同时间的悬浮培养后,流式细胞仪测量的凋亡结果显示:悬浮培养状态下,FAK基因沉默后,细胞的凋亡率明显增加(P<0.01)。实验中我们有趣的发现,Tca8113细胞及Tca-NON组细胞呈现集聚性生长方式,但Tca-FAK组细胞并未出现这种集聚性生长。参考国内外文献,笔者认为FAK可能激活了包括MAPK、PI3K-Akt/PKB等信号级联反应,因失巢引起的源于细胞外基质的生存信号进而得到补偿。癌细胞因具有失巢生存的能力,可在脱黏附状态下生存,进而发生转移。
综上所述,我们认为FAK基因沉默明显增加Tca8113细胞的失巢凋亡能力,进而逆转癌细胞的失巢凋亡抗性,降低了其侵袭和转移的能力。在进一步的实验中,我们将对FAK下游相关信号通路进行实验分析,探讨其可能的分子途径,以期为口腔癌的治疗提供一种崭新的思路。
[1]Liu MZ,Y ang Y,Wang C,et al.The effect of epidermal growth factor receptor variant IIIon glioma cellmigration by stimulating ERK phosphorylation through the focal adhesion kinase signaling pathway[J].Arch Biochem Biophys,2010,502(2):89-95.
[2]Earley S,Plopper GE.Phosphorylation of focal adhesion kinase promotes extravasation of breast cancer cells[J].Biochem Biophys Res Commun,2008,366(2):476-482.
[3]Duxbury MS,Ito H,Zinner MJ,,et al.Focal adhesion kinase gene silencing promotes anoikis and suppressesmetastasis of human pancreatic adenocarcinoma cells[J].Surgery,2004,135(5):555-562.
[4]Mclean GW,Carragher NO,Avizienyte E,et al.The role of focal-adhesion kinase in cancer-a new therapeutic opportunity[J].Nat Rev Cancer,2005,5(7):505-515.
[5]江宏兵,田卫东,李声伟,等.口腔鳞癌粘着斑激酶表达与颈淋巴结转移的关系[J].实用口腔医学杂志,2003,19(3):199-201.
[6]刘华联,江宏兵,邢树忠,等.靶向黏着斑激酶siRNA表达载体构建及转染Tca8113细胞的沉默效应[J].实用口腔医学杂志,2008,24(1):13-16.
[7]Paoli P,Giannoni E,Chiarugi P.Anoikismolecular pathways and its role in cancer progression[J].Biochim Biophys Acta,2013,1833(12):3481-3498.
[8]Carduner L,Picot CR,Leroy-Dudal J,et al.Cell cycle arrest or survival signaling throughαv integrins,activation of PKC and ERK1/2 Lead to anoikis resistance of ovarian cancer spheroids[J].Exp Cell Res,2014,320(2):329-342.
