β受体阻滞剂对体外培养血管内皮细胞增生及凋亡的影响
2015-05-20李丽,尉莉,马琳
李 丽,尉 莉,马 琳
β受体阻滞剂对体外培养血管内皮细胞增生及凋亡的影响
李 丽,尉 莉,马 琳

李 丽
目的 了解普萘洛尔、阿替洛尔、醋丁洛尔及噻吗洛尔对体外培养的血管内皮细胞增生及凋亡的影响。方法 对人脐静脉血管内皮细胞进行体外培养,分别加入9种浓度的4种药物,设立阴性及阳性对照,采用cell counting kit-8(CCK-8)法检测细胞增生,Annexin-V FITC/PI双染法检测细胞凋亡。结果 ①同一药物不同浓度之间抑制率比较:普萘洛尔和阿替洛尔结果一致,各个浓度之间抑制率P均<0.05;醋丁洛尔和噻吗洛尔结果一致,3.125 μmol/L与12.5 μmol/L及12.5 μmol/L与50 μmol/L抑制率P均>0.05,其余浓度间抑制率P均<0.05。②同一浓度的不同药物之间抑制率比较:在200、100、50 μmol/L 3种浓度时,普萘洛尔与阿替洛尔、醋丁洛尔及噻吗洛尔抑制率比较P均<0.05,后3种药物抑制率比较P均>0.05;在25 μmol/L浓度时,普萘洛尔与醋丁洛尔抑制率比较P均<0.05;其余药物抑制率比较P均>0.05。在12.500、6.250、3.125、1.562 5、0.781 3 μmol/L这5种浓度中,同一浓度的不同药物抑制率比较P均>0.05。③对细胞凋亡的诱导:普萘洛尔、阿替洛尔与阴性对照组凋亡率比较P均<0.05;阿替洛尔、普萘洛尔、醋丁洛尔和噻吗洛尔与二氯化钴组凋亡率比较P均<0.05;而阿替洛尔、普萘洛尔、醋丁洛尔和噻吗洛尔4种药物凋亡率比较P均>0.05。结论 4种药物均可抑制细胞增生,普萘洛尔作用最强,且随着药物浓度增加抑制作用也明显增强;4种药物均可诱导细胞凋亡,但彼此之间无明显差异。
β受体阻滞剂;增生,人脐静脉血管内皮细胞;血管瘤
[J Pract Dermatol, 2015, 8(6):411-414]
婴儿血管瘤是婴儿期最常见的良性肿瘤,由胚胎期间的血管组织增生而形成,以血管内皮细胞异常增生为特点,发生在皮肤和软组织的良性肿瘤。自从2008年Léauté-Labrèze[1]发现普萘洛尔对婴儿血管瘤有很好的疗效后,已有临床随机对照研究证明普萘洛尔治疗婴儿血管瘤安全而有效[2]。目前,普萘洛尔已成为治疗高风险级别婴儿血管瘤的一线药物[3]。由于普萘洛尔为非选择性β1及β2受体阻滞剂,其β1受体阻断作用可引起心率减慢、低血压,β2受体阻断可诱发支气管平滑肌收缩和支气管哮喘,另外还可能引起低血糖等不良反应。故已有学者在临床上尝试使用其他β受体阻滞剂,如阿替洛尔为选择性β1受体阻滞剂,用于对普萘洛尔耐受性较差的血管瘤患儿,取得了很好的疗效,且不良反应较少[4]。醋丁洛尔为选择性β1受体阻滞剂,也具有一定的内源性拟交感活性,可以减少对心脏的抑制作用,临床应用更安全。有研究报道,口服普萘洛尔治疗血管瘤停药后复发,采用醋丁洛尔取得了良好的疗效,并且未见明显的不良反应[5]。同时已有大量文献报道外用噻吗洛尔治疗浅表型婴儿血管瘤取得了很好的疗效[6]。
尽管有大量临床研究报道[7],但关于这4种β受体阻滞剂在抑制细胞增生及诱导细胞凋亡方面的作用有无差别尚不清楚。本研究拟通过体外人脐静脉血管内皮细胞(human umbilical vein endothelial cells , HUVEC)培养、加入100 μmol/L二氯化钴对细胞进行刺激后使其迅速增生,从而模拟体内血管瘤内皮细胞增生模式,观察不同浓度普萘洛尔、阿替洛尔、醋丁洛尔及噻吗洛尔干预下HUVEC的增生及凋亡。
1 资料与方法
1.1 试验材料
1.1.1 细胞株 HUVEC由南京凯基生物科技发展有限公司提供。完全培养基为90% RPMI-1640+10% FBS,于37℃、5%CO2、饱和湿度的培养箱中培养。试验细胞加入100 μmol/L二氯化钴进行刺激24 h,使其迅速增生;阴性对照细胞不加入二氯化钴及药物,阳性对照细胞只加入二氯化钴,不加入药物。1.1.2 主要试剂 普萘洛尔、阿替洛尔、醋丁洛尔、噻吗洛尔、二氯化钴、青霉素/链霉素溶液、0.25% Tripsin-EDTA(南京凯基生物科技发展有限公司),RPMI-1640(美国 GIBCO),FBS(美国ExCell Biology),cell counting Kit-8(日本 DOJINDO Laborataries),LDH 试剂盒,Annexin V-FITC细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司)。
1.1.3 主要仪器与设备 超净工作台(苏州净化 SWCJ-1FD),CO2培养箱(日本 SANYO XD-101),生物倒置显微镜(日本OLYMPUS Ⅸ51),台式低速离心机(上海医疗器械股份有限公司医疗设备厂80-2),酶标仪(美国BioTek ELx800),流式细胞仪(美国 Becton-Dickinson FACS Calibur)。
1.2 方法
1.2.1 CCK-8法检测细胞增生 细胞消化、计数,配制成浓度为5×104个/ml的细胞悬液,96孔细胞培养板中每孔加入100 μl细胞悬液;用完全培养基稀释药物至所需浓度,每孔加入200 μl相应的含药培养基,同时设立阴性对照组及阳性对照组;将96孔板每孔加入10 μl CCK-8,进行CCK-8染色,λ=450 nm,测定A值;计数各组的抑制率,抑制率(%)=(阴性对照组-试验组)÷阴性对照组×100%。
1.2.2 Annexin-V FITC/PI双染法检测细胞凋亡 将对数生长期的细胞消化接种到6孔板中,次日待细胞贴壁后,根据组别设置加入相应的含药培养基,同时设立阴性对照组;药物作用24 h后,用0.25%胰酶(不含EDTA)消化收集细胞;用PBS洗涤细胞2次(离心2 000 r/min,共5 min)收集5×105细胞;加入500 μl的Binding Buffer悬浮细胞;加入5 μl Annexin V-FITC混匀后,加入5 μl propidium iodide,混匀;室温,避光,反应5~15 min;用流式细胞仪检测(Ex=488 nm;Em=530 nm)细胞凋亡。
1.3 统计学方法
计量资料以均数±标准差表示,采用SPSS17.0统计软件进行单因素方差分析及卡方检验,以P <0.05为差异有统计学意义。
2 结果
2.1 不同浓度β受体阻滞剂作用于血管内皮细胞24 h后对细胞增生的影响(表1)
2.1.1 不同浓度β受体阻滞剂对血管内皮细胞的抑制作用 9个浓度组的普萘洛尔、阿替洛尔、醋丁洛尔及噻吗洛尔均对增生的血管内皮细胞有一定的抑制作用,随着浓度的增加,抑制率逐渐上升,浓度越高,对细胞增生的抑制作用越强,具有剂量依赖抑制关系。2.1.2 同一浓度的不同药物之间抑制率比较 在200、100、50 μmol/L 3种浓度时,均表现为普萘洛尔抑制作用最强,与阿替洛尔、醋丁洛尔及噻吗洛尔的抑制作用比较差异均有统计学意义,后三者之间抑制率无明显差异。在25 μmol/L浓度时,普萘洛尔与醋丁洛尔抑制率之间差异有统计学意义。在12.5、6.25、3.125、 1.562 5、0.781 3 μmol/L这5种浓度中,同一浓度的不同药物之间抑制率差异均无统计学意义。
2.1.3 二氯化钴对血管内皮细胞的刺激作用 二氯化钴作为阳性对照,7个浓度组的二氯化钴对血管内皮细胞有一定的刺激增生作用,随着浓度的增加,刺激率逐渐上升,具有剂量依赖刺激关系。
2.2 不同浓度β受体阻滞剂及二氯化钴作用于血管内皮细胞24 h后对细胞凋亡的影响
流式仪检测结果显示,阴性对照组细胞凋亡率为8.40%,100 μmol/L二氯化钴凋亡率为5.86%,200 μmol/L阿替洛尔凋亡率为18.50 %,200 μmol/L普萘洛尔凋亡率为18.57 %,醋丁洛尔 200 μmol/L凋亡率为15.08 %,噻吗洛尔 200 μmol/L凋亡率为17.05 %。与阴性对照组比较,阿替洛尔和普萘洛尔与阴性对照组的细胞凋亡率比较差异有统计学意义;与二氯化钴组比较,阿替洛尔、普萘洛尔、醋丁洛尔和噻吗洛尔与二氯化钴组的细胞凋亡率差异均有统计学意义;而阿替洛尔、普萘洛尔、醋丁洛尔和噻吗洛尔4种药物之间的细胞凋亡率差异无统计学意义(图1)。
表1 不同浓度β受体阻滞剂作用24 h对二氯化钴诱导后的内皮细胞增生的影响 (±s)

表1 不同浓度β受体阻滞剂作用24 h对二氯化钴诱导后的内皮细胞增生的影响 (±s)
注:普萘洛尔、阿替洛尔、醋丁洛尔及噻吗洛尔4种药物同一浓度之间比较结果:与普萘洛尔组比较,*P<0.05;与阿替洛尔组比较,★P<0.05;与醋丁洛尔组比较,■P<0.05。相同药物不同浓度比较:与阴性组比较,▲P<0.05;与0.781 3 μmol/L组比较,◆P<0.05,与3.125 μmol/L组比较,☆P<0.05;与12.5 μmol/L组比较,◇P<0.05;与50 μmol/L组比较,△P<0.05
浓度(μmol/L )普萘洛尔 阿替洛尔 醋丁洛尔 噻吗洛尔 二氯化钴实际(A值) 抑制率(%) 实际(A值) 刺激增生率(%)200 0.591±0.017▲◆☆◇△51.94 0.915±0.013*▲◆☆◇△30.23 0.876±0.025*▲◆☆◇△28.70 0.812±0.012*▲◆☆◇24.43 1.347±0.05 11.51 100 0.713±0.01 41.99 0.954±0.002* 27.31 0.931±0.013* 24.27 0.829±0.011*22.84 1.395±0.041 15.45 50 0.816±0.011▲◆☆◇33.60 1.042±0.007*▲◆☆ 20.58 0.996±0.026*▲◆☆◇18.99 0.855±0.027*▲◆☆◇20.36 1.371±0.008 13.52 25 0.951±0.027 22.59 1.086±0.048 17.25 1.052±0.04*14.40 0.907±0.023 15.58 1.357±0.003 12.31 12.5 1.012±0.015▲◆☆17.66 1.098±0.01▲◆☆16.34 1.096±0.025▲◆10.79 0.961±0.025▲◆10.52 1.276±0.019 5.60 6.25 1.075±0.033 12.50 1.165±0.016 11.20 1.108±0.013 9.82 0.982±0.021 8.57 1.245±0.003 3.06 3.125 1.126±0.043▲8.38 1.216±0.023▲7.29 1.132±0.027▲7.89 0.997±0.025▲7.20 1.233±0.006 2.10 1.562 5 1.156±0.018 5.94 1.232±0.03*6.12 1.186±0.033 3.53 1.012±0.01 5.74 0.781 3 1.169±0.033 4.88 1.252±0.034 4.60 1.222±0.052 0.60 1.023±0.019 4.72阴性对照组 1.216±0.036 0 1.302±0.053 0 1.229±0.059 0 1.074±0.051 0 1.208±0.006 0 (%) 实际(A值) 抑制率(%) 实际(A值) 抑制率(%) 实际(A值) 抑制率
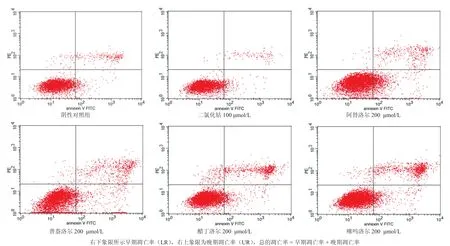
图1 β受体阻滞剂及二氯化钴作用于血管内皮细胞24 h后对细胞凋亡的影响
3 讨论
普萘洛尔目前被认为是治疗重症婴儿血管瘤的一线药物[3]。虽然其疗效确切,但机制仍未明了。有学者发现,普萘洛尔可以通过低氧诱导性因子-1α-血管内皮生长因子-A (HIF-1α-VEGF-A)轴发挥其对血管瘤的抑制作用,普萘洛尔引起HIF-1α通路抑制血管瘤内皮细胞VEGF-A的表达[8]。另外,信号肽介导通路包括PI3/Akt和p38/MAPK,能减少内皮细胞的迁移、血管发生和最终的凋亡,最后直接引起细胞毒性效应。Tazi等[9]研究得出普萘洛尔能使内皮一氧化氮合酶(endothelial nitric oxide synthase, eNOS)活性和表达分别降低47%和75%,低水平的eNOS能直接降低一氧化氮(nitric oxide, NO)的产生,从而导致血管收缩和降低血管紧张度。另外,eNOS的降低能减少血管瘤内皮细胞的增生和长期控制血管瘤增生。另有研究显示,普萘洛尔可通过抑制血管内皮细胞由G0期向G1期的转变而导致细胞周期停滞,并可抑制内皮细胞迁移、分化成毛细血管样管状结构,从而抑制血管生成[10]。故本药在增生期及消退期均可能对血管瘤有治疗作用。以上的发现初步阐述了普萘洛尔治疗婴儿血管瘤的可能机制,也为今后应用普萘洛尔及其他β受体阻滞剂治疗婴儿血管瘤机制的进一步深入研究打下了良好的基础。同时也有学者在尝试使用其他β受体阻滞剂治疗婴儿血管瘤,如阿替洛尔、醋丁洛尔、噻吗洛尔等,均取得了一定的疗效。但不同的β受体阻滞剂在抑制细胞增生及促进凋亡方面是否存在差异,以及药物浓度与增生和凋亡的相关性尚无理论基础。
本研究采用体外血管内皮细胞培养,加入不同浓度、不同种类的β受体阻滞剂,观察其24 h对血管内皮细胞的增生抑制情况及促进凋亡情况。发现在普萘洛尔、阿替洛尔、醋丁洛尔及噻吗洛尔这4种β受体阻滞剂中,均表现为抑制血管细胞的增生,这与临床中所见到的抑制瘤体增生情况是一致的。其中,普萘洛尔抑制细胞增生的作用明显高于其他3种药物,尤其在高浓度时这种差距更明显,这也从体外试验角度证明普萘洛尔疗效较其他药物更好。而对于同一种β受体阻滞剂不同浓度的抑制作用而言,浓度越高,抑制作用越强,这与临床研究中普萘洛尔治疗血管瘤的剂量依赖关系是符合的,即口服普萘洛尔剂量越大,疗效越好[2]。其余3种药物尚无剂量比较的临床研究,根据体外试验的结果,可考虑它们也有一定的剂量依赖性。此项研究提示噻吗洛尔在高浓度时(50 μmol/L和200 μmol/L),其抑制细胞增生程度之间无统计学差异。临床应用中噻吗洛尔主要为外用制剂,治疗浅表性血管瘤的噻吗洛尔外用制剂中有0.1%[11],0.25%[12 ]及0.5%[13]3种浓度。关于浓度与疗效的关系,体外试验已经提示噻吗洛尔抑制细胞增生的程度并未随着药物浓度增加而增强,是否临床应用的3种浓度疗效存在差异,尚需进一步临床研究证实。如果体外研究与临床研究结果相吻合,则外用低浓度的噻吗洛尔即达到良好的治疗效果,可避免浓度增加带来的不良反应。
既往研究报道,普萘洛尔作用于血管内皮细胞24 h后即可诱导其凋亡[14],这与本研究中普萘洛尔对血管内皮细胞的诱导凋亡情况是一致的。关于其他β受体阻滞剂对血管内皮细胞的诱导凋亡的情况尚未见报道。根据本研究结果显示,在诱导内皮细胞凋亡方面,阿替洛尔、醋丁洛尔及噻吗洛尔均可诱导血管内皮细胞凋亡,且诱导细胞凋亡在用药后24 h即可出现,这与临床中应用β受体阻滞剂治疗血管瘤早期即可见瘤体颜色变浅或质地变软相吻合[15]。但4种药物之间诱导细胞凋亡率相比,并未见差异。
综上所述,普萘洛尔、阿替洛尔、醋丁洛尔及噻吗洛尔4种不同的β受体阻滞剂对血管内皮细胞均有一定的抑制作用。在抑制细胞增生方面,普萘洛尔作用最强,且随着药物浓度增加抑制作用越明显;在诱导细胞凋亡方面,4种药物也均有作用,但彼此之间未见差别。由于β受体阻滞剂治疗血管瘤的机制复杂,本研究只是探讨了其中一部分,其余尚有相关血管生成因子如VEGF、碱性成纤维细胞生长因子(bFGF),细胞循环中的周期蛋白等变化与血管瘤消退的关系,尚需今后进一步研究证实。
[1] Léauté-Labrèze C, Dumas de la Roque E, Hu biche T, et al. Propranolol for severe hemangiomas of infancy [J]. N Engl J Med, 2008, 358(24):2649-2651.
[2] Léauté-Labrèze C, Hoeger P, Mazereeuw-Hautier J, et al. A randomized, controlled trial of oral propranolol in infantile hemangioma [J]. N Engl J Med, 2015, 372(8):735-746.
[3] Drolet BA, Frommelt PC, Chamlin SL, et al. Initiation and use of propranolol for infantile hemangioma: report of a consensus conference [J]. Pediatrics, 2013, 131(1):128-140.
[4] Ábarzúa-Araya A, Navarrete-Dechent CP, Heusser F, et al. Atenolol versus propranolol for the treatment of infantile hemangiomas: a randomized controlled study [J]. J Am Acad Dermatol,2014, 70(6):1045-1049.
[5] Blanchet C, Nicollas R, Bigorre M, et al. Management of infantile subglottic hemangioma: acebutolol or propranolol? [J]. Int J Pediatr Otorhinolaryngol,2010, 74(8):959-961.
[6] Tawfik AA, Alsharnoubi J. Topical timolol solution versus laser in treatment of infantile hemangioma: A comparative study [J]. Pediatr Dermatol, 2015 Mar 5. doi: 10.1111/pde.12542.
[7] 李丽, 马琳. 普萘洛尔治疗婴儿血管瘤临床应用进展 [J]. 实用皮肤病学杂志, 2014, 7(5):361-363.
[8] Chim H, Armijo BS, Miller E, et al. Propranolol induces regression of hemangioma cells through HIF-1α-mediated inhibition of VEGF-A [J]. Ann Surg, 2012, 256(1):146-156.
[9] Tazi KA, Barrière E, Moreau R, et al. Role of shear stress in aortic eNOS up-regulation in rats with biliary cirrhosis [J]. Gastroenterology, 2002, 122(7):1869-1877.
[10] Lamy S, Lachambre MP, Lord-Dufour S, et al. Propranolol suppresses angiogenesis in vitro:Inhibition of proliferation, migration,and differentiation of endothelial cells [J]. Vascul Pharmacol, 2010, 53(5-6):200-208.
[11] Semkova K, Kazandjieva J. Topical timolol maleate for treatment of infantile haemangiomas: preliminary results of a prospective study [J]. Clin Exp Dermatol, 2013, 38(2):143-146.
[12] Chambers CB, Katowitz WR, Katowitz JA, et al. A controlled study of topical 0.25% timolol maleate gel for the treatment of cutaneous infantile capillary hemangiomas[J]. Ophthal Plast Reconstr Surg, 2012, 28(2): 103-106.
[13] Chan H, McKay C, Adams S, et al. RCT of timolol maleate gel for superficial infantile hemangiomas in 5- to 24-week-olds[J]. Pediatrics, 2013, 131(6):e1739-1747.
[14] 吉毅, 肖现民, 李凯, 等. 普萘洛尔对婴幼儿血管瘤内皮细胞增殖与凋亡的作用 [J]. 中华小儿外科杂志, 2013, 34(1):1-6.
[15] 杨舟, 李丽, 徐子刚, 等. 普萘洛尔治疗婴儿血管瘤的临床疗效及安全性 [J]. 中华皮肤科杂志, 2012, 45(7):466-469.
(本文编辑 耿建丽)
The effect of β-blockers on proliferation and apoptosis of human umbilical vein endothelial cells in vitro culture
LI Li,WEI Li,MA Lin
Department of Dermatology, Beijing Children’s Hospital, Capital Medical University, Beijing 100045, China
Objective To observe the influence of propranolol, atenolol, acebutolol and timolol on the proliferation and apoptosis of human umbilical vein endothelial cells in vitro culture. Methods Human umbilical vein endothelial cells were cultured in vitro. Four kinds of the drugs, each with 9 different concentrations and the negative and positive control were added. Cell counting Kit-8 (CCK-8) method was used to detect cell proliferation and annexin-V FITC/PI double staining method was used to detect cell apoptosis. Results The inhibition rate between different drug concentrations of one drug: all concentrations of propranolol and atenolol presented significant difference (P<0.05) of the inhibition rate between each other. With the concentrations of 3.125 μmol/L and 12.5 μmol/L, 12.5 μmol/L and 50 μmol/L of acebutolol and timolol both presented significant difference (P<0.05) of the inhibition rate between each other. The other concentrations of acebutolol and timolol both presented no significant difference (P<0.05) of the inhibition rate between each other. Inhibition rates between different drugs of the same concentration: with the concentrations of 200 μmol/L, 100 μmol/L and 50 μmol/L, inhibition rates of propranolol group was significantly higher than that of atenolol group, acebutolol group and timolol group (P<0.05), the inhibition rates of atenolol group, acebutolol group and timolol group had no significantly differences between each other (P>0.05). With the concentrations of 25 μmol/L, inhibition rates of propranolol group was significantly higher than that of acebutolol group (P<0.05), other drug groups had no significant differences between each other (P>0.05). With the concentrations of 12.5 μmol/L, 6.25 μmol/L, 3.125 μmol/L, 1.5625 μmol/L and 0.7813 μmol/L, inhibition rates of propranolol group, atenolol group, acebutolol group and timolol group had no significant differences between
R732.23
A
1674-1293(2015)06-0411-04
10.11786/sypfbxzz.1674-1293.20150603
100045 北京,首都医科大学附属北京儿童医院皮肤科(李丽,尉莉,马琳)
李丽,主治医师,研究方向:婴儿血管瘤及血管畸形的临床及基础研究,E-mail: luckylili@126.com通讯作者:马琳,E-mail: bch_maleen@aliyun.comeach other (P>0.05). The apoptosis rate of human umbilical vein endothelial cells: the apoptosis rate of propranolol group and atenolol group were both significantly higher than that of negative group (P<0.05); the apoptosis rate of propranolol group, atenolol group, acebutolol group and timolol group were all significantly higher than that of cobalt dichloride group (P<0.05); the apoptosis rate of propranolol group, atenolol group, acebutolol group and timolol group had no significant differences between each other (P>0.05). Conclusion Four kinds of β-blockers can inhibit human umbilical vein endothelial cells proliferation, propranolol has the strongest effect, the higher concentration, the better effect. Four kinds of β-blockers can induce human umbilical vein endothelial cells apoptosis, however, there were no significantly differences between each other.
2015-07-20
2015-09-26)
