帕拉米韦分子的密度泛函理论研究
2015-05-17焉炳飞肖翠平李文佐程建波
焉炳飞,肖翠平,李文佐,程建波
(烟台大学化学化工学院,山东 烟台 264005)
近年来,在世界范围内频繁暴发高致病性禽流感,给家禽养殖业造成巨大经济损失.自从1997年在香港发现人类也会感染禽流感之后,此病症引起全世界卫生组织的高度关注.由于禽流感中间宿主较多,而且具有易变异、易传播、高发病率和高死亡率等特点,其预防和治疗难度较大.神经氨酸酶(neuraminidase,NA)具有唾液酸酶活性,在流感病毒的复制、感染以及致病过程中起到至关重要的作用.因此,抑制流感病毒的NA活性即可有效地控制流感病毒在宿主体内的复制以及病毒的传播[1-6].
帕拉米韦(Peramivir),又名 RWJ2270201或BCX-1812,是继扎那米韦(Zanamivir)和奥司他韦(Oseltamivir)研发成功后又一新型流感病毒NA抑制剂,是一种以禽流感病毒表面糖蛋白NA为作用靶点的新颖的环戊烷类抗流感病毒药物.临床试验[7-19]证明对甲型和乙型流感有效,对各亚型流感病毒有广谱的有效性,并且具有低耐药性、良好的患者耐受性等优点.根据世界卫生组织通报,H7N9属于甲型流感病毒亚型,初步试验结果显示[16-19],神经氨酸酶抑制剂或许会对该病毒起作用.为进一步加深对帕拉米韦药性的理解,最近我们应用量子化学方法研究了该分子的空间结构和电子结构性质,以期为研究该类化合物的结构与活性关系提供理论依据,同时也为药物设计提供必要的理化性质参数.
1 计算方法
密度泛函理论是研究分子结构和性质的有效方法[20-24].本工作应用密度泛函理论的B3LYP(Becke’s three-parameter hybrid functional with the non-local correlation of Lee-Yang-Parr)[25-26]方法对其进行全参数优化,优化时采用6-311+G(d,p)[27]基组.在优化构型的基础上用相同的方法进行简正振动分析,同时进行自然键轨道(NBO)分析并计算前线分子轨道能.溶液中的相关计算采用PCM(polarized continuum model)模型[28-30],选用的溶剂是H2O.所有计算采用Gaussian 09程序[31].
2 结果和讨论
2.1 分子几何构型
B3LYP/6-311+G(d,p)计算的帕拉米韦分子的几何构型见图1(a),帕拉米韦的主要结构参数列于表1.计算结果表明,帕拉米韦分子属于C1点群.该分子中五元环不在同一平面上,C16—N11和C16O18的键长分别是0.136 nm和0.123 nm,而孤立的C—N单键、C16O18双键键长分别为0.147 nm 和 0.127 nm[32],这表明 C16—N11与 C16O18之间存在着离域效应;C21N23键长为0.128 nm,比孤立的 CN键长0.001 nm;C21—N22和 C21—N9键长分别为0.140 nm和0.139 nm,比孤立的C—N键分别短0.007 nm和0.008 nm.
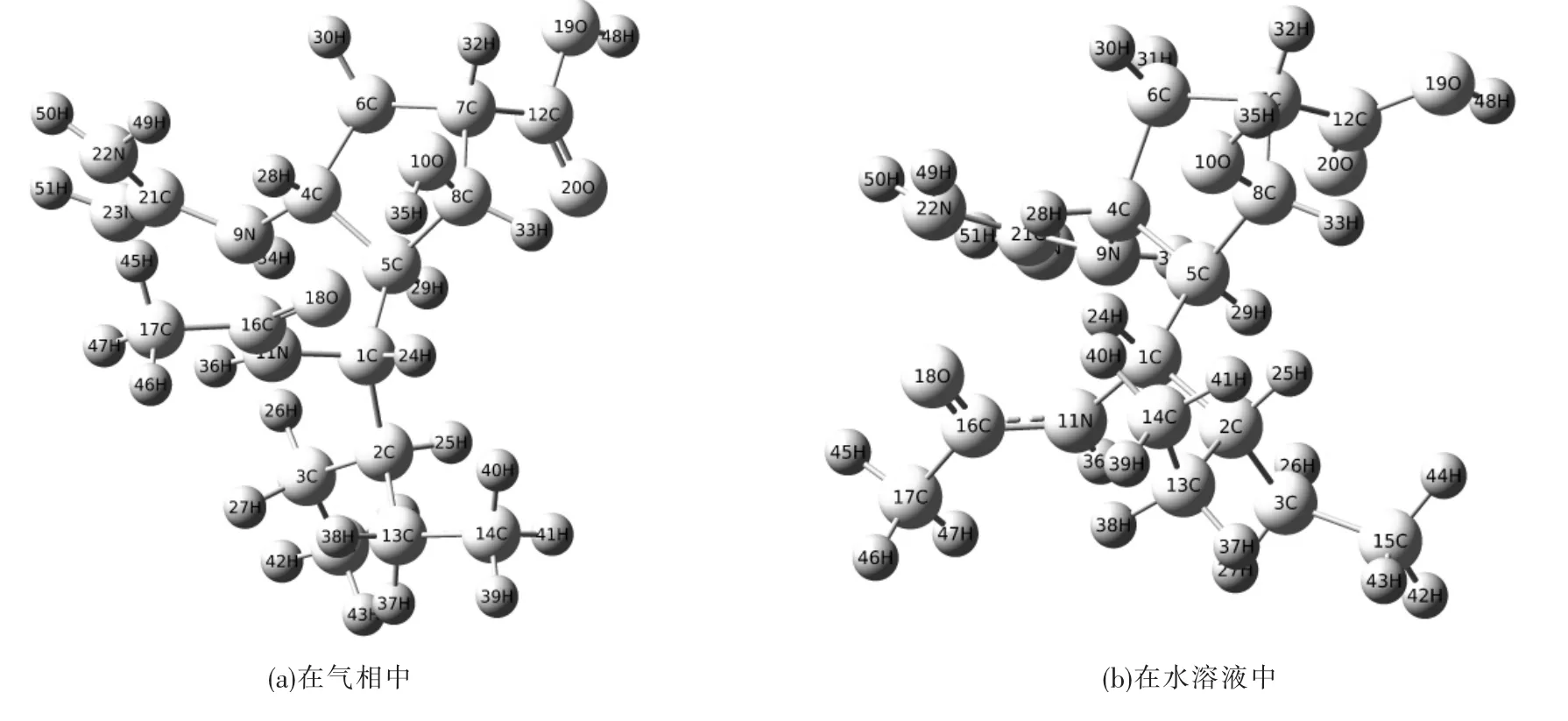
图1 在B3LYP/6-311+G(d,p)水平上计算的帕拉米韦分子的几何构型Fig.1 Geometric configuration of peramivir at the B3LYP/6-311+G(d,p)level

表1 在B3LYP/6-311+G(d,p)水平上计算的帕拉米韦分子中的键长,键角及二面角Tab.1 The B3LYP/6-311+G(d,p)calculated bond lengths,bond angles and dihedral angles of peramivir
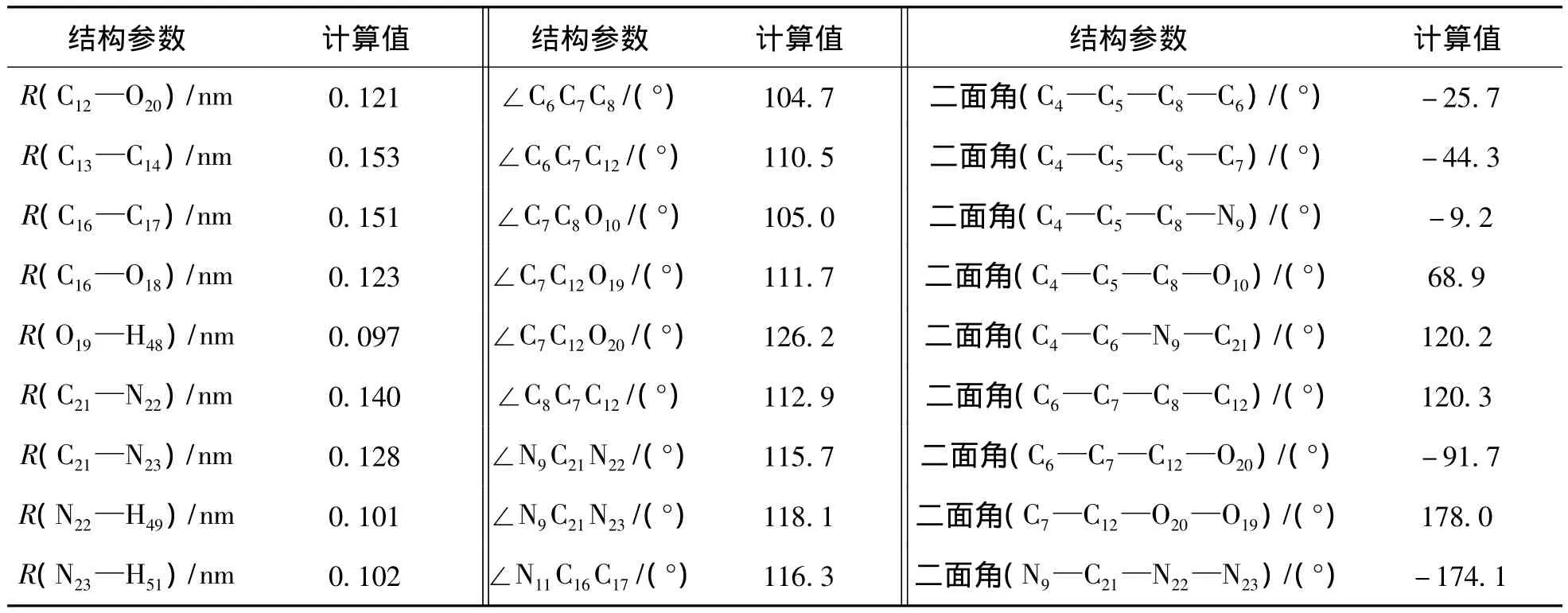
续表1
2.2 分子电荷分布
药理学研究表明[32-34],当受体受到一种药物分子的作用时,必须要通过两者之间电子的相互作用来发挥药效,分析药物分子内的电荷分布可以揭示其与受体的作用点.图2显示了用NBO方法计算得到的电荷分布情况.N22原子带有最高的负电荷 (0.834e), O10(0.778e)、N23(0.773e) 、O19(0.687e)、O18(0.680e)、N9(0.669e)、N11(0.636e)、O20(0.615e)原子都带有较多负电荷,说明 N22、O10、N23、O19、O18、N9、N11和 O20原子都具有较强的亲核活性,可以作为氢键的受体,是起到关键药效作用基团的活性部位.

图2 帕拉米韦的电荷分布Fig.2 Charge populations of peramivir
2.3 前线分子轨道特征
1952年日本化学家福井谦一提出前线分子轨道理论,能量最高的电子占有轨道(HOMO)和能量最低的电子未占轨道(LUMO),统称为前线分子轨道.从HOMO可以看出一个分子捐赠电子的能力,而从LUMO可以看到分子获得电子的能力.图3显示了帕拉米韦分子最高占据轨道和最低空轨道的分布及其能量.

图3 帕拉米韦的最高占据轨道和最低空轨道Fig.3 The HOMO and LUMO orbitals of peramivir
计算表明帕拉米韦分子共有89个占据轨道,则第89个占据轨道为HOMO,第90个为LUMO,其轨道能量分别为-8.98 eV和-3.07 eV,能隙差为5.91 eV.从图3中可看出,HOMO在C21—N23及N9—H34键上电子云相对较密集,表现较强的成键性;LUMO在C12—O20及C16—O18键上电子云相对较密集,表现较强的成键性.
2.4 溶剂化效应
考虑到实验研究都是在溶液环境中进行的,对帕拉米韦的理论研究也应该考虑溶剂效应的影响.由于帕拉米韦为氯化钠注射液制剂,而且其作用环境为体液,所以液相环境下的理论计算所选用的溶剂为H2O,计算模型为PCM模型.在B3LYP/6-311+G(d,p)计算水平下,优化得到了帕拉米韦在水溶液中的几何构型,见图1(b).通过比较发现,在水溶液中的构型与气象中构型相比变化较大:尽管键长变化不超过0.003 nm,但键角变化最大为-83.4°,二面角最大变化为65.7°,说明溶剂效应对构型影响显著.表2给出了帕拉米韦分子在水溶液和气相中主要的结构参数变化值.
2.5 计算模拟的帕拉米韦分子的红外光谱
帕拉米韦分子由51个原子组成的,共有147个基频振动.在B3LYP/6-311+G(d,p)水平上计算模拟了帕拉米韦分子在气相和水溶液中的红外光谱图(图4),这为实验工作者提供理论参考.

表2 帕拉米韦在水溶液与气相中结构参数变化Tab.2 The changes of some structural parameters of peramivir in H2O and in gas phase

图4 在气相和水溶液中模拟的帕拉米韦分子的红外光谱Fig.4 The simulated infrared spectra of peramivir molecule in gas phase and in H2O
3 结论
应用密度泛函理论方法对抗禽流感药物帕拉米韦进行了理论研究,得到了帕拉米韦分子的稳定几何构型.NBO 计算分析表明,N22、O10、N23、O19、O18、N9、N11和O20原子都具有较强的亲核活性,可以作为氢键的受体,是起到关键药效作用基团的活性部位.前线分子轨道分析表明 C21—N23、N9—H34、C12—O20和C16—O18键上电子云相对较密集,表现较强的成键性.以H2O为溶剂研究了溶剂效应对帕拉米韦分子空间结构的影响,比较了水溶液中与气相下帕拉米韦分子结构参数的变化.理论模拟了帕拉米韦分子在气相和水溶液中的红外光谱.本工作为进一步开展帕拉米韦及相关抗流感药物的实验研究提供了有用信息.
[1]Cox N J,Subbarao K.Influenza [J].Lancet,1999,354(9186):1277-1282.
[2]Khare M D,Sharland M.Influenza[J].Expert Opinion on Pharmacotherapy,2000,1(3):367-375.
[3]Takashi Y,Hiroshi B,Manabu N,et al.Efficacy of a single intravenous dose of the neuraminidase inhibitor peramivir in the treatment of equine influenza[J].The Veterinary Journal,2012,193(2):358-362.
[4]Bromba C M,Mason J W,Brant M G,et al.The deguanidinylated derivative of peramivir remains a potent inhibitor of influenza neuraminidase[J].Bioorganic& Medicinal Chemistry Letters,2011,21(23):7137-7141.
[5]顾觉奋.新型抗流感病毒强效神经氨酸酶抑制剂帕拉米韦研究进展[J].中国新药杂志,2013,22(9):989-997.
[6]黄兰,周剑芳,韦红,等.流感病毒神经氨酸酶抑制剂药物耐药现状及机制研究进展[J].病毒学报,2012,28(5):88-92.
[7]Smee D F,Huffman J H,Morrison A C,et al.Cyclopentane neuraminidase inhibitors with potent in vitro anti-influenza virus activities[J].Antimicrobial Agents Chemotherapy,2001,45(3):743-748.
[8]Bania S,Parker C D,Ananth S L,et al.Comparison of the anti-influenza virus activities of RWJ-270201 with those of oseltamivir and zanamivir[J].Antimicrobial Agents Chemotherapy,2001,45(4):1162-1167.
[9]Yugo S,Reiko S,Isamu S,et al.Clinical effectiveness of neuraminidase inhibitors—oseltamivir,zanamivir,laninamivir,and peramivir—for treatment of influenza A(H3N2)and A(H1N1)pdm09 infection:an observational study in the 2010-2011 influenza season in Japan[J].J Infect Chemother,2012,18(6):858-864.
[10]Kitano M,Kodama M,Itoh Y,et al.Efficacy of Repeated intravenous injection of peramivir against influenza A(H1N1)2009 virus infection in immunosuppressed mice [J].Antimicrobial Agents And Chemotherapy,2013,57(5):2286-2294.
[11]Shobugawa Y,Saito R,Sato I,et al.Clinical effectiveness of neuraminidase inhibitors—oseltamivir,zanamivir,laninamivir,and peramivir—for treatment of influenza A(H3N2)and A(H1N1)pdm09 infection:an observational study in the 2010-2011 influenza season in Japan[J].Journal of Infection and Chemotherapy,2012,18(6):858-864.
[12]Louie J K,Yang S,Yen C,et al.Use of intravenous peramivir for treatment of severe influenza A(H1N1)pdm09[J].Plos One,2012,7(6):1-5.
[13]Shetty A K,Peek L A.Peramivir for the treatment of influenza[J].Expert Review of Anti-infective Therapy,2012,10(2):123-143.
[14]李健猴,凌芳芳,杜金燕,等.黄岑苷联合帕拉米韦体内外抗甲型H1N1流感病毒作用[J].中国药理学通报,2013,29(5):617-621.
[15]陈建新,陈良柱,刘雅红,等.神经氨酸酶抑制剂帕拉米韦的合成及其抗禽流感病毒药效[J].中国抗生素杂志,2009,34(8):475-478.
[16]赵丽嘉,王利华,胡雅萍,等.A/B型流感病毒治疗药物—帕拉米韦水合物(Peramivir hydrate)[J].药物评价研究,2010,33(5):400-406.
[17]赵侠,周颖,路敏,等.帕拉米韦三水化合物氯化钠注射液在健康人体的耐药性研究[J].中国新药杂志,2010,19(21):1964-1966.
[18]吴红月.帕拉米韦氯化钠注射液临床使用起效快[N].科技日报,2013-04-11(009).
[19]乔宁.帕拉米韦疗效有待临床观察[N].健康报,2013-04-15(002).
[20]侯一鹏,景波,王海静,等.O2在M2-(M=Au,Ag,Cu,Pt)系列团簇上的吸附行为研究[J].烟台大学学报:自然科学与工程版,2011,24(2):107-111.
[21]薛光法,孙吉祥,李文佐,等.Aun(n=1-6)团簇的密度泛函理论研究[J].烟台大学学报:自然科学与工程版,2008,21(4):261-265.
[22]肖翠平,程建波,李文佐,等.二氯代丁二烯的内旋转[J].烟台大学学报:自然科学与工程版,2010,23(3):183-187.
[23]谭海娜,肖翠平,李文佐.不饱和类锗烯H2C=GeLiBr的理论研究[J].烟台大学学报:自然科学与工程版,2009,22(2):113-116.
[24]裴玉微,王媚,李文佐,等.几种醇阳离子的密度泛函理论研究[J].烟台大学学报:自然科学与工程版,2012,25(3):170-173.
[25]Becke A D.Density-functional thermochemistry,III:The role of exact exchange[J].J Chem Phys 1993,98(7):5648-5652.
[26]Lee C,Yang W,Parr R G.Development of the collesalvetti correlation-energy formula into a functional of the electron-density[J].Phys Rev B 1988,37(2):785-789.
[27]Hehre W J,Radom L,Schleyer P R,et al.Ab Initio Molecular Orbital Theory[M].New York:Wiley,1986.
[28]Mennucci B,Tomasi J.Continuum solvation models:A new approach to the problem of solute’s charge distribution and cavity boundaries[J].Chem Phys,1997,106(12):5151-5158.
[29]Cancès M T,Mennucci B,Tomasi J.A new integral equation formalism for the polarizable continuum model:Theoretical background and applications to isotropic and anisotropic dielectrics[J].Chem Phys,1997,107(8):3032-3041.
[30]Cossi M,Barone V,Mennucci B,et al.Ab initio study of ionic solutions by a polarizable continuum dielectric model[J].Chem Phys Lett,1998,286(3 -4):253-260.
[31]Frisch M J,Trucks G W,Schlegel H B,et al.Gaussian 09[CP].Wallingford:Gaussian Inc.
[32]陈虹,陈冀胜,丁晓琴,等.密度泛函方法研究辣椒碱分子的结构和性质[J].计算机与应用化学,2009,26(5):529-533.
[33]吕振波,庄丽宏,田彦文,等.黄酮类化合物的密度泛函理论研究[J].分子科学学报,2007,23(5):354-357.
[34]梁瑞玲,袁金伟,屈凌波.喜树碱电子结构与抗肿瘤活性关系的密度泛函理论研究[J].中医学报,2011,26(3):262-264.
