巨噬细胞浸润与钙化性主动脉瓣狭窄关系的研究
2015-05-16刘聪,谢霆
刘 聪, 谢 霆
1华中科技大学同济医学院附属协和医院超声科,武汉 430022
2海南省人民医院心脏外科,海口 571000
长期以来,钙化性主动脉瓣狭窄(calcific aortic valve stenosis,CAVS)被视为与年龄老化相关的被动的退行性改变。近年来,随着研究的深入,CAVS更倾向于是一个主动的并渐进性的炎症钙化过程[1]。CAVS是一种后天获得的常见心脏瓣膜病,随着我国老龄化社会的到来,临床实践表明CAVS发病率升高是不争的事实。CAVS特点是广泛的主动脉瓣钙化和炎性细胞浸润导致瓣膜狭窄,引起患者血流动力学障碍,出现胸痛、心脏衰竭、晕厥等。目前已有研究表明CAVS患者存在巨噬细胞浸润[2-3],但尚不清楚巨噬细胞浸润与 CAVS患者瓣膜狭窄程度的关系。
1 资料与方法
1.1 研究对象
收集2012年9月至2014年3月在海南省人民医院心脏外科因CAVS行手术切除的严重钙化主动脉瓣标本80例[男40例,女40例,年龄(58±6)岁],另外取因夹层动脉瘤行手术切除的正常主动脉瓣标本7例[男4例,女3例,年龄(41±8)岁],选择80例健康成人作为对照组,同时收集患者的临床基本资料,包括心血管疾病的危险因素高血压、高脂血症、糖尿病,以及患者超声心动图的测量值:主动脉瓣口面积、最大血流速度、最大压力阶差。排除标准包括:排除先天性主动脉瓣畸形、风湿性心脏瓣膜病、感染性心内膜炎和马凡综合征,同时排除甲状旁腺疾病和肾功能衰竭等影响钙磷代谢的全身性疾病。所有组织标本均根据《赫尔辛基宣言》经患者及家属知情同意后采集,研究方案获医院伦理委员会批准。
1.2 方法
1.2.1 标本处理 标本经10%中性甲醛固定,常规脱水、石蜡包埋、5μm连续切片。选取代表性的蜡块用于免疫组织化学分析,为了更好地保存抗原,在切片前标本不脱钙。
1.2.2 病理学观察 常规苏木精-伊红(HE)染色,显微镜下观察瓣膜的厚度、组织结构、细胞的组成和钙化的部位以及钙化灶周围的改变。
1.2.3 免疫组织化学染色(IHC)和判断标准 兔抗人CD68单克隆抗体(PGM1)购自武汉博士德生物技术有限公司,购买回来后按1∶100稀释,采用PV-9000通用型二步法试剂盒,具体操作按试剂盒操作说明。组织学和免疫组化的染色结果判断:出现棕黄色且高出背景色为阳性。免疫组化分级:根据阳性细胞计数半定量评估,任选4个高倍视野,根据细胞中阳性细胞比例分为4级。0级:<10%的细胞呈现免疫反应阳性;1级:<25%的细胞为免疫反应阳性;2级:25%~50%的细胞为免疫反应阳性;3级:>50%的细胞呈现免疫反应阳性。
1.2.4 巨噬细胞密度与主动脉瓣狭窄程度相关性分析 IPP(Image-Pro Plus)软件测量图片中细胞密度,超声心动图对主动脉瓣狭窄的诊断标准:轻度狭窄时压力阶差峰值和平均压力阶差分别为5~30 mmHg和4~20mmHg,中度狭窄时压力阶差峰值和平均压力阶差分别为30~60mmHg和20~50 mmHg,重度狭窄时分别为>60mmHg和>50 mmHg。同一标本选取细胞最大密度值与超声心动图的测量值进行相关性分析。
1.3 统计学方法
采用SPSS 13.0统计软件分析数据,计量资料以均数±标准差(±s)表示,计数资料用百分比(%)表示,组间均数比较采用单因素方差分析,Pearson法分析巨噬细胞浸润与CAVS程度的关系,以P<0.05为差异有统计学意义。
2 结果
2.1 临床基本资料
临床资料分析表明CAVS患者较成人健康志愿者年龄、体重指数、空腹血糖、收缩压、总甘油三脂、总胆固醇、低密度脂蛋白、C反应蛋白高,而高密度脂蛋白较低,两者间差异均有有统计学意义(表1)。
表1 CAVS组与对照组临床、生化资料比较(±s,n=80)Table 1 Comparison of clinical and biochemical data(±s,n=80)

表1 CAVS组与对照组临床、生化资料比较(±s,n=80)Table 1 Comparison of clinical and biochemical data(±s,n=80)
与对照组比较,*P<0.05
组别 年龄(岁)体重指数(kg/m2)空腹血糖(mmol/L)收缩压(mmHg)总甘油三脂(mmol/L)总胆固醇(mmol/L)高密度脂蛋白(mmol/L)低密度脂蛋白(mmol/L)C反应蛋白(mg/L)CAVS组58.3±6.2*28.10±5.30*6.43±0.41*139.51±1.53* 2.07±0.15* 5.18±0.37* 1.04±0.12* 3.37±0.13* 6.55±0.41*对照组 29.3±4.3 23.40±1.38 5.38±0.30 115.60±6.52 1.24±0.16 3.98±0.22 1.36±0.09 3.13±0.09 3.73±0.18
2.2 瓣膜标本肉眼观察
正常的瓣膜呈半透明状,柔韧性好。CAVS患者瓣膜可见不同程度累及瓣膜的基底部、中间部和瓣尖整体的钙化,表现为瓣口的狭窄和瓣膜明显增厚、坚硬。
2.3 HE染色结果
正常的瓣膜主要由5层构成,依次为:主动脉侧的内皮层、富含胶原纤维的胶原层、致密基质较少并排列疏松的松质层、有明显弹力纤维的心室层和心室侧的内皮层。正常的瓣膜纤维排列整齐,无血管,无炎性细胞浸润(图1A);退行性病变的瓣膜较正常瓣膜厚,结节性钙化灶存在瓣膜松质层中,钙化灶周围纤维组织排列紊乱,瓣膜失去原有的结构,新生血管形成,出现泡沫细胞和脂肪细胞(图1B、C)。
2.4 CD68免疫组织化学染色
CD68免疫组织化学染色:从夹层主动脉瘤取得的正常瓣膜未见巨噬细胞标记抗原CD68(图1 D),80例CAVS瓣膜均可见CD68浸润,部分表现为泡沫样细胞,且主要分布在瓣膜钙化灶及骨样组织周围,以2级、3级表达为主(图1E、F)。
2.5 巨噬细胞密度与瓣膜狭窄相关性分析
CAVS患者主动脉瓣压力阶差峰值(80.30±22.87)mmHg,平均压力阶差 (65.11±20.15)mmHg,瓣口流速(4.62±2.78)m/s,瓣口面积(0.71±0.14)cm2。IPP(Image-Pro Plus)软件测量图片中细胞密度在CAVS患者分布幅度较大为3~29/mm2,线性回归分析表明巨噬细胞最大密度值与压力阶差峰值(r=0.75,P<0.05)、平均压力阶差(r=0.75,P<0.05)、主动脉瓣口流速峰值(r=0.72,P<0.05)呈正相关,而与瓣口面积呈负相关(r=-0.71,P<0.05)(图2)。
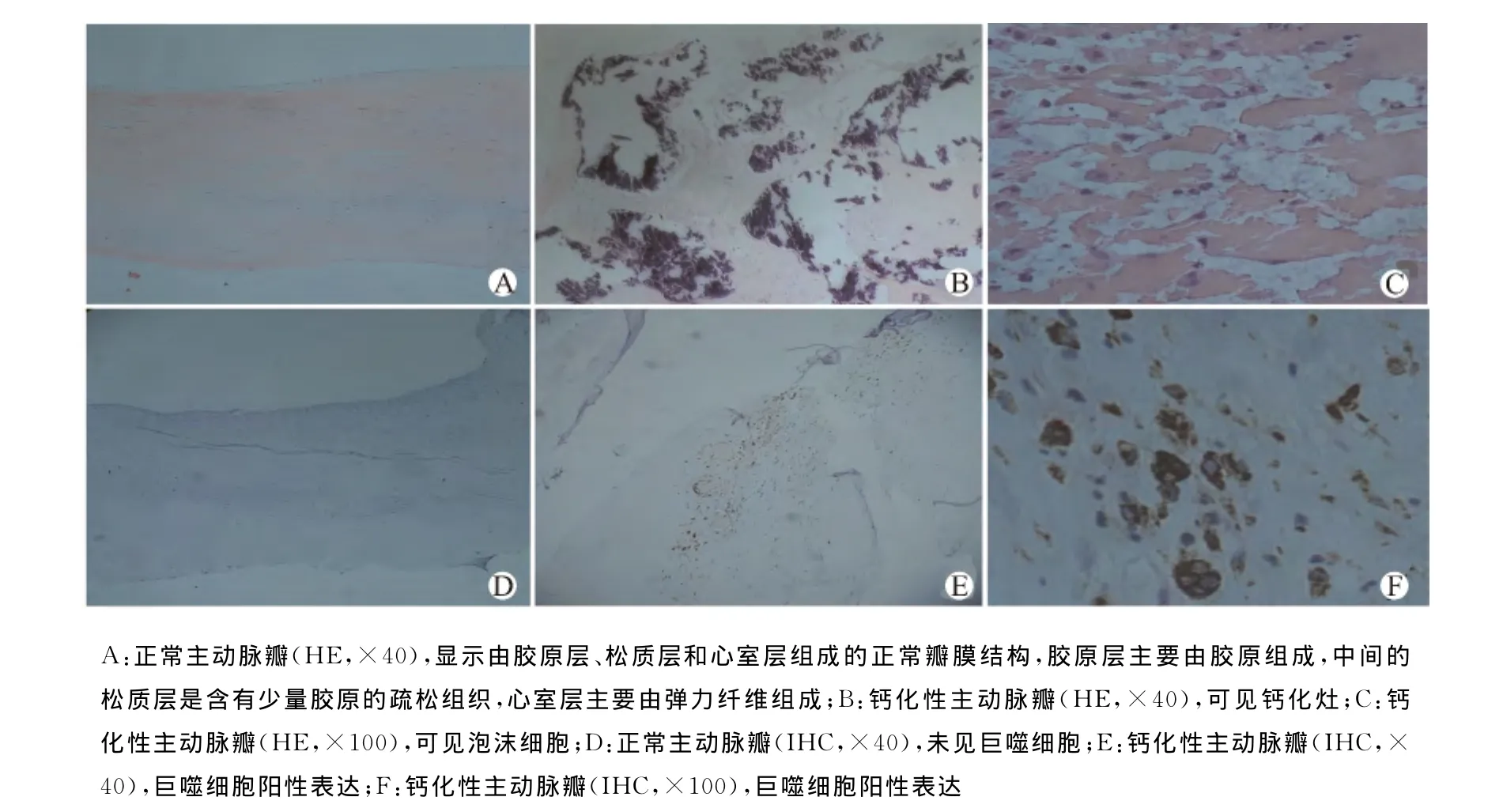
图1 正常和CAVS主动脉瓣组织切片图Fig.1 Sections of normal and CAVS aortic valve tissues
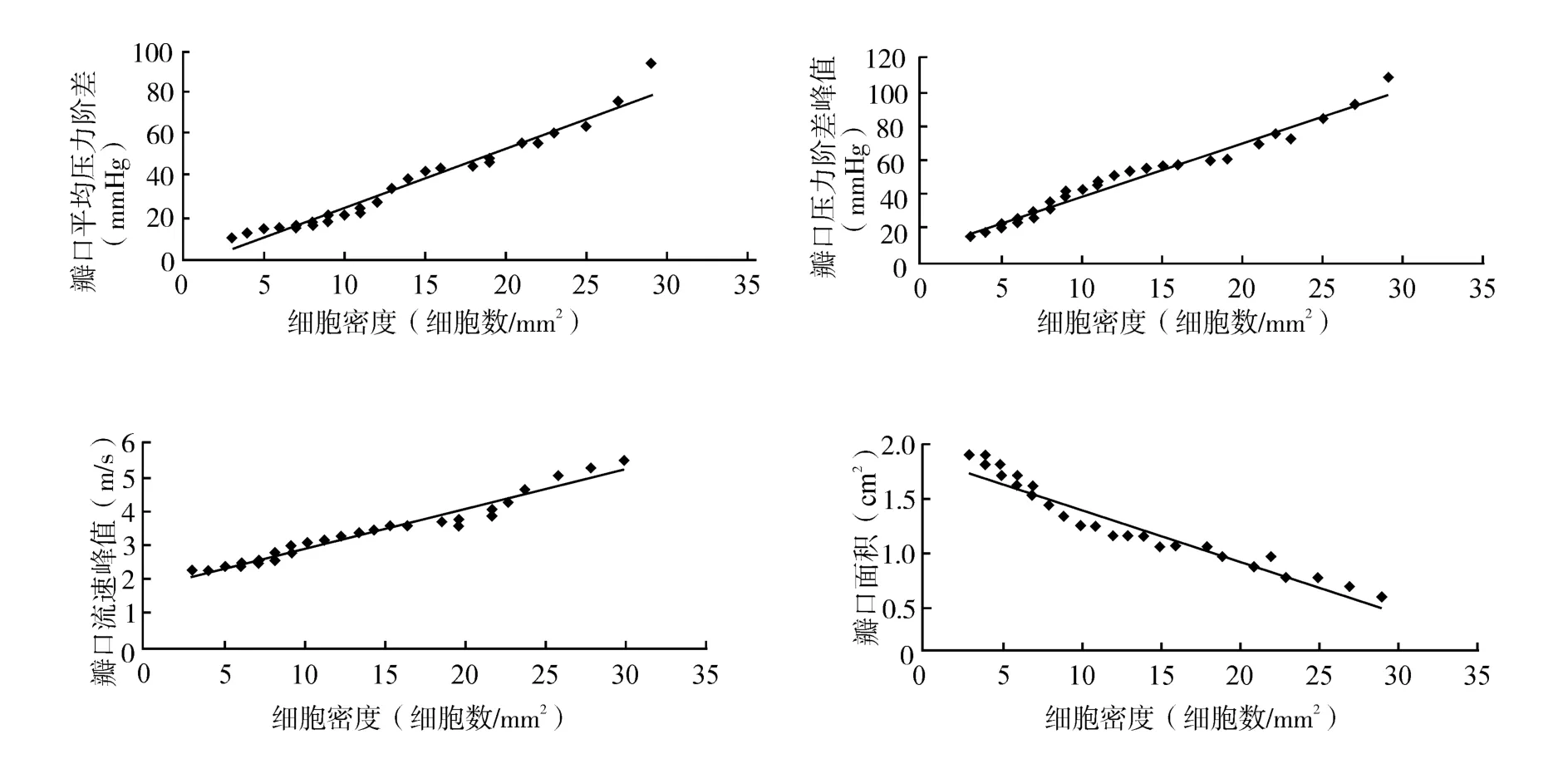
图2 巨噬细胞密度与瓣膜狭窄程度的相关性分析Fig.2 Correlation between density of macrophages and degree of valve stenosis
3 讨论
CAVS是发达国家主动脉瓣置换的最常见原因,发病率仅次于冠心病和高血压,年龄、性别、吸烟、高胆固醇、高血压,2型糖尿病是主动脉瓣退行性钙化狭窄的危险因素,大于65岁的人群中,2%的人患有主动脉瓣退行性钙化狭窄,需要手术干预[4-5]。随着我国老龄化社会的到来,临床实践表明CAVS发病率升高是不争的事实。最近几年CAVS被视为与胆固醇蓄积相关的慢性炎症过程,与动脉粥样硬化有很多相似之处,如:内皮损伤、内皮下积累的脂蛋白的氧化、炎性细胞浸润,最终钙化形成[6-8]。我们研究也发现:与健康成人志愿者比较,CAVS患者血液中胆固醇和C反应蛋白浓度升高,这提示CAVS可能是与胆固醇蓄积相关的慢性炎症性疾病,既往文献也证明CAVS与血液C反应蛋白水平相关[9]。
另外我们研究发现CAVS瓣膜存在炎性细胞浸润,新生血管形成,脂质斑块沉积和钙化以及骨样组织形成的同时,在钙化灶和骨样组织周围见到大量巨噬细胞浸润。但Otto等[3]在CAVS瓣膜不仅发现钙化灶周围区域有大量巨噬细胞,且在尸检正常瓣膜时发现内皮下也有巨噬细胞浸润。而我们正常标本在检测中并未发现内皮下有巨噬细胞浸润,这可能与我们选择的对照组年龄较小有关系。
在炎症过程中巨噬细胞吞噬异常物质和凋亡细胞,残余的细胞基质结合钙离子形成钙化灶。电镜扫描发现:人的主动脉瓣内可看到钙化的大泡状结构,这种大泡状体形态较复杂,直径约几微米,通常为圆形或椭圆形,壁厚0.05~0.1μm,呈絮状、皱褶状。染色可见大泡的周围有小球状颗粒,这些颗粒可能是蛋白聚糖,大泡状体中常含有卫星样小泡,后者呈针状结晶,从这些形态学特征推测,大泡状体是膜磷脂与沉积的蛋白聚糖相互反应的产物。基质小泡常先于主动脉钙化出现,刀豆球蛋白促进钙、磷沉积和基质小泡形成[10]。另外研究表明巨噬细胞分泌的炎症因子诱导间质细胞向骨样细胞转化,单核/巨噬细胞与血管间质细胞共培养,可增加间质细胞向骨样细胞转化,巨噬细胞转化为泡沫细胞的同时能够促进骨分化标志蛋白碱性磷酸酶增加,间质细胞向骨样细胞转化更增加了钙化[11]。
遗憾的是目前巨噬细胞与钙化的研究主要是针对血管钙化,对巨噬细胞在瓣膜钙化中的作用知之甚少,我们目前仅看到1篇文献关于巨噬细胞与瓣膜的研究。Wada等[2]对老年退行性心脏钙化瓣膜标本形态分析表明,与正常瓣膜比较,巨噬细胞的阳性面积百分比和新发微血管密度增高,这与我们研究类似。我们研究证实巨噬细胞密度与CAVS程度密切相关,巨噬细胞最大密度值与压力阶差峰值、平均压力阶差、主动脉瓣口流速峰值呈正相关,而与瓣口面积呈负相关。
总之,我们发现CAVS可能是与高胆固醇相关的慢性炎症性疾病,巨噬细胞密度与CAVS程度密切相关,表明巨噬细胞参与CAVS的进展,巨噬细胞可能是一个抑制钙化性瓣膜发展的潜在治疗靶点。
[1] 应晨,杨震坤,张凤如.钙化性主动脉瓣疾病的发病机制[J].国际心血管病杂志,2012,39(5):260-262.
[2] Wada S,Sugioka K,Naruko T,et al.Relationship between oxidative stress and aortic valve stenosis in humans:an immunohistochemical study[J].Osaka City Med J,2013,59(2):61-67.
[3] Otto C M,Kuusisto J,Reichenbach D D,et al.Characterization of the early lesion of‘degenerative’valvular aortic stenosis.Histological and immunohistochemical studies[J].Circulation,1994,90(2):844-853.
[4] Katz R,Wong N D,Kronmal R,et al.Features of the metabolic syndrome and diabetes mellitus as predictors of aortic valve calcification in the multi-ethnic study of atherosclerosis[J].Circulation,2006,113(17):2113-2119.
[5] Lloyd-Jones D,Adams R,Carnethon M,et al.Heart disease and stroke statistics--2009update:a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee[J].Circulation,2009,119(3):480-486.
[6] Towler D A.Molecular and cellular aspects of calcific aortic valve disease[J].Circ Res,2013,113(2):198-208.
[7] Otto C M.Calcific aortic stenosis--time to look more closely at the valve[J].N Engl J Med,2008,359(13):1395-1398.
[8] Leopold J A.Cellular mechanisms of aortic valve calcification[J].Circ Cardiovasc Interv,2012,5(4):605-614.
[9] Galante A,Pietroiusti A,Vellini M,et al.C-reactive protein is increased in patients with degenerative aortic valvular stenosis[J].J Am Coll Cardiol,2001,38(4):1078-1082.
[10] 张宝红,杜军保,唐朝枢.血管钙化的调节机制[J].心血管病学进展,2003,24(3):179-182.
[11] Tintut Y,Patel J,Territo M,et al.Monocyte/macrophage regulation of vascular calcificationinvitro[J].Circulation,2002,105(5):650-655.
