复方高渗盐溶液对脓毒症大鼠急性肺损伤的影响*
2015-05-16王华兵徐玲文揭凤英
董 芳, 徐 亮, 王华兵, 徐玲文, 揭凤英
武汉市第三医院重症医学科,武汉 430060
目前脓毒症是ICU患者的主要死亡原因之一[1],提高对该病的认识和防治水平无疑具有重要的理论价值及临床意义。相关研究表明,高渗/高胶溶液对失血性休克有治疗作用,且在临床上已有一定 应 用[2-6]。 本 研 究 通 过 盲 肠 结 扎 穿 孔 术 (cecal ligation and puncture,CLP)建立脓毒症大鼠模型,研究复方高渗盐溶液对脓毒症大鼠血浆免疫因子的调控作用,并观察脓毒症时急性肺损伤的相关指标,如动脉血气、BALF中性粒细胞百分比,肺组织MPO活性,并统计各组大鼠生存率,探讨复方高渗盐溶液对脓毒症大鼠急性肺损伤的治疗作用。
1 材料与方法
1.1 实验动物及构建动物模型
雄性 Wistar大鼠133只,10~12周龄,体重230~280g。以3%戊巴比妥钠(30~50mg/kg)腹腔内注射对大鼠实施麻醉。行左侧颈静脉分离置管,经颈静脉置管给药,经颈动脉置管处采集动脉血标本用于监测。采用CLP法制备大鼠脓毒症模型,常规腹部消毒,皮肤正中切口,切口长约2~3cm,打开腹腔,游离肠系膜及盲肠,以3-0丝线环行结扎盲肠根部,用9号针头于盲端部位穿刺2处,两针孔相距约3mm,还纳肠管,保证肠道通路正常,逐层缝合关腹,补充体液丢失,碘伏消毒并包扎伤口。假手术组除不结扎和穿刺盲肠外,其余手术步骤相同。
1.2 实验动物分组
实验动物随机分为4组:SOP组(15只),术毕皮下注射 NS,30mL/kg;CLP组(45只),术毕皮下注射 NS,30mL/kg;CLP+NS组(45只),术毕皮下注射NS,30mL/kg,术后3h自颈静脉内输注NS,5mL/kg,输液速度为 0.4mL/(kg·min);CLP+HSD组(28只),术毕皮下注射 NS,30mL/kg,术后3h自颈静脉内输注 HSD,5mL/kg,输液速度为0.4mL/(kg·min)。各组于手术0、9、18h采集血液标本,每采一次血,均立刻注射同等量的NS。手术后18hCLP组、CLP+NS组、CLP+HSD组分别取部分死亡动物,SOP组处死部分实验动物,取肺组织用于检测。
1.3 动脉血气分析
各组大鼠分别于手术0、9、18h采集动脉血0.2 mL,用便携式血气分析仪(i-STAT,美国Abbott公司)检测血pH,PaO2及PaCO2值。
1.4 各组大鼠生存率
各组大鼠分别于9h和18h统计生存率。
1.5 支气管肺泡灌洗液(BALF)中性粒细胞比例
BALF的收集和细胞分类方法参照Reis等[7]及Callol等[8]研究报道。各组大鼠术后18h计算生存率后,处死部分大鼠,暴露气管肺脏,结扎右支气管,在环状软骨上用血管钳固定气管,其下做横行切口,将7号塑料输液管剪去针头端,留出约10cm长的一段输液软管,将该段输液管的一端插入气管腔后以缝线固定,另一端固定在5mL注射器上。将37℃无菌生理盐水2mL以注射器缓慢注入肺内,间隔30s后回抽,重复3次,共收集支气管肺泡灌洗液5mL。将收集到的支气管肺泡灌洗液以3 000r/min离心10min,取沉淀的细胞进行涂片并行瑞氏染色。油镜下计数100个细胞,按白细胞特征进行分类计数。计算公式为:中性粒细胞百分数(%)=计数中性粒细胞个数/计数总细胞个数×100%。
1.6 肺组织髓过氧化物酶(MPO)活性测定
取部分右肺组织以MPO试剂盒(美国Sigma公司)提供的匀浆介质制成肺组织匀浆,严格按试剂盒说明书步骤要求,测量各管吸光度值,根据说明书提供的公式,计算出MPO活力单位。
1.7 肺组织湿干重比测定
取部分右肺组织称湿重,80℃烘干72h后称干重,计算肺组织湿干重比值。
1.8 肺组织病理改变
CLP组、CLP+NS组、CLP+HSD组于术后18h取部分死亡大鼠(SOP组处死部分大鼠)右肺叶组织标本一小块,置于甲醛液中固定(用10%磷酸缓冲液缓冲,pH值7.4)8h以上,乙醇脱水、石蜡包埋后,切成4μm切片,苏木精-伊红(HE)染色,光镜下观察组织病理学改变。
1.9 统计学方法
用SPSS 12.0统计软件进行分析,数据以均数±标准差(±s)表示,组间均数的比较运用单因素方差分析,运用卡方检验比较各组大鼠生存率的差异,以P<0.05为差异有统计学意义。
2 结果
2.1 各组动物血浆中TNF-α、IL-1β水平测定
SOP组动物血浆中 TNF-α、IL-1β水平在9、18 h均无明显变化,这表明剖腹手术对实验动物的TNF-α、IL-1β的表达无明显影响。CLP组及 CLP+NS组动物血浆TNF-α水平在9h内出现明显升高,在其后的9h内达到高峰。整个实验阶段,CLP+HSD组的血浆TNF-α水平均显著低于CLP组及CLP+NS组,差异有统计学意义(表1)。监测CLP组及CLP+NS组动物的血浆IL-1β值表达水平,9、18h时间点急剧升高达到峰值。而接受HSD治疗的CLP动物组血浆IL-1β水平出现双相变化,9 h和18h时间点该组动物血浆IL-1β水平均显著低于CLP组及CLP+NS组,差异有统计学意义(表1)。
表1 各组大鼠不同时间点TNF-α、IL-1β水平比较(±s)Table 1 Comparison of TNF-αand IL-1βlevels of rats in each group at different time points(±s)
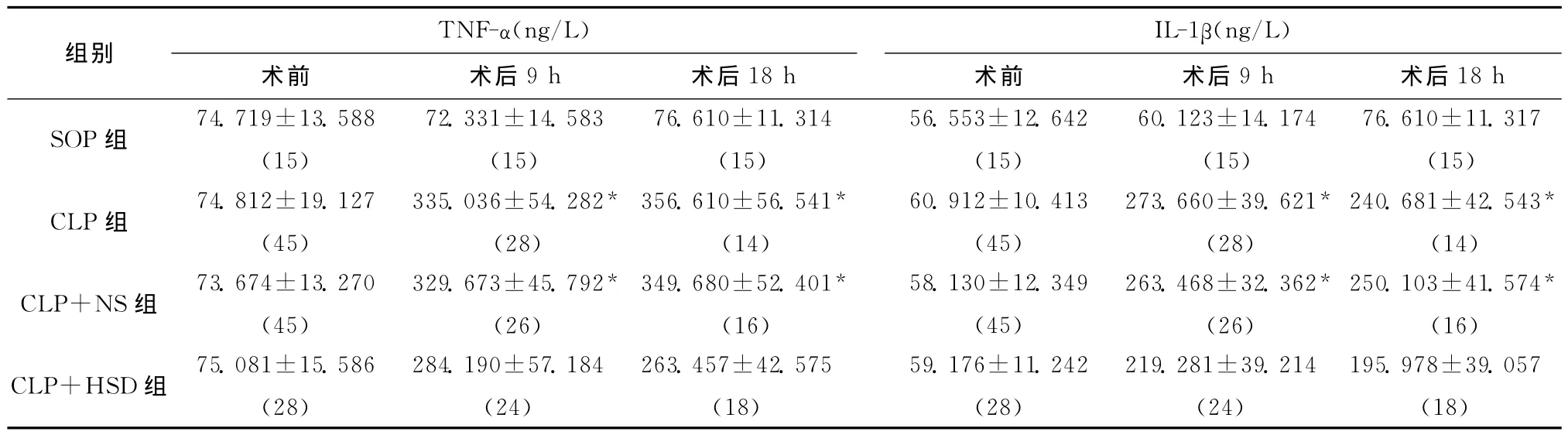
表1 各组大鼠不同时间点TNF-α、IL-1β水平比较(±s)Table 1 Comparison of TNF-αand IL-1βlevels of rats in each group at different time points(±s)
与CLP+HSD组比较,*P<0.05;括号内为动物数
组别 TNF-α(ng/L)IL-1β(ng/L)18h SOP组 74.719±13.588(15)术前 术后9h 术后18h 72.331±14.583(15)术前 术后9h 术后76.610±11.314(15)56.553±12.642(15)60.123±14.174(15)76.610±11.317(15)250.103±41.574*(16)CLP+HSD组 75.081±15.586(28)240.681±42.543*(14)CLP+NS组 73.674±13.270(45)CLP组 74.812±19.127(45)335.036±54.282*(28)356.610±56.541*(14)329.673±45.792*(26)60.912±10.413(45)273.660±39.621*(28)349.680±52.401*(16)284.190±57.184(24)58.130±12.349(45)263.468±32.362*(26)263.457±42.575(18)59.176±11.242(28)219.281±39.214(24)195.978±39.057(18)
2.2 血气分析
动脉血pH值:各组大鼠术后9h动脉血pH值均有轻度下降;术后18hCLP组及CLP+NS组大鼠动脉血pH值持续下降,CLP+HSD组动脉血pH值比CLP组及CLP+NS组有所改善(P<0.05)(表2)。动脉血PaO2:SOP组动脉血PaO2实验期间无明显变化;但CLP组及CLP+NS组大鼠动脉血PaO2在前9h发生了急剧下降,后9h下降速度才逐渐变缓;CLP+HSD组动脉血PaO2下降水平比CLP组及CLP+NS组有明显改善(P<0.05)(表2)。动脉血PaCO2:术后18h内SOP组动脉血PaCO2无显著变化;术后9hCLP组、CLP+NS组及CLP+HSD组各组动脉血PaCO2均轻度上升,但各组之间无明显差异。但术后18hCLP组及CLP+NS组动脉血PaCO2进一步急剧升高,CLP+HSD组动脉血PaCO2升高水平较CLP组及CLP+NS组有明显好转(P<0.05)(表2)。
表2 各组大鼠不同时间点ΔpH、ΔPaO2、ΔPaCO2水平比较(±s)Table 2 Comparison ofΔpH,ΔPaO2andΔPaCO2levels of rats in each group at different time points(±s)
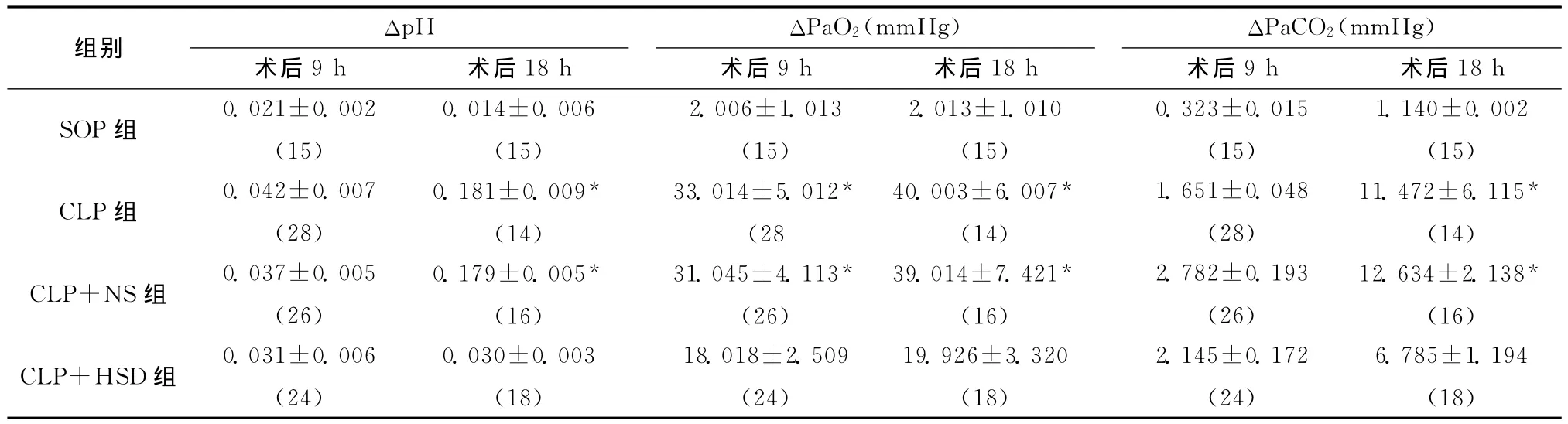
表2 各组大鼠不同时间点ΔpH、ΔPaO2、ΔPaCO2水平比较(±s)Table 2 Comparison ofΔpH,ΔPaO2andΔPaCO2levels of rats in each group at different time points(±s)
与CLP+HSD组比较,*P<0.05;括号内为动物数
组别 ΔpH ΔPaO2(mmHg) ΔPaCO2(mmHg)18h SOP组 0.021±0.002(15)术后9h 术后18h 术后9h 术后18h 0.014±0.006(15)术后9h 术后2.006±1.013(15)2.013±1.010(15)0.323±0.015(15)1.140±0.002(15)12.634±2.138*(16)CLP+HSD组 0.031±0.006(24)11.472±6.115*(14)CLP+NS组 0.037±0.005(26)CLP组 0.042±0.007(28)0.181±0.009*(14)33.014±5.012*(28 0.179±0.005*(16)40.003±6.007*(14)1.651±0.048(28)31.045±4.113*(26)0.030±0.003(18)39.014±7.421*(16)2.782±0.193(26)18.018±2.509(24)19.926±3.320(18)2.145±0.172(24)6.785±1.194(18)
2.3 各组大鼠生存率
SOP组大鼠术后18h内没有发生死亡。CLP组9、18h生存率分别为62.2%、31.1%,比SOP组有显著降低(P<0.05);接受生理盐水治疗的CLP大鼠9、18h生存率也较低,分别为57.8%、35.6%(P<0.05);CLP术后注射 HSD组大鼠9h、18h生存率分别为85.7%、64.3%,比CLP组及CLP+NS组有明显改善(均P<0.05)(表3)。

表3 各组大鼠生存率比较(%)Table 3 Comparison of survival rate of rats in each group(%)
2.4 支气管肺泡灌洗液中性粒细胞比例
CLP组及CLP+NS组大鼠BALF中性粒细胞百分比较SOP组显著升高,接受HSD治疗的大鼠中性粒细胞百分比较CLP组及CLP+NS显著降低(均P<0.05)(图1)。
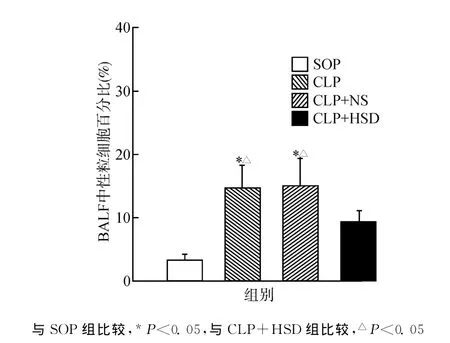
图1 各组大鼠BALF中性粒细胞百分比Fig.1 Neutrophil counts in BALF of rats in each group
2.5 肺组织髓过氧化物酶活性
CLP组及CLP+NS组大鼠肺组织MPO活性比SOP组明显升高,CLP+HSD组肺组织MPO活性比CLP组及CLP+NS组显著减低(均P<0.05)(图2)。

图2 各组大鼠肺组织MPO活性Fig.2 Lung MPO activity of rats in each group
2.6 肺组织湿干重比值
CLP组及CLP+NS组大鼠肺组织湿干重比值较SOP组明显升高,而CLP+HSD组肺组织湿干重比值则与SOP组接近,较CLP组及CLP+NS组有明显改善,差异有统计学意义(均P<0.05)(图3)。

图3 各组大鼠肺组织湿干重比Fig.3 Lung wet/dry weight of rats in each group
2.7 肺组织病理改变
SOP组大鼠肺组织未见明显异常病理改变。CLP组及CLP+NS组肺组织明显水肿、淤血,表现为浸润性炎症改变,肺泡腔渗液;肺间质水肿、增生和变厚,伴大量炎性细胞浸润。与CLP组及CLP+NS组比较,CLP+HSD组大鼠肺组织病理变化减轻,仅可见部分肺泡腔和间质内轻度炎性细胞浸润(图4)。

图4 各组大鼠肺组织病理改变(苏木精-伊红染色,×200)Fig.4 Histopathological changes of lung tissues of rats in each group(hematoxylin-eosin staining,×200)
3 讨论
脓毒症发生时,机体释放大量促炎介质和抗炎介质,多种炎性介质之间相互作用,形成瀑式连锁反应[9],过量炎性介质作用常导致远隔器官功能发生障碍[10]。急性肺损伤(ALI)是脓毒症常见并发症,在大量TNF-α、IL-1β等的刺激下,中性粒细胞聚集于肺内微血管并持续活化,并释放一系列损伤介质,引起弥漫性肺泡损害,最终导致急性肺损伤[11-13]。同时,促炎因子TNF-α是炎症介质瀑式网络级联反应的触发因子,IL-1β位于网络的中心[14],两者在炎症反应综合征(SIRS)中具有重要地位。另外,脓毒症时常伴随微循环障碍,内皮屏障功能丧失[15]。
急性肺损伤本质是因肺泡毛细血管膜弥漫性损伤导致肺水肿和肺微不张,临床表现为呼吸窘迫和顽固性低氧血症的综合征[16]。脓毒症目前标准的液体复苏均选择等渗溶液,如0.9%氯化钠溶液、乳酸林格氏液等,使用等渗液体复苏需要较大剂量才能维持循环,其后果是使得大量液体渗漏入肺组织间隙造成组织水肿,加重微循环障碍所致的肺水肿和肺微不张。本研究发现,CLP术后注射HSD的实验动物肺组织湿干重比有显著改善,且光镜下观察,使用HSD治疗的大鼠肺组织,炎性改变较对照组轻微,仅可见部分肺泡腔和间质内轻度炎性细胞浸润,这可能与HSD渗透压较高,经血管输入HSD后,短时间内使得血管渗透压升高,血管内外产生的渗透压梯度使组织间液、细胞内液向肺微血管内转移,减轻了循环障碍所致的肺水肿和肺微不张。另外,使用高渗透压的HSD只需要较小剂量就可达到上述效果,因此也避免输注大量液体对机体产生不良影响[17]。
本研究显示,使用HSD治疗后的CLP实验动物 TNF-α、IL-1β水平较 CLP组及 CLP+NS组有明显下降,但仍比SOP组高,可见HSD对TNF-α、IL-1β等促炎介质并不是完全抑制,而是在一定程度上减低它们的表达水平,有助于保持全身炎症反应综合征/代偿性抗炎反应(CARS)平衡,这可能是HSD调节脓毒症时免疫紊乱的机制之一。另外,HSD使得TNF-α、IL-1β等促炎介质过度释放得到控制,可能在一定程度上抑制了中性粒细胞在肺内微血管的过度活化,对急性肺损伤起到了一定的治疗作用。最终的BALF中性粒细胞百分比、肺组织MPO、血气结果也证实了使用HSD的大鼠临床指标有一定改善。
大鼠生存率是临床治疗脓毒症的重要目标。CLP+HSD组大鼠在术后9h生存率为85.7%,比CLP及CLP+NS组有明显提高,虽然在术后18h生存率有所下降(64.3%),这可能意味着使用HSD为脓毒症提供了更多的治疗时间,如果在脓毒症早期使用HSD的同时,配合其他综合治疗,后期生存率应该会有进一步提高。
综上所述,HSD可以调节脓毒症造成的免疫紊乱,对脓毒症大鼠出现的循环衰竭有明显改善,能够减轻脓毒症急性肺损伤,对脓毒症治疗有多方面的作用,最终提高了脓毒症大鼠生存率。但由于HSD渗透压较高,输注浓度、输液量、输注时机等有待于进一步临床探讨,且由于高渗透压有可能导致的并发症尚亦需进一步观察。
[1] 林瑾,刘培,庄海舟,等.重症监护病房419例重度脓毒症患者的临床分析[J].中国危重病急救医学,2014,26(3):171-174.
[2] 周其全,刘福玉,高钰琪.不同渗透压不同氧浓度液体对高原失血性休克大鼠复苏效果的对比观察[J].中国危重病急救医学,2008,20(7):393-396.
[3] 张汉生,袁世荧,姚尚龙.乳酸林格氏液、高渗盐水和全血对失血性休克犬血液动力学的影响[J].华中科技大学学报:医学版,2002,31(1):96-98.
[4] 郑国寿,白祥军,占成业,等.高渗盐水对创伤失血性休克兔促炎与抗炎细胞因子和黏附分子表达的影响及其意义[J].中国急救医学,2005,25(7):498-500.
[5] 花向扬,李和柏,陈瑞荣.高渗盐水抗休克临床观察[J].临床荟萃,1999,14(1):7-8.
[6] 王宏梗,张良成,林财珠.高张盐水羟乙基淀粉对创伤失血性休克大鼠早期肺损伤和中性粒细胞表达的影响[J].中华麻醉学,2002,22(8):503-504.
[7] Reis A,Totsch M,Shennib H,et al.Bronchoalveolar lavage:results of sequential,selective techniques in viable murines[J].Am J Respir Crit Care Med,1994,150(2):547-550.
[8] Callol L,Barbero E A,Blasco R,et al.New method of collection of bronchioloalveolar lavage in rat[J].Respir Med,1994,88(5):399.
[9] Payen D,Monneret G,Hotchkiss R.Immunotherapy-apotential new way forward in the treatment of sepsis[J].Crit Care,2013,17(1):118.
[10] 赵克森,金丽娟.休克的细胞和分子基础[M].北京:科学出版社,2002:315-316.
[11] 李志军.菌毒炎并治与多器官功能障碍综合征[J].中国中西医结合急救杂志,2004,11(6):381-383.
[12] Downey G P,Dong Q,Kruger J,et al.Regulation of neutrophil activation in acute lung injury[J].Chest,1999,116(Suppl.1):46s-54s.
[13] Doerschuk C M,Mizgerd J P,Kubo H,et al.Adhension molecules and cellular biomechanical changes in acute lung injury[J].Chest,1999,166(Suppl.1):37s-43s.
[14] 栾樱译,姚咏明.脓毒症中免疫负调控的研究进展[J].中国病理生理杂志,2011,27(3):616-619,624.
[15] 马晓春.应加深对脓毒症微循环功能障碍的认识[J].中国危重病急救医学,2011,23(2):66-67.
[16] Lee W L,Downey G P.Neutrophil activation and acute lung injury[J].Curr Opin Crit Care,2001,7(1):1-7.
[17] Meybohm P,Cavus E,Bein B,et a1.Small volume resuscitation:a randomized controlled trial with either norepinephrine or vasopressin during severe hemorrhage[J].J Trauma,2007,62(3):640-646.
