不同剂量右美托咪定预处理对大鼠心肌缺血再灌注损伤以及炎症反应的影响*
2015-05-16吴志林褚淑娟姚尚龙
吴志林, 褚淑娟, 姚尚龙, 伍 静
华中科技大学同济医学院附属协和医院麻醉科,武汉 430022
急性缺血性心脏病是目前危害人类健康和导致死亡的最常见的疾病之一。为挽救濒死心肌需要及时恢复血供,然而缺血区的再灌注有时会加速心肌死亡,导致梗死范围扩大,这就是心肌缺血再灌注损伤。寻找新的策略减轻这种损伤是目前国内外研究的热点[1]。右美托咪定是一种常用于麻醉的辅助镇静的高选择性α2肾上腺素能受体激动剂。研究表明右美托咪定可以减轻冠状动脉旁路移植手术应激反应,维持血流动力学的稳定[2],还能减轻心脏病患者非心脏手术时的心肌损伤,降低炎症因子的水平[3]。本研究拟观察不同剂量右美托咪定对大鼠心肌缺血再灌注的保护作用,并对可能机制进行探讨。
1 材料与方法
1.1 实验动物及分组
雄性SD大鼠40只,体重300~350g,由华中科技大学同济医学院实验动物学部提供,随机(随机数字表法)分为假手术组(Sham组),心肌缺血再灌注组(I/R组),常规剂量右美托咪定预处理组(Dex1组),大剂量右美托咪定预处理组(Dex2组),每组10只。
1.2 动物模型制备及各组实验方法
大鼠经腹腔注射50mg/kg戊巴比妥钠,麻醉后固定于操作台,分离股静脉置管,Dex1组给予右美托咪定5μg/kg负荷剂量,然后以5μg/(kg·h)持续输注1h,Dex2组给予右美托咪定10μg/kg负荷剂量,然后以10μg/(kg·h)持续输注1h,I/R组给予等量生理盐水输注1h,连接powerlab心电采集系统,记录心电图,输注完毕后分离暴露并切开气管,插入气管导管,连接小动物呼吸机,潮气量10 mL/kg,频率80~100次/min,剪开左侧胸壁,暴露胸腔,剪开心包膜,暴露心脏,结扎冠脉左前降支30 min,再灌注120min,以心电图出现ST段抬高或与高耸T波融合为结扎成功的标志,建立心肌缺血再灌注模型。而Sham组仅穿线不结扎,Sham组手术前后心电图ST段无明显变化,作为阴性对照组,在此仅为了证明模型是否成功,Sham组不参与统计分析。
1.3 标本采集和测定
I/R组、Dex1组和Dex2组在再灌注结束后抽血2mL,静置30min后4℃,3 000r/min离心20 min,分离血清冻存备用,采用ELISE检测血清肿瘤坏死因子α(TNF-α),白细胞介素6(IL-6)的含量。抽血后迅速取下心脏,摘除部分结扎线以下左心室心肌,冰浴中制备成10%的组织匀浆,按试剂盒说明书,测定各组心肌丙二醛(MDA),超氧化物歧化酶(SOD)的含量,经预冷的0.01mmol/L PBS漂洗,-20℃冷冻20min后,从心尖沿心脏长轴连续切片,以2%氯化三苯基四唑(TTC)染色,染色完毕4%多聚甲醛固定,以Image J图像分析软件计算心肌梗死面积。
1.4 统计学方法
采用SPSS 12.0统计软件进行数据分析,所有计量资料采用±s表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 炎症因子TNF-α、IL-6的变化
Dex1组和 Dex2组与I/R 组相比 TNF-α、IL-6均有所降低,差异具有统计学意义(均P<0.05);Dex1组和Dex2组之间差异无统计学意义。见表1。
表1 各组炎症因子TNF-α、IL-6的比较(±s,n=10)Table 1 Comparison of the changes of inflammatory factor TNF-αand IL-6(±s,n=10)

表1 各组炎症因子TNF-α、IL-6的比较(±s,n=10)Table 1 Comparison of the changes of inflammatory factor TNF-αand IL-6(±s,n=10)
与I/R组比较,*P<0.05
组别 TNF-α(pg/mL) IL-6(pg/mL)R 26.5±5.8 41.2±6.5 Dex1 18.5±5.4* 32.1±4.9*Dex2 19.4±5.2* 31.1±5.4 I/*
2.2 心肌组织MDA和SOD的变化
Dex1组和Dex2组与I/R组相比SOD升高,MDA降低(均P<0.05),而Dex1组和Dex2组之间差异无统计学意义。见表2。
表2 心肌组织MDA和SOD的比较(±s,n=10)Table 2 Comparison of MDA and SOD in myocardial tissue(±s,n=10)

表2 心肌组织MDA和SOD的比较(±s,n=10)Table 2 Comparison of MDA and SOD in myocardial tissue(±s,n=10)
与I/R组比较,*P<0.05
组别 SOD(U/mg) MDA(nmol/mg)R 39.0±5.2 15.3±3.5 Dex1 67.0±4.8* 13.5±5.2*Dex2 70.0±6.3* 12.3±4.2 I/*
2.3 各组心肌梗死面积的比较
采用TTC染色,经Image J图像分析软件计算I/R组梗死面积为(59.23±4.35)%,Dex1 组和Dex2组 分 别 为 (47.22±3.98)% 和 (48.56±4.59)%,两组与I/R组相比均显著减少,差异具有统计学意义(均P<0.05),而Dex1组和Dex2组差异无统计学意义。见图1。
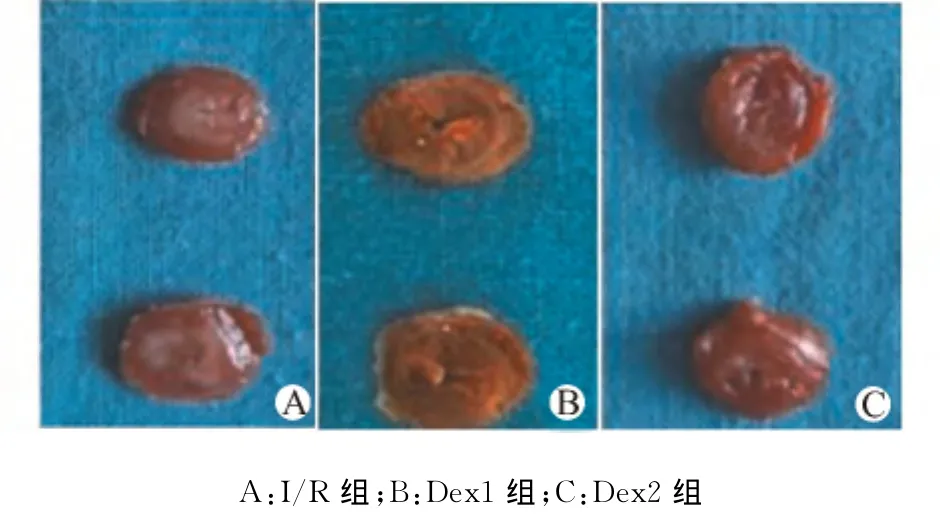
图1 I/R组、Dex1组和Dex2组心肌组织TTC染色Fig.1 TTC staining of myocardial tissue in group Dex1,Dex2and I/R
3 讨论
心肌缺血再灌注后的氧化应激和炎症反应是造成心肌损伤的机制之一,缺血再灌注后抗氧化物质的消耗,氧化后毒性产物的增加,激活体内的炎症反应进一步损害心肌,导致梗死后范围的扩大,因此通过各种方法减弱氧化应激,降低炎症反应是减轻心肌缺血再灌注损伤的治疗策略之一[4]。对脏器预先进行短暂的缺血再灌注处理后,通过调节炎症介质,激活神经传导通路,可以提高组织器官抗缺血再灌注损伤的能力,这就是缺血预处理(ischemic preconditioning,IPC)。目前认为IPC是一种最为有效的内源性保护机制。但是由于人为的缺血预处理的个体差异,安全时限等存在争议,其临床应用受到限制。因此人们尝试使用药物进行预处理,希望达到缺血预处理类似的保护作用,许多实验表明阿片类药物、挥发性麻醉药预处理都能产生一定程度的保护作用[5-6]。
右美托咪定是一种高选择性的α2肾上腺能受体激动剂,可通过降低TNF-α的表达,减轻大鼠肠道缺血再灌注损伤[7];抑制中枢的交感活性,调节脑血流和脑氧供,改善缺血区域的血流灌注,减少神经细胞的凋亡,具有神经保护作用[8],在本研究中我们尝试使用2种不同剂量的右美托咪定对心肌缺血再灌注损伤大鼠模型进行预处理,一种是常规剂量,以5μg/kg作负荷剂量,然后以5μg/(kg·h)持续输注,另一种为大剂量(Dex2组),剂量加倍,以10μg/kg为负荷剂量,然后以10μg/(kg·h)持续输注,建立大鼠体内心脏缺血再灌注模型,观察这2种剂量预处理后的效果。
多种炎症因子参与心肌缺血再灌注的损伤,包括 TNF-α、IL-6、IL-8、IL-10、IL-12等,这些炎症因子与缺血再灌注后无复流现象的发生及心肌梗死面积扩大密切相关,其中TNF-α由心肌缺血再灌注早期的心肌细胞和单核/巨噬细胞产生。在TNF-α和氧自由基的共同作用下,可激活对缺血再灌注损伤起到关键作用的炎症反应上游的核因子-κB,导致炎症放大,IL-6可直接作用于血管内皮细胞和免疫细胞,促进急性期蛋白合成,诱导细胞因子表达,催化和放大炎症反应[9]。多项研究表明 TNF-α、IL-6和氧化应激与缺血再灌注心肌细胞损伤呈正相关[10-11]。我们发现右美托咪定预处理的Dex1组和Dex2组血清炎症因子 TNF-α,IL-6与I/R组相比有明显降低,差异有统计学意义(P<0.05),表明右美托咪定具有明显的抗炎症反应的作用。
缺血再灌注后的炎症反应和氧化应激相互作用,促进细胞内蛋白酶的释放,共同加重心肌细胞的损伤,SOD是一种重要的抗氧化剂之一,SOD是氧自由基的自然天敌,MDA是脂质过氧化的最重要的产物之一,与缺血再灌注诱发的脂质过氧化密切相关。通过测定SOD和MDA可以反映机体抗氧化能力和膜脂质过氧化的程度[12]。在本实验中对缺血再灌注心肌SOD和MDA的检测发现,Dex1组和Dex2组与I/R组相比SOD活性增高,氧化应激产物MDA下降(P<0.05),通过对缺血再灌注心肌TTC染色后梗死面积测定发现Dex1组和Dex2组大鼠心肌梗死面积较I/R组有所缩小(均P<0.05)。
在常规剂量组(Dex1组)和大剂量组(Dex2组)两组之间对比,这两组大鼠缺血再灌注模型尽管采用了不同剂量的右美托咪定预处理,但是炎症反应指标,氧化应激和心肌梗死面积的差异并无统计学意义。提示右美托咪定在心肌保护作用似乎存在药物“封顶效应”。
综上所述,我们认为右美托咪定预处理可以通过减轻氧化应激,降低炎症反应对缺血再灌注心肌产生保护作用,但加大剂量后保护作用有限,是否因为大剂量的右美托咪定导致血压下降部分抵消了其抗炎症和抗氧化作用,其机制还有待进一步研究。
[1] Turer A T,Hill J A.Pathogenesis of myocardial ischemia reperfusion injury and rationale for therapy[J].Am J Cardiol,2010,106(3):3608-3610.
[2] Carollo D S,Nossaman B D,Ramadhyani U.Dexmeditomidine:a review of clinical applications[J].Curr Opin Anesthesiol,2008,21(4):457-461.
[3] 寇党培,王准,边卫,等.右美托咪定对非体外循环冠状动脉旁路移植术患者心肌损伤的影响[J].中华麻醉学杂志,2011,31(5):550-552.
[4] Kawano S,Kubota T,Monden Y,et al.Blockade of NF-kappaB improves cardiac function and survival after myocardial infarction[J].Am J Physiol Heart Circ Physiol,2006,291(3):1337-1344.
[5] Schultz J E,Hsu A K,Gross G J,et al.Morphine mimics the cardioprotective effect of ischemic preconditioning via aglibenclamide-sensitive mechanism in the rat heart[J].Cir Res,1996,78(6):1100-1104.
[6] 廖锦华,李健玲,严彦念,等.七氟醚预处理对缺血再灌注大鼠心肌活性氧的产生的影响及其发挥心肌保护作用的机制[J].中国病理生理学杂志,2011,27(8):1476-1484.
[7] Zhang X Y,Liu Z M,Wen S H,et al.Dexmeditomidine before,but not after ischemia attenuates intestinal injury induced by intestinal ischemia-reperfusion in rats[J].Anesthesiology,2012,116(5):1-12.
[8] Dong X,Xing Q,Li Y,et al.Dexmedetomidine provides neuroprotection:impact on ketamine-induced neuroapoptosis in the developing rat brain[J].Acta Anaesthesiol Scand,2014,58(9):1121-1126.
[9] Sugano M,Hata T,Tsuchida K,et al.Local delivery of soluble TNF-alpha receptor 1gene reduces infarct size following ischemia reperfusion injury in rats[J].Mol Cell Biochem,2004,266(12):127-132.
[10] Bhattacharya K,Farwell K,Huang M,et al.Mast cell deficient W/Wv mice have lower serum IL-6and less cardiac tissue necrosis than their normal littermates following myocardial ischemia-reperfusion[J].Int J Immunopathol Pharmacol,2007,20(1):69-74.
[11] Frangogiannis N G.Targeting the inflammatory response in healing myocardial infarcts[J].Curr Med Chem,2006,13(16):1877-1893.
[12] Juranek I,Bezek S.Controversy of free radical hypothesis:reactive oxygen species-cause or consequence of tissue injury?[J].Gen Physiol Biophys,2005,24(3):263-278.
