利多卡因对自发性及催产素诱发人子宫平滑肌收缩的影响*
2015-05-16黄晓雷李元涛齐晓非文亚杰吴铭广
黄晓雷, 李元涛, 李 泳, 齐晓非, 文亚杰, 吴铭广
南方医科大学附属深圳妇幼保健院麻醉科,深圳 518028
利多卡因是剖宫产手术中常用局麻药[1-2]。临床浓度的局麻药可抑制子宫平滑肌收缩并减弱子宫收缩力,进而增加产后出血的发生率[3-5]。而剖宫产后给予催产素促进子宫收缩已成为防治术后子宫出血的常规手段[6]。那么,利多卡因是否可影响催产素促子宫平滑肌收缩?其导致子宫平滑肌收缩功能减弱的具体机制是什么?研究表明,子宫平滑肌收缩功能与细胞内Ca2+浓度密切相关[7-9]。产妇生产过程中,催产素可通过激活催产素受体导致细胞内Ca2+浓度升高[10-11]。细胞内 Ca2+浓度升高可诱发钙调蛋白相关肌球蛋白轻链激酶激活进而导致子宫平滑肌收缩[12]。由此可见,利多卡因所致子宫收缩力减弱可能与催产素及其Ca2+调节功能异常相关。因此,本研究拟观察利多卡因对自发性及催产素诱发人子宫平滑肌收缩的影响并探讨其相关机制。
1 材料与方法
1.1 主要试剂及仪器
利多卡因及催产素购自美国Sigma公司;Krebs 液 含 有 NaCl 119mmol/L,MgSO41.2 mmol/L,KH2PO41.2mmol/L,NaHCO325mmol/L,CaCl22.5mmol/L,葡萄糖11.5mmol/L,EDTA 0.026mmol/L;钙离子荧光染料 Fluo-3AM 购自美国Molecular Probe公司;抗磷酸化PKC抗体、抗总PKC抗体、抗催产素受体购自美国Abcam公司;抗β-actin抗体购自武汉博士德公司;应变式传感器购自日本Kyowa公司,型号LVS-20GA;共聚焦显微镜购自德国Zeiss公司,型号LSM-510。
1.2 子宫平滑肌组织培养
本研究流程经南方医科大学附属深圳妇幼保健院伦理委员会批准。选择孕足月(孕周≥38周)拟行剖宫产术的健康产妇,胎儿及胎盘取出后于子宫下段切口上缘取条形子宫平滑肌组织,将其置入预冷无菌Krebs液中。Krebs液冲洗3遍去除组织表面残留血液。37℃ Krebs液中仔细剥离子宫及环形子宫平滑肌层,仅保留外层纵行子宫平滑肌并将其修剪为宽2mm、长15mm左右的组织块。平滑肌组织置入37℃的培养液中,并将组织块的一段与应变式传感器相连,并给予0.5g的初始张力。
1.3 实验给药
初始张力设置后,一部分平滑肌(40条)给予催产素(10-9mol/L)处理,另一部分(40条)给予等量生理盐水使其保持自主收缩状态。之后,经催产素处理或未经催产素处理的平滑肌组织被随机分为5组(n=8),包括对照组及利多卡因(L)1~4组。L1~4组分别给予10-5、5×10-5、10-4、5×10-4mol/L利多卡因,而对照组仅给予生理盐水。
1.4 钙离子浓度检测
平滑肌条块置入含5μmol/L Fluo-3AM 的培养液中室温孵育3h。Fluo-3AM孵育后,平滑肌组织置入37℃的培养液中,并将组织块的一段与应变式传感器相连,并给予0.5g的初始张力。组织块的一段与应变式传感器连接30min后,共聚焦显微镜下测定细胞内Ca2+浓度(激发波长488nm,发射波长505nm)。
1.5 蛋白提取及 Western blot检测
利多卡因处理1h后,子宫平滑肌用PBS洗3次,加入RIPA裂解液,用细胞刮刮下细胞,收集到Eppendorf管中,用BCA试剂盒对所抽提的蛋白质进行蛋白定量,将蛋白样品调整为相同浓度。相同浓度体积的蛋白样品加入5×样品缓冲液,100℃沸水中煮8min,12 000g离心8min,之后进行SDSPAGE电泳,并经电转移将蛋白转至PVDF膜。PVDF膜在5%的脱脂牛奶中室温封闭1h。封闭结束后,PVDF膜浸于5%脱脂牛奶稀释的相应浓度一抗(抗磷酸化PKC抗体,1∶500;抗总PKC抗体,1∶1 000;抗催产素受体抗体,1∶1 000;抗β-actin抗体,1∶500)中在4℃环境下孵育过夜。次日将膜取出,TBST液洗涤3次,加入1∶5 000稀释的辣根过氧化物酶标记的相应生物二抗(武汉博士德公司),室温孵育2h,TBST液洗涤3次,然后进行ECL显色,在凝胶成像系统(美国Bio Rad公司)中成像,采用Image Lab 3.0软件进行灰度分析。
1.6 统计学分析
所有数据以均数±标准差(±s)表示,采用SPSS 16.0软件进行数据分析。其中,连续变量的组间比较采用单因素方差分析。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 利多卡因对自发性人子宫平滑肌收缩的影响
与对照组比较,10-4及5×10-4mol/L利多卡因可导致自发性收缩子宫平滑肌收缩幅度和收缩频率减少(P<0.05或P<0.01,表1),而10-5及5×10-5mol/L利多卡因对自发性收缩子宫平滑肌收缩幅度和收缩频率的影响差异无统计学意义(均P>0.05,表1)。
2.2 利多卡因对催产素诱发人子宫平滑肌收缩的影响
与对照组比较,10-4及5×10-4mol/L利多卡因可导致催产素处理的子宫平滑肌收缩幅度和收缩频率减少(P<0.05或P<0.01,表1),而10-5及5×10-5mol/L利多卡因对催产素处理的子宫平滑肌收缩幅度和收缩频率的影响差异无统计学意义(均P>0.05,表1)。
2.3 利多卡因对人子宫平滑肌细胞内钙离子浓度的影响
与对照组比较,10-4及5×10-4mol/L利多卡因可导致自发性收缩子宫平滑肌细胞内钙离子浓度减少(P<0.05或P<0.01,表2),而10-5及5×10-5mol/L利多卡因对自发性收缩子宫平滑肌细胞内钙离子浓度影响差异无统计学意义(均P>0.05,表2)。与对照组比较,5×10-5、10-4及5×10-4mol/L利多卡因可导致催产素处理的子宫平滑肌细胞内钙离子浓度减少(P<0.05或P<0.01,表2),而10-5mol/L利多卡因对催产素处理的子宫平滑肌细胞内钙离子浓度的影响差异无统计学意义(P>0.05,表2)。
表1 不同浓度利多卡因对子宫平滑肌收缩功能的影响(±s,n=8)Table 1 Effects of lidocaine on the contractions of isolated myometrial smooth muscles from pregnant women(±s,n=8)

表1 不同浓度利多卡因对子宫平滑肌收缩功能的影响(±s,n=8)Table 1 Effects of lidocaine on the contractions of isolated myometrial smooth muscles from pregnant women(±s,n=8)
与对照组比较,*P<0.05**P<0.01
分组生理盐水处理幅度(g) 频率(次/10min)催产素处理幅度(g) 频率(次/10min)对照组1.73±0.21 1.37±0.12 2.16±0.30 1.90±0.21 L1 1.64±0.20 1.34±0.12 2.14±0.30 1.88±0.21 L2 1.56±0.19 1.32±0.12 2.06±0.29 1.76±0.19 L3 1.38±0.18* 1.19±0.11* 1.98±0.20* 1.54±0.17*L4 1.31±0.17* 1.06±0.10** 1.91±0.27* 1.33±0.15**
表2 不同浓度利多卡因对子宫平滑肌细胞内钙离子浓度的影响(±s,n=8,nmol/L)Table 2 Effects of lidocaine on the intracellular Ca2+concentration in isolated myometrial smooth muscles from pregnant women(±s,n=8,nmol/L)
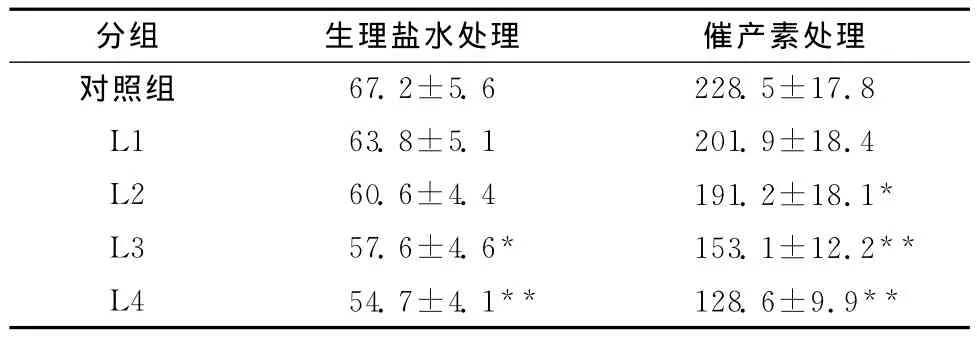
表2 不同浓度利多卡因对子宫平滑肌细胞内钙离子浓度的影响(±s,n=8,nmol/L)Table 2 Effects of lidocaine on the intracellular Ca2+concentration in isolated myometrial smooth muscles from pregnant women(±s,n=8,nmol/L)
与对照组比较,*P<0.05**P<0.01
分组 生理盐水处理 催产素处理对照组67.2±5.6 228.5±17.8 L1 63.8±5.1 201.9±18.4 L2 60.6±4.4 191.2±18.1*L3 57.6±4.6* 153.1±12.2**L4 54.7±4.1** 128.6±9.9**
2.4 利多卡因对人子宫平滑肌催产素受体及磷酸化PKC表达水平的影响
与对照组比较,10-4及5×10-4mol/L利多卡因可导致自发性收缩和催产素处理的子宫平滑肌细胞内磷酸化PKC表达水平降低(P<0.05或P<0.01,表3)。但10-4及5×10-4mol/L利多卡因对自发性收缩和催产素处理的子宫平滑肌细胞内催产素受体的影响差异无统计学意义(P>0.05,表3)。
3 讨论
已有研究表明,局麻药如利多卡因可导致离体子宫平滑肌自发性收缩减弱[13-14]。而本实验结果表明,利多卡因不仅可减弱人子宫平滑肌自发性收缩,亦可抑制催产素促子宫平滑肌收缩作用;而这种作用可能与平滑肌细胞内钙离子浓度减少及PKC磷酸化水平降低相关。
妊娠期妇女子宫平滑肌具有自发性收缩活动。而体外情况下子宫平滑肌亦可产生类似的自发性规律收缩[15]。这种自发性规律收缩受到细胞动作电位、平滑肌内钙离子浓度及表面功能受体的调控[16-17]。利多卡因等局麻药的主要作用机制是抑制细胞膜钠离子通道介导钠离子内流[18-19]。钠离子内流过度减少可影响动作电位生成和钙离子内流,从而减弱细胞兴奋性[20]。但利多卡因能否影响自发性及催产素诱发子宫平滑肌收缩功能仍有待进一步探讨。
表3 利多卡因对子宫平滑肌细胞内PKC磷酸化水平及催产素受体表达水平的影响(±s,n=5)Table 3 Effects of lidocaine on the levels of PKC phosphorylation and oxytocin receptor protein expression in isolated myometrial smooth muscles from pregnant women(±s,n=5)

表3 利多卡因对子宫平滑肌细胞内PKC磷酸化水平及催产素受体表达水平的影响(±s,n=5)Table 3 Effects of lidocaine on the levels of PKC phosphorylation and oxytocin receptor protein expression in isolated myometrial smooth muscles from pregnant women(±s,n=5)
与对照组比较,*P<0.05**P<0.01
PKC磷酸化水平(%)分组催产素受体(%)生理盐水处理 催产素处理对照组生理盐水处理 催产素处理90.2±10.8 91.6±8.3 100.0±14.0 157.4±17.3 100.0±12.0 95.0±8.6 L1 97.3±12.5 147.8±14.9 96.2±11.0 92.0±6.6 L2 87.0±13.4 135.4±17.8 96.3±14.0 94.0±7.9 L3 72.4±12.8* 124.1±13.9* 94.8±11.4 92.9±8.4 L4 64.5±12.4* 95.2±11.0**
利多卡因是临床上常用的局麻药,在剖宫产手术硬膜外麻醉中得到广泛应用[21]。研究表明,在常规使用利多卡因行硬膜外麻醉的剖宫产术中,血浆中利多卡因的浓度约为10-5~10-4mol/L[22]。因此,本实验通过给予子宫平滑肌10-5、5×10-5、10-4及5×10-4mol/L利多卡因,观察不同浓度利多卡因对子宫平滑肌收缩功能的影响。与前期研究结果一致[13-14],我们的结果表明,10-4及5×10-4mol/L的利多卡因可显著减弱子宫平滑肌自主收缩功能。
催产素是剖宫产手术中的常规用药[23]。临床上常于胎儿及胎盘取出后静脉给予催产素以促进子宫收缩,防止术后子宫出血的发生。因此,本实验亦观察了催产素预处理状况下,利多卡因对子宫平滑肌收缩功能的影响。结果表明,10-4及5×10-4mol/L的利多卡因可显著减弱催产素诱发的子宫平滑肌收缩。这就说明,利多卡因不仅可导致子宫平滑肌自主收缩功能下降,亦可导致催产素促子宫平滑肌收缩能力减弱。因此,较高剂量的利多卡因可能导致子宫平滑肌对催产素反应性降低进而增加剖宫产后产后出血的风险。
利多卡因诱发子宫平滑肌收缩能力减弱的机制尚不清楚。研究表明,细胞钙离子是调节子宫平滑肌收缩的关键分子[24]。催产素可作用于子宫平滑肌表面的催产素受体,通过激活PKC信号通路,导致细胞内Ca2+浓度增加,从而促进子宫平滑肌收缩[25]。而子宫平滑肌细胞内钙离子浓度降低可能是导致子宫收缩异常及产后出血的重要机制。本实验结果表明,10-4及5×10-4mol/L的利多卡因可显著减少自主收缩子宫平滑肌细胞内钙离子浓度,并减弱催产素诱发的钙离子内流作用。与此同时,10-4及5×10-4mol/L的利多卡因亦可导致子宫平滑肌细胞内磷酸化PKC水平下降。PKC活性(磷酸化水平)下降可导致子宫内膜平滑肌内肌球蛋白动能减弱[25],从而加重子宫平滑肌收缩异常。
综上所述,利多卡因可能通过抑制子宫平滑肌PKC信号通路,从而降低细胞内钙离子浓度,最终减弱人子宫平滑肌自发性收缩并抑制催产素的促收缩作用。
[1] Farzi F,Mirmansouri A,Forghanparast K,et al.Addition of intrathecal fentanyl or meperidine to lidocaine and epinephrine for spinal anesthesia in elective cesarean delivery[J].Anesth Pain Med,2014,4(1):e14081.
[2] Kessous R,Wiznitzer A,Polachek H,et al.Preoperative analgesia with local lidocaine infiltration for post cesarean delivery pain management[J].J Matern Fetal Neonatal Med,2012,25(7):1131-1134.
[3] Nacitarhan C,Sadan G,Kayacan N,et al.The effects of opioids,local anesthetics and adjuvants on isolated pregnant rat uterine muscles[J].Methods Find Exp Clin Pharmacol,2007,29(4):273-276.
[4] Wei J S,Jin Z B,Yin Z Q,et al.Effects of local anesthetics on contractions of pregnant and non-pregnant rat myometriumin vitro[J].Acta Physiol Hung,2014,101(2):228-235.
[5] Karsli B,Kayacan N,Kucukyavuz Z,et al.Effects of local anesthetics on pregnant uterine muscles[J].Pol J Pharmacol,2003,55(1):51-56.
[6] Kotaska A J,Klein M C,Liston R M.Epidural analgesia associated with low-dose oxytocin augmentation increases cesarean births:a critical look at the external validity of randomized trials[J].Am J Obstet Gynecol,2006,194(3):809-814.
[7] Bernstein K,Vink J Y,Fu X W,et al.Calcium-activated chloride channels anoctamin 1and 2promote murine uterine smooth muscle contractility[J].Am J Obstet Gynecol,2014,211(6):681-688.
[8] 黄晓雷,罗仪,李元涛,等.丙泊酚对人子宫平滑肌细胞Ca2+跨膜内流和肌浆网钙释放功能的影响[J].华中科技大学学报:医学版,2011,40(3):357-360.
[9] 李德,伍卫,骆宁,等.钙释放通道稳定蛋白过度表达对心力衰竭心室肌细胞肌浆网功能的影响[J].中国病理生理杂志,2007,23(7):1263-1266.
[10] Dyer R A,Butwick A J,Carvalho B.Oxytocin for labour and caesarean delivery:implications for the anaesthesiologist[J].Curr Opin Anaesthesiol,2011,24(3):255-261.
[11] Cretoiu S M,Simionescu A A,Caravia L,et al.Complex effects of imatinib on spontaneous and oxytocin-induced contractions in human non-pregnant myometrium[J].Acta Physiol Hung,2011,98(3):329-338.
[12] Wray S.Uterine contraction and physiological mechanisms of modulation[J].Am J Physiol,1993,264(1Pt 1):C1-C18.
[13] Karsli B,Kayacan N,Kucukyavuz Z,et al.Effects of local anesthetics on pregnant uterine muscles[J].Pol J Pharmacol,2003,55(1):51-56.
[14] Nacitarhan C,Sadan G,Kayacan N,et al.The effects of opioids,local anesthetics and adjuvants on isolated pregnant rat uterine muscles[J].Methods Find Exp Clin Pharmacol,2007,29(4):273-276.
[15] Dallot E,Pouchelet M,Gouhier N,et al.Contraction of cultured human uterine smooth muscle cells after stimulation with endothelin-1[J].Biol Reprod,2003,68(3):937-942.
[16] Tong W C,Choi C Y,Kharche S,et al.A computational model of the ionic currents,Ca2+dynamics and action potentials underlying contraction of isolated uterine smooth muscle[J].PLoS One,2011,6(4):e18685.
[17] Rauk P N,Friebe-Hoffmann U,Winebrenner L D,et al.Interleukin-6up-regulates the oxytocin receptor in cultured uterine smooth muscle cells[J].Am J Reprod Immunol,2001,45(3):148-153.
[18] Mao J,Chen L L.Systemic lidocaine for neuropathic pain relief[J].Pain,2000,87(1):7-17.
[19] Roberson D P,Binshtok A M,Blasl F,et al.Targeting of sodium channel blockers into nociceptors to produce long-duration analgesia:a systematic study and review[J].Br J Pharmacol,2011,164(1):48-58.
[20] Xu F,Garavito-Aguilar Z,Recio-Pinto E,et al.Local anesthetics modulate neuronal calcium signaling through multiple sites of action[J].Anesthesiology,2003,98(5):1139-1146.
[21] El-Tahan M R,Warda O M,Diab D G,et al.A randomized study of the effects of perioperative i.v.lidocaine on hemodynamic and hormonal responses for cesarean section[J].J Anesth,2009,23(2):215-221.
[22] Downing J W,Johnson H V,Gonzalez H F,et al.The pharmacokinetics of epidural lidocaine and bupivacaine during cesarean section[J].Anesth Analg,1997,84(3):527-532.
[23] Balki M,Ronayne M,Davies S,et al.Minimum oxytocin dose requirement after cesarean delivery for labor arrest[J].Obstet Gynecol,2006,107(1):45-50.
[24] Ledoux J,Werner M E,Brayden J E,et al.Calcium-activated potassium channels and the regulation of vascular tone[J].Physiology(Bethesda),2006,21(1):69-78.
[25] Sanborn B M.Hormones and calcium:mechanisms controlling uterine smooth muscle contractile activity.The Litchfield Lecture[J].Exp Physiol,2001,86(2):223-237.
