MicroRNA-155对糖尿病大鼠脑缺血损伤血管再生的调控*
2015-05-16韩江全卢俊江向灿辉刘承灵王正远刘玲陈玲范娅丹
韩江全,卢俊江,向灿辉,刘承灵,王正远,刘玲,陈玲,范娅丹
(遵义医学院1第五附属医院神经内科,2珠海校区实验中心,广东 珠海 519100;3南方医科大学珠江医院特需医疗中心,广东 广州 510000)
MicroRNA-155对糖尿病大鼠脑缺血损伤血管再生的调控*
韩江全1△,卢俊江1,3,向灿辉2,刘承灵1,王正远1,刘玲1,陈玲1,范娅丹1
(遵义医学院1第五附属医院神经内科,2珠海校区实验中心,广东 珠海 519100;3南方医科大学珠江医院特需医疗中心,广东 广州 510000)
目的:观察microRNA-155(miRNA-155)表达对糖尿病大鼠脑缺血损伤及CD31、血管内皮生长因子(VEGF)表达的影响,探讨miRNA-155对糖尿病加重脑缺血血管再生的调控作用。方法:SD大鼠腹腔内注射链脲佐菌素建立糖尿病大鼠模型,继而应用栓线法建立永久性局灶性脑缺血模型。随机分为5组:(1)假手术组(sham组);(2)脑缺血组(CI组);(3)糖尿病脑缺血组(DCI组);(4)糖尿病脑缺血+miRNA-155抑制物组(inhibitor组);(5)糖尿病脑缺血+阴性对照组(scramble组)。于缺血后24 h采用实时荧光定量聚合酶链反应检测miRNA-155的表达水平;参照Zea-Longa 5分制行神经功能缺损评分;2,3,5-氯化三苯基四氮唑(TTC)染色测梗死体积;Western blotting检测血小板内皮细胞黏附分子-1(PECAM-1/CD31)、VEGF的表达水平。结果:糖尿病脑缺血+miRNA-155抑制物组大鼠脑缺血侧皮质区的miRNA-155表达水平显著低于糖尿病脑缺血组(P<0.05)。miRNA-155表达下调可显著减少糖尿病脑缺血大鼠的神经功能缺损评分及脑梗死体积,但显著增加CD31表达水平与VEGF表达水平(均P<0.05)。结论:miRNA-155对糖尿病加重脑缺血损伤血管再生有重要的调控作用,miRNA-155表达下调可显著减轻糖尿病大鼠脑缺血损伤。
微小RNA-155;糖尿病;脑缺血;血管再生
脑梗死是糖尿病的严重血管并发症,糖尿病并发急性脑梗死占脑梗死的20%~25%,且梗死面积更大、症状更重,更容易形成进展性卒中,预后更差[1-2]。糖尿病可加重脑缺血损伤的神经元损害和血管损害已得到广泛认可,但其机制尚不完全清楚,仍未寻找出有效可行的治疗措施。微小RNA(microRNAs,miRNAs)是一类小分子非编码RNA,约由20~22个碱基组成。研究显示,miRNAs可通过调控其靶mRNA翻译过程发挥基因表达调控作用,从而广泛参与细胞分化、增殖以及血管再生等多种生物现象[3]。miRNA-155是miRNAs家族中的一员,新近研究发现,脑缺血损伤以及在多种脑损伤同时存在的情况下,miRNA-155表达呈现显著变化[4-5],提示miRNA-155在脑缺血损伤中发挥重要的调控作用;而抑制miRNA-155具有神经保护作用,可能对脑缺血损伤的修复有益[5-6]。此外,血管再生(angiogenesis)已被证明可增加脑缺血后脑组织的血液灌注及改善神经功能,在糖尿病加重脑缺血损伤中起着重要作用[2,7]。本实验通过使用人工合成miRNA-155抑制物下调糖尿病脑缺血大鼠脑内的miRNA-155水平,探讨miRNA-155对糖尿病大鼠脑缺血血管再生的影响。
材料和方法
1 材料
健康成年雄性SD大鼠购自遵义医学院珠海校区实验动物中心。RNA抽提试剂盒miRNeasy Mini购自Qiagen;TaqMan®MicroRNA反转录试剂盒、TaqMan®基因表达预混液以及TaqMan®MicroRNA Assays购自Life Technologies;2,3,5-氯化三苯基四氮唑(TTC)试剂、链脲佐菌素购自Sigma;TNF-α羊抗多克隆抗体购自Santa Cruz;miR-155抑制物及阴性对照核苷酸购自上海吉玛生物公司。miR-155抑制物及其阴性对照核苷酸均溶解于灭菌生理盐水中,浓度为0.2 g/L。
2 模型的制备
2.1 糖尿病动物模型建立链脲佐菌素用0.1 mmol/L柠檬酸钠-柠檬酸缓冲液(pH 4.2)在冰浴中配制成10 mg/L的浓度,于禁食8 h大鼠左下腹腹腔注射(55 mg/kg)。稳定7 d后,用罗氏血糖仪测定大鼠尾尖血血糖,空腹血糖>16.7 mmol/L的大鼠确定为糖尿病大鼠。
2.2 永久性局灶性脑缺血模型的建立采用Longa线栓法建立永久性大脑中动脉阻塞脑缺血模型,均予阻断右侧大脑中动脉24 h。糖尿病大鼠于注射链脲佐菌素后6周建立脑缺血模型。
3 实验动物分组
实验动物60只,8~12周,体重240~280 g,均衡饲料喂养,自由进食。随机分为6组:(1)假手术(sham)组:不阻断右侧大脑中动脉,假手术5 min经侧脑室注射等容量生理盐水;(2)脑缺血(cerebral ischemia,CI)组:于脑缺血5 min时经侧脑室注射等容量生理盐水;(3)糖尿病脑缺血(diabetes with cerebral ischemia,DCI)组:糖尿病大鼠于脑缺血5 min时经侧脑室注射等容量生理盐水;(4)糖尿病脑缺血+miRNA-155抑制物(inhibitor)组:糖尿病大鼠于脑缺血5 min时经侧脑室注射miRNA-155抑制物10 μg;(5)糖尿病脑缺血+阴性对照(scramble)组:糖尿病大鼠于脑缺血5 min时经侧脑室注射miRNA-155阴性对照核苷酸10 μg。每组均10只大鼠。
4 主要方法
4.1 神经功能评分参照Zea-Longa 5分制评分标准,于缺血24 h对各组大鼠进行行为学评分纪录。2分或2分以上者视为造模成功。
4.2 梗死体积测定各组动物于神经功能缺损评分完毕后过量麻醉处死,迅速断头取脑,将鼠脑立即置于-20℃冰箱中20 min后取出,行2 mm厚连续冠状切片,共5片。将切片立即置于2%氯化三苯四氮唑溶液中,37℃恒温下避光染色30 min,然后置于4℃、4%多聚甲醛溶液中固定24 h。正常脑组织染为红色,梗死组织为白色,数码相机拍照,用Luxex-F图像分析仪(日本富士)测定每张脑片的梗死面积,根据公式V=t(A1+A2+……An)-(A1+An) t/2计算梗死体积,其中t为切片厚度,A为梗死面积。
4.3 实时荧光定量聚合酶链反应(real-time PCR)检测miRNA-155的表达各组动物于脑缺血24 h后,取大鼠脑缺血侧皮质区组织标本。使用miRNeasy Mini试剂盒提取总RNA。根据TaqMan®MicroRNA反转录试剂盒使用说明将RNA样品逆转录。将获得cDNA稀释10倍后使用TaqMan®MicroRNA Assays及TaqMan®基因表达预混液进行real-time PCR反应。采用U6为内参照基因。通过2-ΔΔCt法统计各组间miRNA-155相对表达量。
4.4 Western blotting检测CD31和血管内皮生长因子(vascular endothelial growth factor,VEGF)蛋白的表达大鼠迅速断头取脑,冰上分离缺血侧顶叶大脑皮质约100 mg,冰上研磨组织后加预冷的蛋白裂解液,继续碾磨至液态,然后4℃、12 000 r/min离心30 min,留上清液,取40 μL用BCA法进行蛋白定量测定,所剩上清液按4∶1的比例加变性loading buffer,100℃水浴10 min。取蛋白样品(40 μg)采用10%SDS-PAGE(Bio-Rad垂直板式电泳槽仪)120 min进行分离,然后转至PVDF。5%脱脂奶粉37℃封闭2 h,然后分别加入兔抗CD31和VEGF抗体(1∶500),37℃孵育2 h,4℃过夜;偶联辣根过氧化物酶(HRP)羊抗兔IgG(1∶2 000)室温孵育2 h,LumiGLO发光,X-感光盒内曝光。以上反应均在塑料袋内进行,其间用PBS充分洗涤。为了检测蛋白裂解/转移的变化,所有的印迹均以丽春红(抗体孵育前)和考马斯亮蓝(化学发光法检测后)染色。将胶片进行扫描或拍照,采用HPIAS-1000高清晰度彩色病理图文分析系统进行图像分析,获取各组Western blotting条带的平均吸光度(A)值,内参照为GAPDH,目的蛋白与GAPDH吸光度比值即为目的蛋白的相对值。
5 统计学处理
采用SPSS 17.0软件进行统计分析,计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1 各组造模前的血糖值
Sham组、CI组、DCI组、inhibitor组和scramble组造模前的血糖水平分别为(5.78±0.32)、(5.90± 0.27)、(16.96±1.65)、(16.93±1.15)和(16.97± 1.53)mmol/L,其中DCI组、inhibitor组及scramble组的血糖水平明显高于CI组,有统计学意义(P<0.05),而DCI组、inhibitor组与scramble组间无显著差异。
2 各组神经功能缺损评分
Sham组大鼠神经功能缺损评分均为0分,其余各组大鼠在麻醉清醒后均出现不同程度的神经功能缺损。其中,与sham组比较,CI组、DCI组、inhibitor组和scramble组大鼠的神经功能缺损评分均明显升高(P<0.05);与CI组相比,DCI组和scramble组大鼠的神经功能缺损评分均明显升高(P<0.05),但DCI组和scramble组之间差异无统计学意义。而inhibitor组大鼠的神经功能缺损评分较DCI组和scramble组均明显降低(P<0.05),见表1。

表1 各组大鼠神经功能评分、脑梗死体积、miRNA-155、CD31及VEGF表达水平的比较Table 1.The neural deficit functional score,infarct size and the e? xpression of miRNA-155,CD31 and VEGF in the diabetic rats with different treatments(Mean±SD.n=5~10)
3 各组梗死体积的变化
Sham组未见有白色梗死区域,其余各组脑缺血侧可见到明显的白色梗死区。其中,与sham组比较,CI组、DCI组、inhibitor组和scramble组大鼠的梗死体积均明显增大(P<0.05);与CI组比较,DCI组和scramble组大鼠的梗死体积均明显增大(P<0.05),但DCI组和scramble组之间差异无统计学意义(P>0.05)。而inhibitor组大鼠的梗死体积较DCI组和scramble组明显减小,见图1、表1。

Figure 1.The TTC staining of the brain slices among 5 groups.The pale area represents the infarct region.图1 各组大鼠脑组织TTC染色图片
4 各组缺血周围组织miRNA-155的表达
Sham组见少量miRNA-155表达,其余各组脑缺血侧可见到明显的miRNA-155表达。其中,与sham组比较,CI组、DCI组、inhibitor组和scramble组大鼠的miRNA-155表达均明显增多(P<0.05);与CI组比较,DCI组和scramble组大鼠的miRNA-155表达均增多明显(P<0.05),但DCI组和scramble组之间差异无统计学意义(P>0.05)。而inhibitor组大鼠的miRNA-155表达较DCI组和scramble组明显减小(P<0.05),见图2、表1。

Figure 2.The expression of miRNA-155 in cerebral cortex of the diabetic rats with different treatments determined by real-time PCR.Mean±SD.n=5.*P<0.05 vs sham;#P<0.05 vs CI;ΔP<0.05 vs DCI.图2 Real-time PCR检测各组miRNA-155的表达
5 各组缺血周围组织CD31、VEGF表达
Sham组见少量CD31、VEGF蛋白表达,其余各组脑缺血周围组织可见到明显的CD31、VEGF蛋白表达。其中,与sham组比较,CI组、DCI组、inhibitor组和scramble组大鼠的CD31、VEGF蛋白表达均明显增多(P<0.05);与CI组比较,DCI组和scramble组大鼠的CD31、VEGF蛋白表达均明显减少(P<0.05),但DCI组和scramble组之间差异无统计学意义。而inhibitor组大鼠的CD31、VEGF蛋白表达较DCI组和scramble组明显增多(P<0.05),见图3、表1。
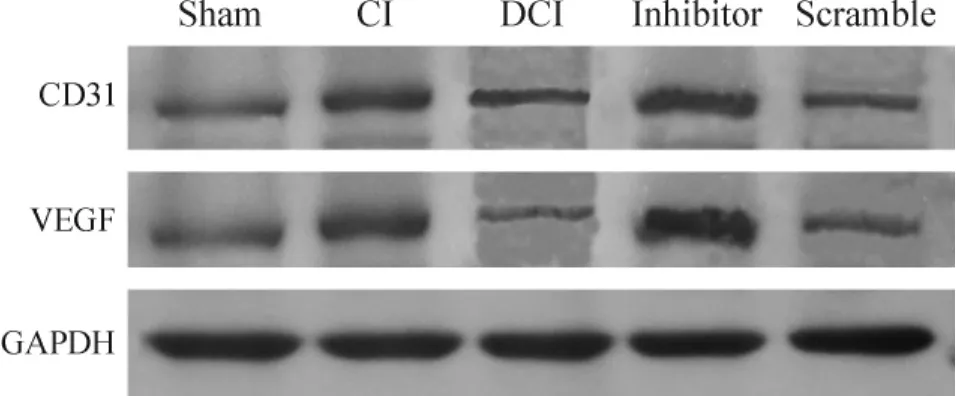
Figure 3.The protein expression of CD31 and VEGF in the cerebral cortex of ischemic penumbra determined by Western blotting.图3 CD31和VEGF蛋白表达的Western blotting图
讨论
糖尿病是脑血管病发病和加重的重要危险因素,它不仅能够诱发脑缺血,而且能够使脑缺血损伤进一步加重。本实验发现,与脑缺血组相比,糖尿病脑缺血大鼠的神经功能评分明显增加,梗死体积显著增大,与既往研究[1-2]一致,进一步证实糖尿病加重脑缺血损伤,也提示糖尿病对缺血性脑损伤有加强效应。糖尿病加重脑缺血损伤的病理机制迄今尚未完全清楚。近年研究证实,血管再生可增加脑缺血后脑组织的血液灌注及改善神经功能,在糖尿病加重脑缺血损伤中起着重要作用[2,7]。血管再生为糖尿病加重脑缺血损伤的治疗开辟了一条再血管化的新途径。目前在血管再生的研究中,微血管密度是普遍采用的较直观能有效反映新生血管数目和侧支循环建立情况的指标。CD31又称为血小板内皮细胞黏附分子-1(platelet endothelial cell adhesion molecule-1,PECAM-1),主要由内皮细胞和淋巴结中分化期的单核细胞分泌,存在于血管内皮和血小板中的一种糖蛋白,也是内皮细胞的一种特异性标记物。脑缺血梗死周围区微血管密度高,则CD31的蛋白表达明显增加,故将CD31作为特异性标记物,来反映组织中微血管密度已被广泛采用[8]。而血管内皮生长因子是一种多功能细胞因子,具有促进微动脉、小动脉血管通透性增加、血管内皮细胞增殖、迁移及诱导血管生成等作用;缺血后脑组织VEGF及受体表达增加,并与CD31表达呈正相关,对缺血脑组织具有保护作用,因此,VEGF已被作为反映血管再生的标志性指标[2]。研究显示,局部脑缺血可引起VEGF表达上调;单纯升高血糖也会使VEGF表达增加,而糖尿病大鼠脑缺血模型的VEGF mRNA呈低水平表达[9],本实验结果与上述研究一致,提示缺血与高血糖联合运用对VEGF表达的影响未表现叠加效应。究其原因,可能与缺血和高血糖时VEGF表达的调控途径不同有关。目前认为,低氧是引起VEGF表达上调的强效诱发因素,可通过缺氧诱导因子-1和(或)缺氧诱导蛋白来刺激VEGF的转录与表达。而高血糖引起VEGF表达上调的机制则与二酯酰甘油-蛋白激酶C途径有关。本实验显示,糖尿病脑缺血大鼠的CD31和VEGF的表达较脑缺血组明显减弱,而神经功能评分明显增加、梗死面积也显著增大,进一步证实糖尿病加重脑缺血损伤可能与VEGF低表达有关,另一方面也表明血管再生在糖尿病加重脑缺血再灌注损伤过程起着重要作用。miRNA是一类进化上保守的非编码单链小RNA,能在转录后降解靶基因mRNA或抑制基因的翻译。每一种miRNA可以通过调控多个靶mRNA表达。研究显示miRNA几乎参与了所有已知的生物学调控过程,显示其强大的调控作用[3]。近年来,一些有关miRNA调控缺血诱导下血管再生研究已见报道[10]。但有关miRNA-155调控糖尿病加重脑缺血损伤血管再生的研究尚未见报道。miRNA-155属于microRNAs家族中的一员,位于非编码基因Bic内,在血液细胞中高表达。研究发现,永久性大脑中动脉阻塞脑缺血损伤及在多种脑损伤同时存在的情况下,miRNA-155在脑内海马区表达改变显著[4]。新近研究发现,miRNA-155在脑缺血皮质区表达明显上调[5]。本实验结果显示,糖尿病大鼠脑缺血侧皮质区miRNA-155表达较脑缺血组明显上调,一方面表明miRNA-155表达具有广泛性及作用机制的复杂性;另一方面提示miRNA-155可能参与了糖尿病加重脑缺血损伤的病理生理过程。为了进一步明确miRNA-155在糖尿病加重脑缺血损伤的作用,我们使用miRNA-155抑制物进行干预。miRNA抑制物是一类经人工合成或构建的反义表达载体,通过碱基互补原理结合目的基因或mRNA上特定的序列(靶核酸),从而最终达到基因控制和治疗目的。由于miRNA抑制物基因治疗具有高度特异性、经济方便及不良反应小等优点,现已成为当前肿瘤治疗研究热点之一。在脑血管疾病方面,目前研究已发现[11],抑制miR-145、-497、-181a、-1和-let-7f的表达对脑缺血损伤均具有神经保护作用。本实验发现,miRNA-155抑制物可显著减少脑缺血大鼠的miRNA-155表达水平,且可显著改善糖尿病脑缺血大鼠的神经功能缺损评分,减少脑梗死体积,进一步证实miRNA-155在糖尿病加重脑缺血损伤中起着重要的作用。其原因可能为:糖尿病加重脑缺血损伤过程与炎症反应及免疫密切相关[1-2],而miRNA-155是一个多功能miRNA,参与了血细胞再生、炎症和免疫等多种生物学过程,与脑缺血后炎性反应密切相关[5]。研究发现,神经小胶质细胞在脂多糖刺激后,miRNA-155表达明显上调;敲除miRNA-155后,则细胞因子信号抑制蛋白-1显著上调,一氧化氮产生以及炎症细胞因子、诱导一氧化氮合酶表达明显减少;原代培养神经元在miRNA-155被抑制的条件培养基进行培养,则减少神经元死亡,因此,抑制miRNA-155表达具有神经保护作用,对脑缺血损伤产生有益作用[4-5]。
此外,有研究发现,miRNA-155能在转录后水平调控血管紧张素Ⅱ1型受体,从而抑制血管紧张素Ⅱ的信号传导[12]。由于血管紧张素Ⅱ与血管再生相关[13],推测miRNA-155可能参与血管再生。另有研究发现[14],miRNA-155在人脐静脉内皮细胞和血管平滑肌细胞上呈现高表达,并能够直接作用于血管紧张素II 1型受体上,降低血管紧张素II诱导内皮细胞迁移,抑制血管再生。新近研究发现,miRNA-155作为脑源性神经营养因子的调节因子,可直接抑制内源性脑源性神经营养因子产生,而后者对促进血管再生有着重要的影响[15]。本实验结果显示,糖尿病脑缺血大鼠的miRNA-155表达明显增强,则CD31和VEGF表达明显减少,而抑制miRNA-155表达,则CD31和VEGF表达显著增强,提示miRNA-155对糖尿病加重脑缺血损伤血管再生有着重要的调控作用。
[1]Bruno A.Management of hyperglycemia during acute stroke[J].Curr Cardiol Rep,2009,11(1):36-41.
[2]韩江全,吴俊雄,胡泳涛,等.超负荷血糖对鼠局灶性脑缺血侧皮质内皮抑素表达的影响[J].中风与神经疾病杂志,2012,29(4):321-324.
[3]Filip A.MiRNA——new mechanisms of gene expression control[J].Postepy Biochem,2007,53(4):413-419.
[4]Liu DZ,Tian YF,Ander BP,et al.Brain and blood microRNA expression profiling of ischemic stroke,intracerebral hemorrhage and kainate seizures[J].J Cereb Blood Flow Metab,2010,30(1):92-101.
[5]Hunsberger JG,Fessler EB,Wang ZF,et al.Post-insult valproic acid-regulated microRNAs:potential targets for cerebral ischemia[J].Am J Transl Res,2012,4(3): 316-332.
[6]Cardoso AL,Guedes JR,Pereira de Almeida L,et al.miR-155 modulates microglia-mediated immune response by down-regulating SOCS-1 and promoting cytokine and nitric oxide production[J].Immunology,2012,135(1): 73-88.
[7]Soliman S,Ishrat T,Pillai A,et al.Candesartan induces a prolonged proangiogenic effect and augments endothelium-mediated neuroprotection after oxygen and glucose deprivation:role of vascular endothelial growth factors A and B[J].J Pharmacol Exp Ther,2014,349(3):444-457.
[8]Lee CZ,Xue Z,Hao Q,et al.Nitric oxide in vascular endothelial growth factor-induced focal angiogenesis and matrix metalloproteinase-9 activity in the mouse brain[J].Stroke,2009,40(8):2879-2881.
[9]陈静,李树清.高血糖和脑缺血对树驹皮层不同区域VEGF表达的影响[J].中国病理生理杂志,2010,26(2):251-255.
[10]Bonauer A,Carmona G,Iwasaki M,et al.MicroRNA-92a controls angiogenesis and functional recovery of ischemic tissues in mice[J].Science,2009,324(5935):1710-1713.
[11]Koutsis G,Siasos G,Spengos K.The emerging role of microRNA in stroke[J].Curr Top Med Chem,2013,13 (13):1573-1588.
[12]Martin MM,Lee EJ,Bucken berger JA,et al.The human angiotensinⅡtype 1 receptor-1166 A/C polymorphism attenuates microRNA-155 binding[J].J Biol Chem,2007,282(33):24262-24269
[13]Heffelfinger SC.The renin angiotensin system in the regulation of angiogenesis[J].Curr Pharm Des,2007,13 (12):1215-1229.
[14]Zhu N,Zhang DZ,Chen SF,et al.Endothelial enriched microRNAs regulate angiotensin II-induced endothelial inflammation and migration[J].Atherosclerosis,2011,215 (2):286-293.
[15]Varendi K,Kumar A,Härma MA,et al.miR-1,miR-10b,miR-155,and miR-191 are novel regulators of BDNF[J].Cell Mol Life Sci,2014,5(8):1312-1318.
Effect of microRNA-155 on regulation of angiogenesis in diabetic rats with cerebral ischemic injury
HAN Jiang-quan1,LU Jun-jiang1,3,XIANG Can-hui2,LIU Cheng-ling1,WANG Zhengyuan1,LIU Ling1,CHEN Ling1,FAN Ya-dan1
(1Department of Neurology,The Fifth Affiliated Hospital,2Experimental Center of Zhuhai Campus,Zunyi Medical College,Zhuhai 519100,China;3Special Medical Center of Zhujiang Hospital Affiliated to Southern Medical University,Guangzhou 510000,China.E-mail:gdshanjq@163.com)
AIM:To evaluate the effect of microRNA-155(miRNA-155)on the regulation of angiogenesis in diabetic rats with cerebral ischemic injury.METHODS:Adult male Sprague-Dawley rats were randomly divided into 5 groups:sham group,cerebral ischemia group,diabetic cerebral ischemia group,diabetic cerebral ischemia+miRNA-155 inhibitors group and diabetic cerebral ischemia+scramble group.Diabetes model was made by injection of streptozocin and permanent cerebral ischemic model was developed by suture-occluded method.The scores of neurological deficit and infarct volume were estimated at 24 h after cerebral ischemia.miRNA-155 level was detected by real-time polymerase chain reaction.The expression of platelet endothelial cell adhesion molecule-1(PECAM-1/CD31)and vascular endothelial growth factor(VEGF)was detected by Western blotting.RESULTS:miRNA-155 inhibitor significantly reduced miRNA-155 levels in the ischemic cortex(P<0.05),improved the scores of neurological deficit,reduced infarction size and upregulated the levels of CD31 and VEGF(P<0.05).CONCLUSION:miRNA-155 has a critical role in the regulation of angiogenesis in diabetic rats with cerebral ischemia.Down-regulation of miRNA-155 using miRNA-155 inhibitor attenuates brain infarct injury in diabetic rats.
microRNA-155;Diabetes;Cerebral ischemia;Angiogenesis
R363.2+71
A
10.3969/j.issn.1000-4718.2015.02.029
1000-4718(2015)02-354-05
2014-09-26
2014-11-27
贵州省科学技术基金资助项目(黔科合J字LKZ[2012]13号);广东省珠海市医学重点学科项目(No.珠卫
200880 )
△通讯作者Tel:0756-6276307;E-mail:gdshanjq@163.com
