慢性间歇性低氧对大鼠肾脏氧化应激损伤及HIF-1α表达的影响*
2015-05-16李婷李秀翠梁冬施温正旺梅红芳曹红超苏苗赏蔡晓红
李婷,李秀翠,梁冬施,温正旺,梅红芳,曹红超,苏苗赏,蔡晓红△
(1温州医科大学附属第一医院儿科,浙江 温州 325000;温州医科大学附属第二医院,育英儿童医院2儿童神经内科,3儿童急诊科,4儿童感染科,5儿童呼吸科,浙江 温州 325027)
·短篇论著·
慢性间歇性低氧对大鼠肾脏氧化应激损伤及HIF-1α表达的影响*
李婷1,李秀翠2,梁冬施3,温正旺4,梅红芳5,曹红超5,苏苗赏5,蔡晓红5△
(1温州医科大学附属第一医院儿科,浙江 温州 325000;温州医科大学附属第二医院,育英儿童医院2儿童神经内科,3儿童急诊科,4儿童感染科,5儿童呼吸科,浙江 温州 325027)
目的:观察慢性间歇性低氧(CIH)大鼠肾组织形态学及其氧化应激相关指标变化,探讨CIH的肾损害机制。方法:将40只SD大鼠随机分为4组,CIH组2周和4周组(2IH和4IH)以及对照组2周和4周组(2C和4C),每组10只,采用化学比色法检测血清SOD活性,肾脏称重计算肾体比,HE染色、PAS染色和Masson染色法观察肾组织病理结构变化,real-time PCR法检测肾组织HIF-1α、Cu/ZnSOD和MnSOD mRNA的表达变化。结果: (1)各组大鼠平均肾重、体重和肾体比差异无统计学意义(均P>0.05);IH组大鼠肾组织存在病理损害,HE和PAS染色示肾小球系膜和基底膜轻度增生,肾小管上皮水肿,4周组损害较明显;Masson染色IH和对照组均未见纤维化改变。(2)化学比色法示IH组血清SOD活性低于相应对照组(均P<0.05),4IH组下降更明显(P<0.05)。Cu/ZnSOD和MnSOD mRNA组间比较差异有统计学意义(均P<0.05);Cu/ZnSOD mRNA表现为IH组低于相应对照组(均P<0.05),4IH组与2IH组比较差异无统计学意义;MnSOD mRNA的表达4IH组较4C组下调,差异有统计学意义(P<0.05),4IH组明显高于2IH组(P<0.05),2IH和2C组比较差异无统计学意义(P>0.05)。IH组肾组织HIF-1α的mRNA表达均高于相应对照组(均P<0.05),4IH组高于2IH组(P<0.05)。结论:CIH可诱导大鼠肾小球、小管结构异常,但4周CIH尚未引起肾组织纤维化改变。CIH可通过上调HIF-1α mRNA和下调Cu/Zn SOD、MnSOD mRNA的表达,参与氧化应激损伤过程。
间歇性低氧;氧化应激;肾损伤
据流行病学调查显示,儿童的阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hyponea syndrome,OSAHS)的患病率为2%~4.8%[1-2],OSAHS对儿童的生长发育带来极大的危害,其中以学龄前儿童多见。OSAHS可导致全身多系统功能损害,其中包括OSAHS导致肾损害已被临床证实,主要表现为夜间多尿、肾功能改变、蛋白尿、肾小管功能受损等,但其分子机制尚不清楚。睡眠呼吸暂停模式慢性间歇低氧是OSAHS特有的特殊低氧模式,是任何其它低氧性疾病所不能达到和不具备的。反复的低氧-复氧,类似缺血再灌注,细胞线粒体产生较多的活性氧簇(reactive oxygen species,ROS),引起机体氧化应激,是OSAHS导致肾损害的重要的病理生理机制。抗氧化剂,如超氧化物歧化酶(superoxide dismutase,SOD)在抗氧化应激反应中作为主要的催化酶而起重要的保护作用。因此本研究模拟OSAHS的典型病理生理特征,建立慢性间歇低氧(chronic intermittent hypoxia,CIH)的幼鼠模型,观察慢性间歇性低氧暴露后大鼠肾组织形态学改变,并检测肾组织中低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)、MnSOD和Cu/ZnSOD mRNA的表达情况,揭示慢性间歇性低氧产生的氧化应激反应对大鼠肾损害的影响机制。
材料和方法
1 实验动物和主要材料
SPF级SD幼年大鼠(90~110 g,3~4周)购自温州医科大学实验动物中心。
间歇低氧不锈钢饲氧舱自行设计制备;医用压缩氧气(浓度>99.5%)、高纯度压缩氮气(浓度>99.99%)、压缩空气由温州市医用氧厂充装。
2 主要方法
2.1 动物分组SPF级健康雄性SD大鼠,共40只,随机分为4组,每组10只,分别为CIH 2周组(2IH)、4周组(4IH),以及对照组2周组(2C)、4周组(4C)。
2.2 CIH动物模型建立将CIH组置于间歇低氧不锈钢饲氧舱中,设定实验参数如下:在0.3 kPa气压下通氮气30 s,然后停30 s,以25 L/min的通气流量通氧气12 s,然后停18 s,如此构成一个间歇低氧循环,低氧时舱内氧浓度维持在10.0%±1.5%,复氧时氧气浓度维持在21.0%±0.5%,舱内CO2的浓度低于0.01%,每天实验时间持续7.5 h(8:30~16: 00),每周持续7 d,用以模拟中重度OSAHS。对照舱:通入压缩后的空气,其它参数设置相同。实验时拉上窗帘,各个氧舱上盖上黑布,保持舱内黑暗,模拟大鼠夜间睡眠状态,保证舱内温度和室内温度22~24℃,湿度40%~50%。每天实验结束后,将大鼠分组放入另外的笼子里,给予日光灯照射,模拟白天状态。实验时大鼠的活动和饮食不受限制。
2.3 标本采集造模结束后称重,精确到小数点后1位,并记录。每组随机取4只大鼠麻醉后,开胸分离心脏,留取5 mL动脉血,置于4℃冰箱静置2 h,低温离心机4℃4 000 r/min离心l5 min,抽取血清,-80℃冰箱保存,用于检测总SOD活力。余6只大鼠用3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,开腹暴露左右肾,从肾静脉注入预冷的生理盐水灌洗致左、右肾变苍白后取出,在冰板上去除包膜后称重,精确到小数点后2位,记录并计算肾体比[肾体比(%)=肾重/体重×100%]。右肾置4%多聚甲醛中固定。
2.4 肾组织病理染色(HE染色、PAS染色和Masson染色)组织块常规石蜡包埋,4 μm切片,切片常规用二甲苯脱蜡,经各级乙醇至水洗,分别于HE、PAS和Masson染色。肾脏病理损害的评估包括肾小球肿胀、肾小管上皮细胞肿胀及结构紊乱、肾小球系膜增生和肾小球及间质纤维化改变,每项损害严重程度按照0~4分来评估:0=轻微损害,1=轻度损害,2=中度损害,3=重度损害,4=严重损害。全部4项积分为0~16分。
2.5 采用real-time PCR法检测左肾HIF-1α、Cu/Zn-SOD和MnSOD mRNA的表达采用Trizol从肾组织中抽提总RNA,操作按说明书进行,并行RNA纯度及定量检测,并将RNA逆转录成cDNA,用PCR扩增仪进行基因扩增。PCR反应条件为95℃5 min;95℃10 s,60℃10 s,72℃10 s,45个循环扩增。β-actin作为内参照,所用β-actin、HIF-1α、Cu/Zn SOD和MnSOD引物序列由上海生工生物工程有限公司设计并合成,序列见表1。运用Lightcycler 480 15.0软件来记录数据并分析,以2-ΔCt计算目的基因的相对表达量。

表1 引物序列Table 1.The sequences of the primers for real-time PCR
3 统计学处理
除肾脏病理评分之外,各组均为正态计量资料数据,以均数±标准差(mean±SD)表示,肾脏病理评分以中位数(median)表示,用SPSS 21.0统计软件处理。肾脏病理评分多组间采用Kruskal-Wallis检验。其它资料多组间比较采用单因素方差分析(One-way ANOVA),组与组之间的两两比较,若方差齐则用LSD检验,方差不齐则用Dunnett’s T3检验。
结果
1 各组大鼠肾重、体重、肾体比的情况
各组大鼠肾重、体重及肾重/体重比差异均无统计学意义,见表2。

表2 各组肾重、体重及肾体比的比较Table 2.The comparison of renal weight,body weight,ratio of renal weight to body weight in 4 groups(Mean±SD.n=10)
2 各组大鼠肾组织病理学改变
2.1 HE染色2C与4C组肾小球和肾小管上皮结构基本正常,IH组肾小球系膜轻度增生,肾小球塞满整个肾小囊腔,肾小管上皮细胞肿胀,以近端小管为主,4IH组较2IH组改变明显,见图1。
2.2 PAS染色2C与4C组肾小球基底膜和系膜无明显增厚,肾小管上皮细胞刷状缘完整,IH组可见肾小球基底膜和系膜轻度增厚,肾小管上皮细胞刷状缘结构不完整,4IH组较2IH组改变明显,见图1。
2.3 Masson染色IH组(2周组、4周组)和C组(2周组、4周组)肾小球及肾小管间质均无蓝色胶原纤维沉着,见图1。
2.4 病理评分(n=6)病理评分显示IH组(4IH组为5,2IH组为3)比相应空气模拟对照组(2C和4C组均为0.5)病理损害严重,差异有统计学意义(P<0.05),且4IH组比2IH病理损害更明显,差异有统计学意义(P<0.05)。
3 各组大鼠血清SOD活性改变及肾组织HIF-1α、Cu/ZnSOD和MnSOD mRNA的表达变化
3.1 血清SOD活力的变化2IH、4IH组血清中SOD活性分别低于2C、4C组(P<0.05),4IH组明显低于2IH组(P<0.05),2C与4C组比较差异无统计学意义,见图2。
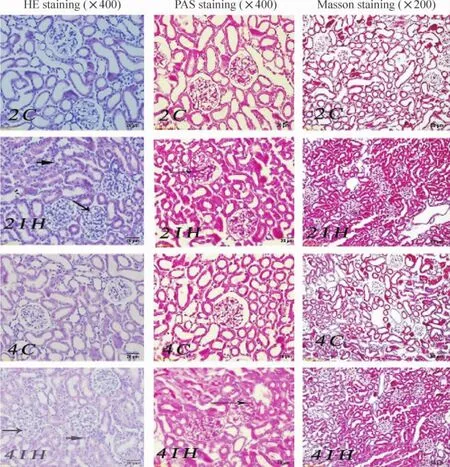
Figure 1.The changes of histological structure in glomeruli and renal tubules from the rats exposed to chronic intermittent hypoxia and the control rats.Normal histological structure of glomeruli and renal tubules were observed in 2C group and 4C group.Mesangial proliferation of glomeruli was seen in 2IH group and 4IH group(long arrow).Thickening membranes within the glomeruli were found in 2IH group and 4IH group(long arrow).Swelling was seen in renal tuble in 2IH group and 4IH group (short arrow).No fibrotic response was observed in Masson staining.图1 各组大鼠肾脏形态学改变
3.2 各组大鼠肾组织HIF-1α、Cu/ZnSOD和MnSOD mRNA的表达变化HIF-1α mRNA在各组间比较差异有统计学意义(P<0.05)。与相应对照组比较,IH组大鼠肾组织HIF-1αm RNA表达均增加(P<0.05),与2IH组比较,4IH组表达显著升高(P<0.05);MnSOD和Cu/ZnSOD mRNA组间比较差异有统计学意义。其中Cu/ZnSOD的mRNA表达量IH组分别低于相应对照组(P<0.05),4IH组与2IH组之间差异无统计学意义。MnSOD mRNA的表达量,2IH组与相应对照组(2C组)比较差异无统计学意义,4IH组与相应对照组(4C组)及2IH组比较均明显下降,差异有统计学意义(P<0.05),见图2。
讨论
OSAHS是一种以间歇性低氧和片段化睡眠为主要病理生理机制的多系统功能障碍性疾病。目前在OSAHS相关心血管并发症及认知功能损害的分子机制研究中,氧化应激损伤是靶器官损害的主要机制[3-4]。OSAHS相关性肾损害可表现为[5-9]夜间多尿、肾功能改变、蛋白尿、肾小管功能受损等。CIH动物模型研究[10-11]模拟OSAHS病理生理改变,发现其可引起肾脏组织结构、超微结构、蛋白组学改变,但均为成年动物。其次,肾脏作为高血流高灌注脏器,对氧供给和氧张力变化较为敏感,容易致缺氧性损伤,儿童尤甚。本研究选择3~4周龄SD幼鼠,利用自行研制的间歇性低氧氧舱,采用90 s 10%O2的间歇性低氧模式,主要用于探讨OSAHS对儿童肾组织的影响。。根据我们前期的研究[12],90 s 10%O2模式的间歇性低氧相当于人类中重度OSAHS的病理生理改变。本研究显示中重度间歇性低氧复氧的暴露,肾重体重比无明显改变,但病理评分显示低氧组肾脏损伤严重,表现为肾小球及小管结构出现了改变。肾慢性缺氧是引起肾间质纤维化的关键因素,低氧可上调近曲小管上皮细胞和肾脏成纤维细胞TGF-β表达。本研究应用Masson染色观察肾小管间质及肾小球纤维化改变,发现2周和4周IH组均未引起肾组织纤维化改变;Sun等[13]在成年小鼠的研究也显示间歇性低氧暴露8周后肾组织才开始出现纤维化改变,表明CIH引起肾组织纤维化改变与间歇性低氧时间长短以及低氧程度有关。
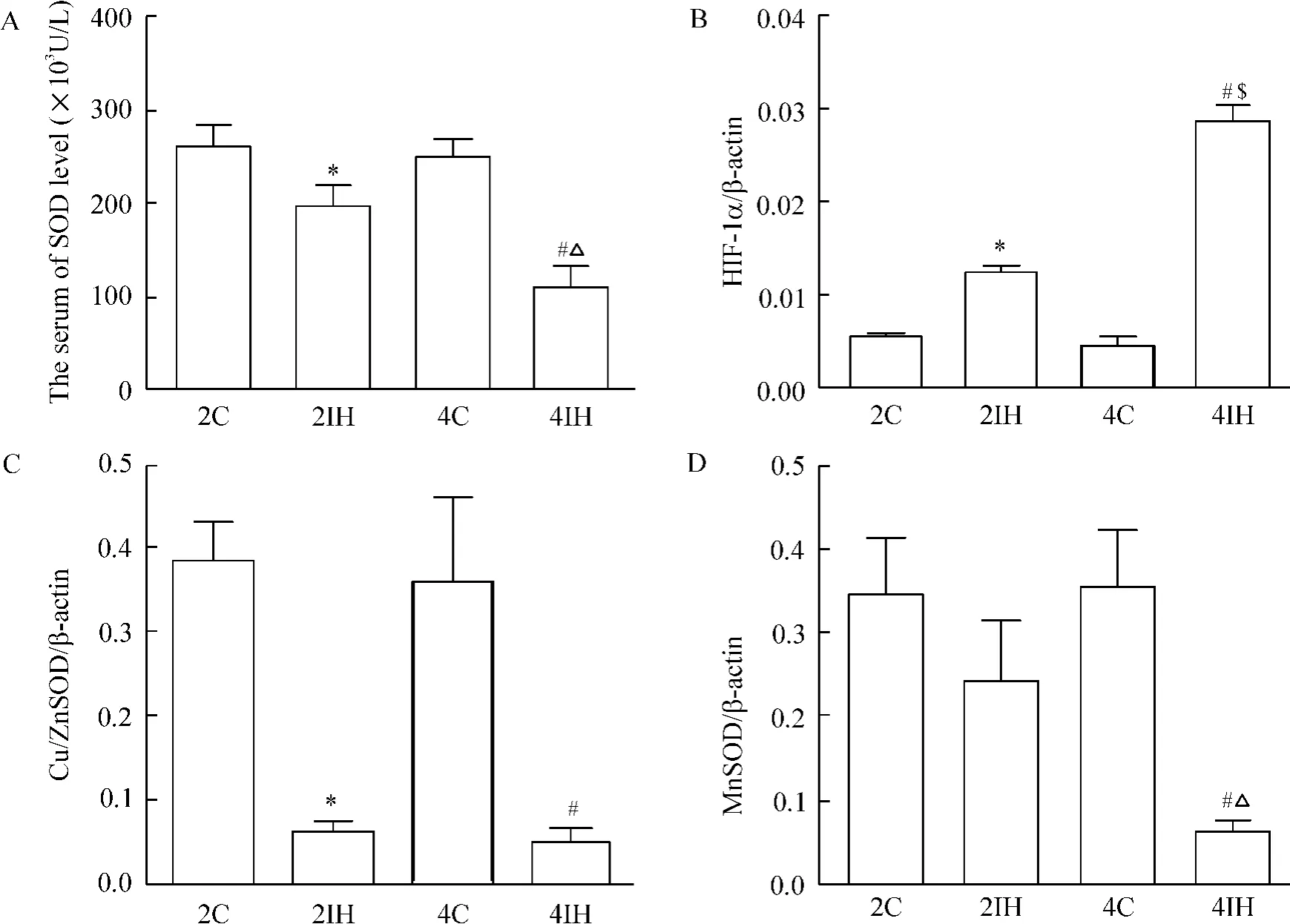
Figure 2.The changes of the oxidative stress markers in the serum and kidney of the rats with different treatments.A:the serum SOD level were measured by xanthine oxidase methods;B~D:real-time PCR was used to detect the mRNA expression of HIF-1α,Cu/ZnSOD and MnSOD in the kidney.Mean±SD.n=6.*P<0.05 vs 2C group;#P<0.05 vs 4C group;△P<0.05 vs 2IH group.图2 大鼠血清SOD活性及肾组织HIF-1α、Cu/ZnSOD和MnSOD mRNA的相对表达量
慢性间歇性低氧复氧是OSAHS特征性低氧方式,不同于持续性低氧过程,为一种更严重的低氧,其病理生理过程类似于缺血再灌注损伤。HIF-1是调控氧平衡的转录因子,为氧敏感的α亚基和稳定表达的β亚基组成的异源二聚体结构,局部组织HIF-1α含量可间接反映组织细胞缺氧情况。持续低氧主要通过介导低氧适应性反应增加HIF-1α的表达,间歇低氧也可上调HIF-1α表达,但其所依赖的信号转导途径不同于持续低氧反应[14]。王赞峰等[15]的研究发现间断低氧处理30 d后,大鼠脑内HIF-1α mRNA和蛋白表达明显增强,免疫组化显示HIF-1α的分布区域与TUNEL阳性细胞一致,反映高表达的HIF-1α参与神经系统慢性间断低氧的应答。da Rosa等[16]发现慢性间歇性低氧下小鼠肺组织和肝脏HIF-1α蛋白表达上调。因此肾组织HIF-1α mRNA的表达变化可反映CIH条件下肾组织缺氧情况。本研究应用实时定量PCR方法检测肾组织中与低氧相关的HIF-1α mRNA表达,显示在IH暴露下其表达上调,呈时间依赖性增加,说明在CIH条件下SD大鼠肾组织存在低氧。
多项临床研究显示,OSAHS患者体内存在氧化应激[3,17-20]和抗氧化能力的下降[21]。SODs是体内一线抗氧化反应的酶,铜/锌超氧化物歧化酶(copper/zinc superoxide dismutase,Cu/ZnSOD)和锰超氧化物歧化酶(manganese superoxide dismutase,Mn-SOD)是其最主要的2种类型,Cu/ZnSOD主要表达于胞浆中,MnSOD主要位于线粒体。本研究通过化学比色法测定CIH大鼠血清中总SOD活性,发现SOD活性下降,与暴露时间呈负相关,说明CIH SD大鼠体内存在氧化应激,表现为抗氧化能力下降。同时本研究用实时荧光定量法检测肾组织中反映抗氧化能力的2种酶Cu/ZnSOD和MnSOD mRNA的表达,发现IH组2种SOD酶基因表达均下调,间接表明了间歇性低氧诱导了肾组织的氧化应激。MnSOD可维持线粒体正常功能,其活性下降失活导致线粒体损伤,最终导致氧化应激的发生。李光等[22]研究发现2周间歇性低氧主要下调胰腺β细胞MnSOD表达。Nanduri等[23]的研究也显示,PC12细胞经间歇性低氧暴露后主要表现为MnSOD表达下调,其它抗氧化酶不变,上述研究表明间歇性低氧的暴露主要引起MnSOD表达的下调,本研究显示间歇低氧组早期下调胞浆Cu/ZnSOD的表达,随着缺氧时间延长,引起线粒体MnSOD表达的下调,表明CIH大鼠出现了氧化应激反应,导致肾组织结构的损害。
综上所述,CIH可通过上调HIF-1 mRNA表达、下调Cu/Zn SOD和MnSOD mRNA表达,参与大鼠肾组织氧化应激损伤。
[1]Wildhaber JH,Moeller A.Sleep and respiration in children:time to wake up![J].Swiss Med Wkly,2007,137(49-50):689-694.
[2]Li AM,So HK,Au CT,et al.Epidemiology of obstructive sleep apnoea syndrome in Chinese children:a two-phase community study[J].Thorax,2010,65(11):991-997.
[3]Jurado-Gamez B,Fernandez-Marin MC,Gomez-Chaparro JL,et al.Relationship of oxidative stress and endothelial dysfunction in sleep apnoea[J].Eur Respir J,2011,37 (4):873-879.
[4]Nair D,Dayyat EA,Zhang SX,et al.Intermittent hypoxia-induced cognitive deficits are mediated by NADPH oxidase activity in a murine model of sleep apnea[J].PLoS One,2011,6(5):e19847.
[5]Chou YT,Lee PH,Yang CT,et al.Obstructive sleep apnea:a stand-alone risk factor for chronic kidney disease[J].Nephrol Dial Transplant,2011,26(7):2244-2250.
[6]Nicholl DD,Ahmed SB,Loewen AH,et al.Declining kidney function increases the prevalence of sleep apnea and nocturnal hypoxia[J].Chest,2012,141(6): 1422-1430.
[7]Uyar M,Davutoglu V.Obstructive sleep apnoea:a standalone risk factor for chronic kidney disease[J].Nephrol Dial Transplant,2011,26(8):2718.
[8]Mallamaci F,Tripepi G.Comment accompanying:obstructive sleep apnoea:a stand-alone risk factor for chronic kidney disease by Chou Yu-Ting[J].Nephrol Dial Transplant,2011,26(7):2072-2074.
[9]Turek NF,Ricardo AC,Lash JP.Sleep disturbances as nontraditional risk factors for development and progression of CKD:review of the evidence[J].Am J Kidney Dis, 2012,60(5):823-833.
[10]宋爱玲,曾奕明.慢性间断性缺氧对小鼠肾组织结构、基质金属蛋白酶及其组织抑制因子表达的影响[J].国际呼吸杂志,2007,27(11):808-812.
[11]张春燕,杨烨,陈燕,等.慢性间歇性缺氧大鼠肾脏组织表达蛋白质组的变化[J].泸州医学院学报,2011,34(3):255-257.
[12]李秀翠,蔡晓红,温正旺,等.间歇性低氧动物模型的建立及验证[J].医学研究杂志,2012,41(7):57-61.
[13]Sun W,Yin X,Wang Y,et al.Intermittent hypoxia-induced renal antioxidants and oxidative damage in male mice:hormetic dose response[J].Dose Response,2012,11(3):385-400.
[14]Yuan G,Nanduri J,Khan S,et al.Induction of HIF-1alpha expression by intermittent hypoxia:involvement of NADPH oxidase,Ca2+signaling,prolyl hydroxylases,and mTOR[J].J Cell Physiol,2008,217(3):674-685.
[15]王赞峰,代冰,康健.慢性间断低氧对大鼠脑内缺氧诱导因子-1α表达和神经细胞凋亡的影响[J].中国病理生理杂志,2010,26(3):593-595.
[16]da Rosa DP,Forgiarini LF,Baronio D,et al.Simulating sleep apnea by exposure to intermittent hypoxia induces inflammation in the lung and liver[J].Mediators Inflamm,2012,2012:879419.
[17]Lavie L,Vishnevsky A,Lavie P.Evidence for lipid peroxidation in obstructive sleep apnea[J].Sleep,2004,27 (1):123-128.
[18]Westhoff M,Litterst P.Obstructive sleep apnoea and oxidative stress[J].Pneumologie,2012,66(10):610-615.
[19]Baysal E,Taysi S,Aksoy N,et al.Serum paraoxonase,arylesterase activity and oxidative status in patients with obstructive sleep apnea syndrome(OSAS)[J].Eur Rev Med Pharmacol Sci,2012,16(6):770-774.
[20]Ntalapascha M,Makris D,Kyparos A,et al.Oxidative stress in patients with obstructive sleep apnea syndrome[J].Sleep Breath,2013,17(2):549-555.
[21]Katsoulis K,Kontakiotis T,Spanogiannis D,et al.Total antioxidant status in patients with obstructive sleep apnea without comorbidities:the role of the severity of the disease[J].Sleep Breath,2011,15(4):861-866.
[22]李光,柴文戍,康健.间歇低氧小鼠胰腺β细胞凋亡及其机制的实验研究[J].中国病理生理杂志,2011,27(4):794-797.
[23]Nanduri J,Wang N,Yuan G,et al.Intermittent hypoxia degrades HIF-2alpha via calpains resulting in oxidative stress:implications for recurrent apnea-induced morbidities[J].Proc Natl Acad Sci U S A,2009,106(4): 1199-1204.
Effect of chronic intermittent hypoxia on renal oxidative stress damage and HIF-1α expression in rats
LI Ting1,LI Xiu-cui2,LIANG Dong-shi3,WEN Zheng-wang4,MEI Hong-fang5,CAO Hong-chao5,SU Miao-shang5,CAI Xiao-hong5
(1Department of Pediatrics,The First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China;2Department of Neurology,3Department of Emergency,4Department of Infectious Disease,5Department of Respiratory Disease,The Second Affiliated Hospital of Wenzhou Medical University,Wenzhou 325027,China.E-mail:caixh839@sina.com)
AIM:To investigate the mechanism of renal damage in chronic intermittent hypoxia(CIH)rat model.METHODS:The Sprague-Dawley rats were randomly divided into 2-week CIH group(2IH),2-week simulated air control group(2C),4-week CIH group(4IH)and 4-week simulated air control group(4C).HE staining,PAS staining and Masson staining were used for histological evaluation.Blood was collected for the measurement of superoxide dismutase(SOD).The mRNA expression of hypoxia-inducible factor-1α(HIF-1α),manganese superoxide dismutase(MnSOD),copper/zinc superoxide dismutase(Cu/ZnSOD)was detected by real-time PCR.RESULTS:(1)No significance difference of renal weight,body weight,and the ratio of renal weight to body weight was observed,while IH caused morphologic kidney damage,especially in 4IH group.Hypertrophy of epithelial cells in the kidney tubles and dilation in the glomeruli were observed under light microscope with HE and PAS staining,especially in 4IH group.Masson staining showed no significant fibrotic response in the kidney of the rats exposed to IH.(2)The SOD levels in the serum and kidney were decreased after CIH.Compared with the corresponding control groups,the levels of serum SOD were significantly lower in CIH groups,especially in 4IH group.The mRNA expression of Cu/ZnSOD and MnSOD in CIH groups decreased significantly as compared with control groups.The mRNA levels of HIF-1α were significantly higher in CIH groups than those in the corresponding control groups.CONCLUSION:CIH induces abnormalities of glomeruli and convoluted tubules,while 4-week IH exposure has not led to fibrotic response.CIH participates in the process of renal oxidative stress damage by upregulating HIF-1α transcription and downregulating Cu/ZnSOD and MnSOD transcription.
Intermittent hypoxia;Oxidative stress;Renal injury
R363;R725.6
A
10.3969/j.issn.1000-4718.2015.02.028
1000-4718(2015)02-348-06
2014-07-25
2014-12-09
浙江省科技厅项目(No.2013C33174);浙江省自然科学基金资金项目(No.Y2110277);温州市科技计划项目(No.H20130001);浙江省卫生厅项目(No.2011RCB027;No.2013RCA037;No.2014ZDA014);国家卫计委国家重点临床专
科开放课题(No.20130209)
△通讯作者Tel:0577-88832693;E-mail:caixh839@sina.com
