槲皮素抑制异烟肼诱导的L-02细胞线粒体氧化应激性DNA损伤*
2015-05-16卢春凤王淑秋陈廷玉张明远王淑湘王建杰袁庆
卢春凤,王淑秋,陈廷玉,张明远,王淑湘,王建杰,袁庆
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
槲皮素抑制异烟肼诱导的L-02细胞线粒体氧化应激性DNA损伤*
卢春凤,王淑秋△,陈廷玉,张明远,王淑湘,王建杰,袁庆
(佳木斯大学基础医学院,黑龙江 佳木斯 154007)
目的:探讨活性氧(ROS)介导的线粒体氧化损伤在异烟肼(INH)诱导L-02细胞DNA损伤中的作用及槲皮素对细胞的保护作用。方法:建立体外培养INH致肝细胞L-02损伤的模型,将细胞分为对照(control)组、INH组、槲皮素低剂量(Que low)及高剂量(Que high)组。利用彗星试验评价细胞DNA损伤;制备L-02细胞线粒体,应用荧光探针DCFH-DA和rhodamine 123检测细胞线粒体ROS水平及线粒体膜电位(ΔΨm);采用TBA法测定丙二醛(MDA)含量;应用黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)的活性;采用Western blotting法检测细胞中Bcl-2和Bax蛋白表达,计算Bax/Bcl-2值。结果:INH可诱导L-02细胞DNA损伤,使细胞线粒体ROS水平、细胞MDA含量及Bax/Bcl-2值明显增高,并使细胞ΔΨm值和SOD活性明显下降。而槲皮素能减轻细胞DNA损伤,减少细胞ROS水平,增加细胞ΔΨm值,降低细胞MDA含量,增加SOD活性,减少Bax/Bcl-2值。结论:INH可通过诱导细胞线粒体氧化应激导致L-02细胞DNA损伤。槲皮素能减轻INH诱导L-02细胞的DNA损伤,对L-02细胞具有保护作用,可能与其抑制ROS介导的线粒体氧化损伤有关。
槲皮素;异烟肼;线粒体氧化损伤;L-02细胞;DNA损伤
氧化应激是许多药物引起肝脏毒性的主要机制,线粒体是细胞活性氧(reactive oxygen species,ROS)产生的主要场所,也是氧化损伤的主要靶点[1]。异烟肼(isonicotinyl hydrazide,INH)有很多不良反应,最严重的是肝脏损伤,但到目前为止其肝脏毒性的具体机制尚未阐明[2]。槲皮素(quercetin,Que)属类黄酮物质,广泛存在于水果、蔬菜和一些中草药中,是具有临床应用前景的抗氧化剂。因此,本实验以体外培养的人肝细胞L-02为研究对象,利用差速离心法制备细胞线粒体,在亚细胞水平上研究ROS介导的线粒体氧化损伤在INH诱导L-02细胞DNA损伤中的作用,进一步探讨INH的肝细胞毒性机制及槲皮素的保护效应和机制,以期为临床防治INH的肝脏毒性提供一定的实验依据。
材料和方法
1 细胞和主要试剂
正常人肝细胞L-02购自中国科学院上海细胞库;胎牛血清为HyClone产品;DMEM培养基为Gibco产品;槲皮素、异烟肼(INH)、DCFH-DA和rhodamine 123均为Sigma产品;正常熔点琼脂糖和低熔点琼脂糖均为Amresco产品;丙烯酰胺和甲叉双丙烯酰胺均为Merck产品;兔抗Bcl-2和Bax多克隆抗体为Santa Cruz产品;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒购自南京建成生物工程研究所。
2 方法
2.1 细胞培养及处理用含10%胎牛血清的DMEM培养基常规培养L-02细胞,镜下观察细胞生长情况,取生长状态良好的细胞进行试验。将细胞分为4组:对照组(加入与处理组相同体积的无血清培养基);INH(10 mmol/L)组;槲皮素低剂量(25 μmol/L)组;槲皮素高剂量(50 μmol/L)组。
2.2 指标检测按上述分组将L-02细胞处理24 h后,收集细胞,利用彗星试验评价细胞DNA损伤情况,用CASP彗星分析软件进行图像分析,分析指标包括DNA的尾长(tail length)、尾部DNA(tail DNA)百分含量和尾矩(tail moment)。差速离心法制备L-02细胞线粒体,应用荧光探针DCFH-DA和rhodamine 123检测细胞线粒体ROS水平及线粒体膜电位(ΔΨm);采用TBA法测定细胞内脂质过氧化产物MDA的含量;应用黄嘌呤氧化酶法评估细胞内抗氧化酶SOD的活性;采用Western blotting法检测细胞中凋亡调控蛋白Bcl-2和Bax表达,并计算Bax/Bcl-2值。
3 统计学处理
数据以均数±标准差(mean±SD)表示。应用SPSS 11.0软件进行统计分析,并用Origin 7.5作图。组间均数比较采用单因素方差进行分析,以P<0.05为差异有统计学意义。
结果
1 槲皮素和INH对细胞DNA损伤的影响
槲皮素和INH处理L-02细胞24 h后,进行单细胞凝胶电泳,然后在荧光显微镜下观察细胞DNA损伤情况:正常组细胞的DNA大部分呈圆形荧光团,无拖尾现象;INH组的细胞DNA有拖尾现象,呈现不同程度的头尾分明的典型彗星图像;槲皮素组的细胞DNA拖尾现象明显减轻,高剂量组的效果更明显。应用CASP彗星分析软件进行图像分析发现,与对照组相比,INH组细胞DNA的尾长、尾部DNA百分含量和尾矩均显著增加(P<0.01),表明INH诱导了细胞DNA损伤;槲皮素组细胞DNA的尾长、尾部DNA百分含量和尾矩均明显减少,与INH组相比差异有统计学意义(P<0.05或P<0.01),表明槲皮素减轻了INH对细胞DNA的损伤,对L-02细胞有保护作用,且高剂量组的保护作用更显著,见图1~3。
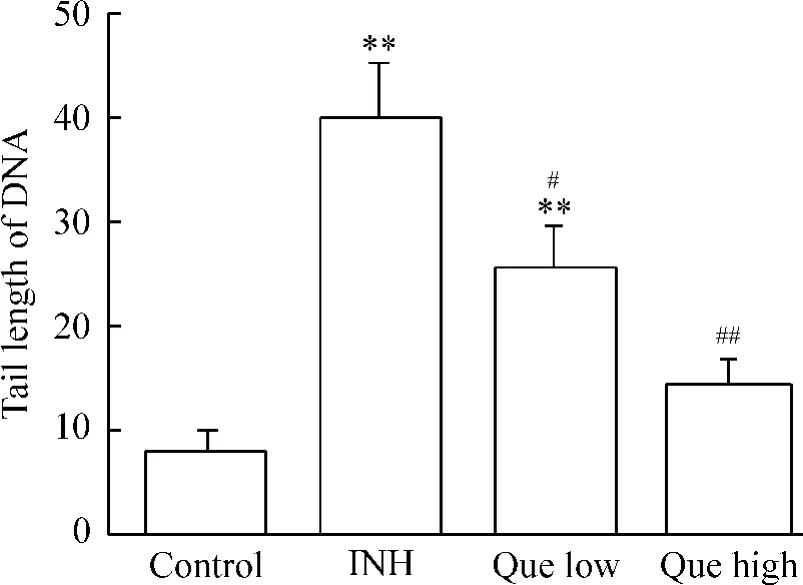
Figure 1.The effects of quercetin and INH on tail length of DNA in L-02 cells.Mean±SD.n=6.**P<0.01 vs control group;#P<0.05,##P<0.01 vs INH group.图1 槲皮素和INH对L-02细胞DNA尾长的影响

Figure 2.The effects of quercetin and INH on tail DNA of DNA in L-02 cells.Mean±SD.n=6.**P<0.01 vs control group;#P<0.05,##P<0.01 vs INH group.图2 槲皮素和INH对L-02细胞尾部DNA百分含量的影响

Figure 3.The effects of quercetin and INH on tail moment of DNA in L-02 cells.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs INH group.图3 槲皮素和INH对L-02细胞DNA尾矩的影响
2 槲皮素和INH对细胞线粒体ROS生成的影响
由图4可见,经INH处理L-02细胞后,与对照组相比,细胞线粒体的ROS水平显著增高(P<0.01),表明INH可诱导细胞线粒体ROS的生成;槲皮素组的细胞线粒体ROS水平均明显降低,与INH组相比,差异有统计学意义(P<0.05或P<0.01),表明槲皮素可抑制细胞线粒体ROS的生成,且高剂量组抑制细胞线粒体ROS生成的作用更显著。

Figure 4.The effects of quercetin and INH on the mitochondrial ROS generation in L-02 cells.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs INH group.图4 槲皮素和INH对L-02细胞线粒体ROS生成的影响
3 槲皮素和INH对线粒体膜电位的影响
由图5可见,经INH处理L-02细胞后,与对照组相比,细胞ΔΨm值显著下降(P<0.01),表明INH可造成细胞线粒体损伤;槲皮素组的细胞ΔΨm值均明显增高,与INH组相比,差异有统计学意义(P<0.05或P<0.01),表明槲皮素对细胞线粒体有保护作用,且高剂量组对细胞线粒体的保护作用更明显。

Figure 5.The effects of quercetin and INH on ΔΨmin L-02 cells.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs INH group.图5 槲皮素和INH对L-02细胞线粒体膜电位的影响
4 槲皮素和INH对细胞丙二醛(malondialdehyde,MDA)含量的影响
由图6可见,经INH处理L-02细胞后,与对照组相比,细胞的MDA含量明显增加(P<0.01),表明INH可使细胞发生脂质过氧化反应;槲皮素组细胞的MDA含量均明显减少,与INH组相比,差异有统计学意义(P<0.05或P<0.01),表明槲皮素有抗脂质过氧化作用,且高剂量组的作用更显著。

Figure 6.The effects of quercetin and INH on the content of MDA in L-02 cells.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs INH group.图6 槲皮素和INH对L-02细胞MDA含量的影响
5 槲皮素和INH对细胞SOD活性的影响
由图7可见,经INH处理L-02细胞后,与对照组相比,细胞的SOD活性显著降低(P<0.01),表明INH可降低细胞的抗氧化能力;槲皮素组细胞的SOD活性均明显增高,与INH组相比,差异有统计学意义(P<0.05或P<0.01),表明槲皮素增加细胞的抗氧化能力,且高剂量组的作用更显著。
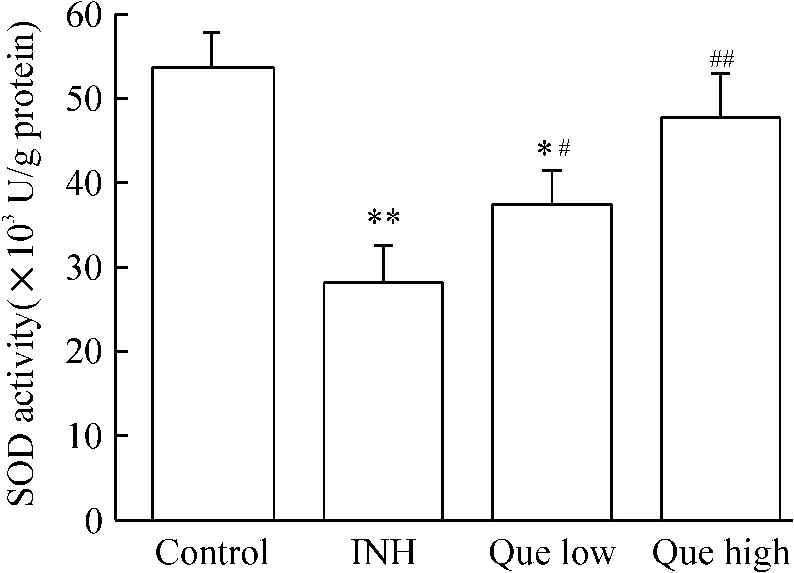
Figure 7.The effects of quercetin and INH on the activity of SOD in L-02 cells.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs INH group.图7 槲皮素和INH对L-02细胞SOD活性的影响
6 槲皮素和INH对细胞凋亡调控蛋白Bcl-2和Bax表达的影响
经INH处理L-02细胞后,与对照组相比,细胞的Bcl-2蛋白表达明显减少,而Bax蛋白表达明显增加,Bax/Bcl-2值显著增高(P<0.01);槲皮素高剂量组细胞Bcl-2蛋白表达明显增多,而Bax蛋白表达明显减少,Bax/Bcl-2值明显降低,与INH组相比,差异有统计学意义(P<0.05),见图8。

Figure 8.The effects of quercetin and INH on the ratio of Bax/ Bcl-2 in L-02 cells.Mean±SD.n=6.*P<0.05,**P<0.01 vs control group;#P<0.05 vs INH group.图8 槲皮素和INH对L-02细胞Bax/Bcl-2值的影响
讨论
正常情况下,细胞内氧自由基的产生与清除处于动态平衡状态,当细胞内ROS等自由基生成增加和/或抗氧化系统的清除能力降低,细胞将会发生氧化应激反应,引起细胞内大分子物质发生氧化损伤,从而造成细胞损伤[3]。线粒体是细胞产生ROS的主要场所,也是多数有毒化合物攻击的主要靶点。研究表明,ROS过多生成可损伤线粒体膜,导致ΔΨm值下降[4-5]。
为了观察INH是否能诱导L-02细胞DNA损伤,进而研究槲皮素的作用及机制,我们利用彗星试验评价了细胞DNA损伤情况,评价指标包括细胞DNA的尾长、尾部DNA百分含量和尾矩,其中,尾长是指DNA从细胞中心迁移的距离,在低损伤剂量范围内与DNA损伤呈线性关系;尾部DNA百分含量反映细胞拖尾中DNA碎片的多少,尾部DNA百分含量与损伤程度有关;尾矩是指从彗星头部的右边界到彗星尾部末端的距离与尾部DNA百分含量的乘积,也与损伤程度呈线性关系。实验结果显示,INH能诱导L-02细胞DNA损伤,而槲皮素对受损伤细胞有保护作用。那么INH诱导L-02细胞DNA损伤是否与ROS及线粒体损伤有关?因此,本实验检测了细胞线粒体ROS水平及ΔΨm值。ROS是细胞内主要的氧自由基,它的水平能反映细胞内氧化系统的情况;ΔΨm值是反映线粒体功能的关键指标,ΔΨm值降低提示细胞发生线粒体损伤[6]。L-02细胞经INH处理后,细胞线粒体ROS生成显著增多,ΔΨm值明显下降;而槲皮素能明显减少细胞线粒体ROS生成,并增加细胞ΔΨm值,提示INH能促进细胞线粒体ROS生成,导致细胞线粒体损伤;槲皮素能减轻INH诱导的细胞线粒体损伤。
INH能造成细胞线粒体损伤,那么INH诱导L-02细胞DNA损伤是否与ROS介导的氧化损伤有关?因此,本实验进一步检测了氧化损伤的重要指标MDA和SOD。MDA是典型的脂质过氧化产物,其含量的多少可反映细胞发生脂质过氧化的程度,间接反映细胞发生氧化损伤的程度;SOD能清除自由基,是细胞内重要的抗氧化物酶,其活性的高低可反映细胞的抗氧化能力[7]。研究表明,槲皮素在体外可通过与金属离子结合、清除ROS等自由基及抑制DNA损伤等发挥抗氧化作用[8-10]。此外,体内实验已证实槲皮素可通过降低脂质过氧化物水平、增加抗氧化系统的能力对氧化损伤的肝脏发挥保护效应[11]。实验结果发现,L-02细胞经INH处理后,细胞中MDA含量显著增高,而SOD的活性显著降低,表明在本实验条件下INH可诱导L-02细胞发生氧化损伤。这提示INH进入细胞内,可能诱导细胞线粒体大量生成ROS,降低细胞SOD活性,使细胞内氧化与抗氧化系统失衡,导致线粒体损伤,进而诱发氧化应激反应,使线粒体受损,引起ΔΨm值下降,氧化产物MDA含量增加,DNA链断裂,造成细胞损伤及细胞凋亡[12]。实验还发现,槲皮素能减少细胞MDA含量,增加SOD的活性,表明槲皮素能减轻INH诱导的L-02细胞氧化损伤,可能是通过清除细胞线粒体ROS,提高细胞内抗氧化系统的能力,抑制线粒体氧化应激反应,从而发挥其作用。
此外,本实验还检测了Bcl-2和Bax蛋白表达,并计算Bax/Bcl-2值。Bcl-2和Bax是调控细胞凋亡重要蛋白,Bax是促凋亡蛋白,而Bcl-2是抑凋亡蛋白[13],一般认为Bax和Bcl-2的比值是决定细胞是否发生凋亡的关键因素。研究表明,细胞ΔΨm值下降可促进Bax由细胞浆转位至线粒体膜,进而启动线粒体凋亡途径,激活caspase蛋白酶家族,使DNA降解,造成DNA损伤[14-15]。实验结果发现,INH能下调细胞Bcl-2蛋白表达,上调Bax蛋白表达,增加Bax/Bcl-2值,表明INH可诱导细胞凋亡;高剂量槲皮素能上调细胞Bcl-2蛋白表达,下调Bax蛋白表达,使Bax/Bcl-2值降低,表明槲皮素可通过调整Bax和Bcl-2的比例发挥其抗凋亡的作用,进而保护细胞免受损伤。
综上所述,在本实验条件下,INH能诱导L-02细胞DNA损伤,ROS介导的细胞线粒体氧化损伤在此过程中发挥了重要作用。槲皮素能减轻INH诱导L-02细胞的DNA损伤效应,对L-02细胞具有保护作用,可能与其抑制ROS介导的线粒体氧化损伤有关。
[1]Zorov DB,Juhaszova M,Sollott SJ.Mitochondrial reactive oxygen species(ROS)and ROS-induced ROS release[J].Physiol Rev,2014,94(3):909-950.
[2]Gourishankar A,Navarro F,DebRoy AN,et al.Isoniazid hepatotoxicity with clinical and histopathology correlate[J].Ann Clin Lab Sci,2014,44(1):87-90.
[3]Cortes-Rojo C,Rodriguez-Orozco AR.Importance of oxidative damage on the electron transport chain for the rational use of mitochondria-targeted antioxidants[J].Mini Rev Med Chem,2011,11(7):625-632.
[4]Nabben M,Shabalina IG,Moonen-Kornips E,et al.Uncoupled respiration,ROS production,acute lipotoxicity and oxidative damage in isolated skeletal muscle mitochondria from UCP3-ablated mice[J].Biochim Biophys Acta,2011,1807(9):1095-1105.
[5]熊燕,张梅,陈菲,等.线粒体功能障碍与心血管疾病[J].中国病理生理杂志,2013,29(2):364-370.
[6]Gong SS,Peng YY,Jiang PP,et al.A deafness-associated tRNAHismutation alters the mitochondrial function,ROS production and membrane potential[J].Nucleic Acids Res,2014,42(12):8039-8048.
[7]Qiao H,Dong L,Zhang X,et al.Protective effect of luteolin in experimental ischemic stroke:upregulated SOD1,CAT,Bcl-2 and claudin-5,down-regulated MDA and Bax expression[J].Neurochem Res,2012,37(9):2014-2024.
[8]Abarikwu SO,Pant AB,Farombi EO.Dietary antioxidant,quercetin,protects sertoli-germ cell coculture from atrazine-induced oxidative damage[J].J Biochem Mol Toxicol,2012,26(11):477-485.
[9]苗成,李金国,苗芳,等.槲皮素对ox-LDL所致的小鼠巨噬细胞脂质蓄积和过氧化的影响[J].中国病理生理杂志,2013,29(8):1370-1374.
[10]Li Y,Deng Y,Tang Y,et al.Quercetin protects rat hepatocytes from oxidative damage induced by ethanol and iron by maintaining intercellular liable iron pool[J].Hum Exp Toxicol,2014,33(5):534-541.
[11]Kukongviriyapan U,Sompamit K,Pannangpetch P,et al.Preventive and therapeutic effects of quercetin on lipopolysaccharide-induced oxidative stress and vascular dysfunction in mice[J].Can J Physiol Pharmacol,2012,90 (10):1345-1353.
[12]Sharma V,Anderson D,Dhawan A.Zinc oxide nanoparticles induce oxidative DNA damage and ROS-triggered mitochondriamediatedapoptosisinhumanlivercells (HepG2)[J].Apoptosis,2012,17(8):852-870.
[13]Lee JS,Jung WK,Jeong MH,et al.Sanguinarine induces apoptosis of HT-29 human colon cancer cells via the regulation of Bax/Bcl-2 ratio and caspase-9-dependent pathway[J].Int Toxicol,2012,31(1):70-77.
[14]曹军军,杨茂伟,郭宝磊,等.枸橼酸铁铵通过提高ROS水平激活MAPK通路并诱导成骨细胞凋亡[J].中国病理生理杂志,2013,29(3):476-480.
[15]Jane EP,Premkumar DR,Morales A,et al.Inhibition of phosphatidylinositol 3-kinase/AKTsignalingbyNVPBKM120 promotes ABT-737-induced toxicity in a caspasedependent manner through mitochondrial dysfunction and DNA damage response in established and primary cultured glioblastoma cells[J].J Pharmacol Exp Ther,2014,350 (1):22-35.
Protective effect of quercetin on L-02 cells by inhibiting DNA damage of INH-induced mitochondrial oxidative stress
LU Chun-feng,WANG Shu-qiu,CHEN Ting-yu,ZHANG Ming-yuan,WANG Shu-xiang,WANG Jian-jie,YUAN Qing
(Basic Medical College,Jiamusi University,Jiamusi 154007,China.E-mail:wang_shuq@163.com)
AIM:To investigate the role of reactive oxygen species(ROS)-mediated mitochondrial oxidative injury in isonicotinyl hydrazide(INH)-induced DNA damage and the protective effect of quercetin on L-02 cells.METHODS:The injury model of hepatocyte L-02cells in vitro induced by INH was established.The cells were divided into control group,INH group,low-dose quercetin group and high-dose quercetin group.The DNA damage of L-02 cells was evaluated by the comet test.The mitochondrion was prepared,and the level of mitochondrial ROS and the value of mitochondrial membrane potential(ΔΨm)were detected by fluorescent probes DCFH-DA and rhodamine 123.The content of MDA was measured by TBA method.The activity of SOD was assessed with the xanthine oxidase method.The protein expression of Bcl-2 and Bax was determined by Western blotting,and the value of Bax/Bcl-2 was calculated.RESULTS:INH induced obvious DNA damage,increased the level of mitochondrial ROS,the content of MDA and the value of Bax/ Bcl-2,and markedly reduced the value of ΔΨmand the activity of SOD in the L-02 cells.Quercetin attenuated DNA damage,reduced the level of mitochondrial ROS,elevated the value of ΔΨm,declined the content of MDA,increased the activity of SOD and decreased the value of Bax/Bcl-2 in the L-02 cells.CONCLUSION:INH induces DNA damage in L-02 cells by generation of mitochondrial oxidative stress.Quercetin has a protective effect on L-02 cells to attenuate the INH-induced DNA damage by inhibiting ROS-mediated mitochondrial oxidative damage.
Quercetin;Isoniazid;Mitochondrial oxidative damage;L-02 cells;DNA damage
R363
A
10.3969/j.issn.1000-4718.2015.02.021
1000-4718(2015)02-308-05
2014-09-03
2014-10-23
国家自然科学基金资助项目(No.81373497);黑龙江省自然科学基金资助项目(No.D201248);佳木斯大学科学技术研究项目(No.Sjz2012-09)
△通讯作者Tel:0454-8618518;E-mail:wang_shuq@163.com
