TLR4通过NF-κB信号途径对宫颈癌细胞增殖的影响
2015-05-16颜伟许芳根刘安文蔡婧王硕
颜伟,许芳根,刘安文△,蔡婧,王硕
(南昌大学第二附属医院1肿瘤科,2消化内科,江西 南昌 330006)
TLR4通过NF-κB信号途径对宫颈癌细胞增殖的影响
颜伟1,许芳根2,刘安文1△,蔡婧1,王硕1
(南昌大学第二附属医院1肿瘤科,2消化内科,江西 南昌 330006)
目的:研究Toll样受体4(Toll-like receptor 4,TLR4)小干扰RNA(siRNA)是否通过NF-κB信号途径下调Bcl-2而抑制宫颈癌细胞的增殖。方法:设计并合成针对TLR4基因的3条特异性siRNA)及阴性siRNA,并同时设立空白对照,然后用脂质体LipofectamineTM2000转染细胞。通过半定量RT-PCR和Western印迹法分别检测转染前后HeLa细胞中TLR4 mRNA和蛋白表达水平,Western印迹法检测p65及Bcl-2蛋白表达水平,MTT法和平板克隆检测细胞增殖率,Annexin V-FITC/PI染色流式细胞术检测细胞凋亡,流式细胞术检测细胞周期。结果:3条针对TLR4基因的siRNA均能抑制TLR4的mRNA和蛋白表达,其中TLR4-siRNA-003的沉默效率最高。转染TLR4-siRNA-003 48 h后细胞中TLR4的mRNA和蛋白表达水平分别下调62%和89%,p65及Bcl-2蛋白水平明显下调,同时细胞增殖明显受到抑制,细胞凋亡率显著升高,细胞周期被阻滞于G1期。结论:TLR4特异性siRNA能够有效沉默TLR4基因表达,并通过NF-κB信号通路下调Bcl-2而显著抑制宫颈癌HeLa细胞的增殖。TLR4可能成为治疗宫颈癌的一个新靶点。
宫颈癌;Toll样受体4;小干扰RNA;NF-κB信号通路;细胞增殖
宫颈癌是严重危害女性健康的恶性肿瘤,我国宫颈癌的发生率位居世界第一,占世界每年新增病例的28.8%,居女性生殖道恶性肿瘤第1位[1]。宫颈癌由于对大多数抗癌药物不敏感,所以首选治疗为手术及放射治疗,但是晚期或复发转移患者效果欠佳,化疗具有全身作用特点,所以寻求新的靶位基因治疗晚期宫颈癌成为研究的重点。Toll样受体(Toll-like receptors,TLRs)属于病原相关分子模式识别受体,在天然免疫及其继发的获得性免疫中起重要作用。近年研究[2]表明,TLRs在多种肿瘤细胞表面表达,并具有配体特异性,通过配体的激活释放肿瘤生长因子和细胞生长因子形成肿瘤生长微环境,促进肿瘤发展,逃避肿瘤免疫反应。而TLRs中TLR4不但识别外源的病原体,还可识别内源性物质及其降解产物[3]。其激活的TRAF6可以结合ECSIT,激活MAPK途径,活化NF-κB和低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)信号[4]。Hasimu等[5]研究证实,TLR4在宫颈癌中表达异常,随着宫颈病变程度升级而增高,蛋白表达升高,提示TLR4与宫颈癌的发生、发展可能有关。曾治民等[6]发现,采用小干扰RNA(small interfering RNA,siRNA)沉默TLR4基因在肝癌细胞株Hep3B中的表达,可致细胞周期停滞于G2/M期,从而抑制癌细胞的异常增殖并促进凋亡。但TLR4基因是否在宫颈癌细胞的异常增殖中起关键作用,目前尚不清楚。因此,本实验设计以TLR4为靶基因,探讨沉默TLR4后对宫颈癌细胞增殖的影响,并研究是否通过NF-κB信号途径下调Bcl-2表达导致这种变化。
材料和方法
1 材料和试剂
人宫颈癌HeLa细胞由南昌大学第二附属医院分子中心实验室保存;RPMI-1640培养液、胰酶及胎牛血清购自Gibco;Trizol及LipofectamineTM2000购自Invitrogen;逆转录试剂盒及PCR试剂盒购自TaKaRa公司;蛋白抽提试剂盒及BCA蛋白定量试剂盒购自上海超研生物科技有限公司;TLR4多克隆抗体购自Santa Cruz;NF-κB及Bcl-2多克隆抗体均购自CST;四甲基偶氮唑蓝(MTT)和二甲基亚砜(DMSO)购自Sigma;姬姆萨染液购自上海博光生物科技有限公司;以TLR4基因为靶标的特异性siRNA和阴性对照siRNA均由广州市锐博生物科技有限公司合成及纯化。
2 TLR4 siRNAs的设计
通过Ambion网站在线设计针对TLR4基因的3条特异性siRNA序列:TLR4-siRNA-001的正义链为5’-CAAUUCUGUUGCUUGUAUATT-3’,反义链为3’-TTGUUAAGACAACGAACAUAU-5’;TLR4-siRNA-002的正义链为5’-CAAUCUGACGAACCUAGUATT-3’,反义链为3’-TTGUUAGACUGCUUGGAUCAU-5’; TLR4-siRNA-003的正义链为5’-UUCGAGACUGGACAAGCCATT-3’,反义链为5’-UGGCUUGUCCAGUCUCGAATT-3’。同时,随机设计FAM标记、作为阴性对照的siRNA(negative siRNA),正义链为5’-UUCUCCGAACGUGUCACGUTT-3’,反义链为5’-ACGUGACACGUUCGGAGAATT-3’。
3 细胞培养和转染
将宫颈癌HeLa细胞以每孔2×105个接种于6孔板,用含10%胎牛血清的RPMI-1640培养液培养于5%CO2、37℃培养箱中。当细胞培养至50%~70%融合度时,参考LipofectamineTM2 000说明书,用脂质体LipofectamineTM2000分别转染各种siRNA(50 nmol/L)。实验分为空白对照(control)组、阴性siRNA(negative siRNA)组和TLR4-siRNAs(包括TLR4-siRNA-001、002、003)组。
4 主要实验方法
4.1 半定量RT-PCRsiRNA转染24 h后收集细胞,Trizol法提取细胞总RNA,反转录合成cDNA。后以cDNA为模板,进行PCR扩增。TLR4引物的正义链为5’-ACCTGTCCCTGAACCCTATGAA-3’,反义链为5’-CTTCTAAACCAGCCAGACCTTG-3’;内参照GAPDH引物的正义链为5’-GTTGGAGGTCGGAGTCAACGGA-3’,反义链为5’-GAGGGATCTCGCTCCTGGAGGA-3’。反应条件为94℃5 min;然后94℃30 s,57℃30 s,72℃30 s,共33个循环。扩增片段大小分别为138 bp和240 bp。取5 μL扩增产物于琼脂糖凝胶电泳,拍照并于凝胶图像分析系统进行扫描分析,计算TLR4 mRNA与GAPDH mRNA的比值。
4.2 Western印迹法检测TLR4、NF-κB及Bcl-2蛋白的表达siRNA转染8 h后收集细胞,提取细胞总蛋白,采用BCA法进行蛋白定量。取等量蛋白40 μg上样,进行10%的SDS-PAGE,浓缩胶80 V、分离胶120 V恒压电泳,260 mA恒流转膜1.5 h。然后用含5%脱脂奶粉的TBST封闭2 h,加入兔抗人TLR4或GAPDH抗体于4℃孵育过夜,次日TBST洗膜10 min 3次后加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(稀释比例为1∶5 000)于室温孵育2 h,TBST洗膜10 min 3次。最后,ECL发光显色,X胶片曝光,采集图像,采用Image-Pro Plus软件对目的蛋白进行定量分析。以GAPDH作为内参照。
4.3 MTT法绘制细胞生长曲线收集转染24 h后的细胞,将细胞重悬,以每孔5×103个接种于96孔板,每孔200 μL,并设置3个复孔。继续培养细胞0 h、24 h、48 h、72 h和96 h后,采用MTT法测定细胞生长活性(以490 nm波长处的吸光度A值表示),待测孔加入20 μL MTT,4 h后每孔加入150 μL DMSO,在酶标仪上于490 nm波长处测定光吸收值,以MTT比色值为纵坐标,时间为横坐标绘制出各组细胞的生长曲线。
4.4 平板克隆形成实验检测细胞增殖情况收集转染24 h后的细胞,将细胞重悬,以每孔2 000个接种于6孔板,继续培养于37℃培养箱,每隔3 d换1次培养液。12 d后终止培养,弃培养液,PBS清洗细胞,多聚甲醛溶液固定细胞15 min,并用姬姆萨染液20 min后,显微镜下计数含克隆形成数[克隆形成率(%)=克隆数/接种细胞数×100%]。
4.5 流式细胞术检测细胞凋亡和细胞周期用0.25%不含EDTA胰蛋白酶消化收集转染36 h后的细胞,离心,Annexin V-FITC/PI染色后,用流式细胞仪检测细胞凋亡率。
用0.25%胰蛋白酶收集转染48 h后的细胞,用PBS洗涤细胞后,加入1 mL 70%乙醇溶液,固定过夜。次日重悬细胞于500 μL PBS,加入2 g/L碘化丙啶(propidium iodide,PI)后,避光孵育30 min,然后使用流式细胞仪计数各细胞周期的细胞数。
5 统计学处理
采用SPSS 15.0软件进行统计学分析。所有结果计量数据均以均数±标准差(mean±SD)表示,每组实验重复3次,组间差异比较采用t检验。以P<0.05为差异有统计学意义。
结果
1 LipofectamineTM2000转染效率检测
细胞转染后24 h,在荧光显微镜下观察绿色荧光蛋白的表达情况,随机取10个低倍视野,计数转染细胞占细胞总数的百分比来评价转染效率。结果显示转染效率达92.00%±4.67%,图1显示绿色荧光蛋白表达的情况。

Figure 1.Observation of cervical cancer HeLa cells transfected with siRNA by LipofectamineTM2000 under fluorescence microscope(×100).图1 宫颈癌HeLa细胞经脂质体LipofectamineTM2000法转染后的荧光分布
2 siRNA转染对宫颈癌HeLa细胞TLR4基因表达水平的影响
通过半定量RT-PCR和Western印迹法分别检测TLR4-siRNA转染HeLa细胞48 h后TLR4的mRNA和蛋白表达水平。结果显示3组TLR4-siRNA都能有效沉默TLR4的表达(P<0.05),其中转染TLR4-siRNA-003组,TLR4的mRNA和蛋白表达水平分别下调了62%和89%,下降最为显著;而转染negative siRNA组,TLR4的mRNA和蛋白表达水平无明显变化,见图2。因此,后续实验选择TLR4-siRNA-003进行基因转染。
3 TLR4-siRNA转染对宫颈癌HeLa细胞NF-κB及Bcl-2表达水平的影响
选择沉默效率最高的TLR4-siRNA-003进行转染48 h后,通过Western印迹法分别检测p65及Bcl-2蛋白的表达水平。结果显示,TLR4-siRNA-003组的HeLa细胞中p65及Bcl-2的蛋白表达水平显著下调,与空白对照组比较差异有统计学意义(P<0.05);而转染negative siRNA组的HeLa细胞中p65及Bcl-2的蛋白表达水平基本无变化,差异无统计学意义(P<0.05),见图3。
4 TLR4-siRNA转染对宫颈癌HeLa细胞增殖的影响
选择沉默效率最高的TLR4-siRNA-003进行转染后,分别通过MTT法和克隆形成实验检测TLR4对宫颈癌HeLa细胞增殖的影响。MTT法检测结果显示,重新种板24 h后,TLR4-siRNA-003组的HeLa细胞增殖开始受到明显抑制,在24、48和72 h这3个时点的细胞增殖抑制率分别为(19.17±2.12)%、(38.75± 2.87)%和(51.50±3.32)%,与空白对照组比较差异有统计学意义(P<0.05);而转染negative siRNA组对HeLa细胞增殖无明显影响(图4A)。克隆形成实验结果与MTT检测结果相同,control、negativesiRNA和TLR4-siRNA-003各组克隆形成率依次为(80.56±8.53)%、(78.87±9.78)%和(18.89± 4.13)%,与空白对照组和阴性siRNA组相比,转染TLR4-siRNA-003后HeLa细胞的克隆集落数显著减少,差异有统计学意义(P<0.05),而转染negative siRNA组对HeLa细胞克隆形成能力无明显影响,差异无统计学意义(图4B)。
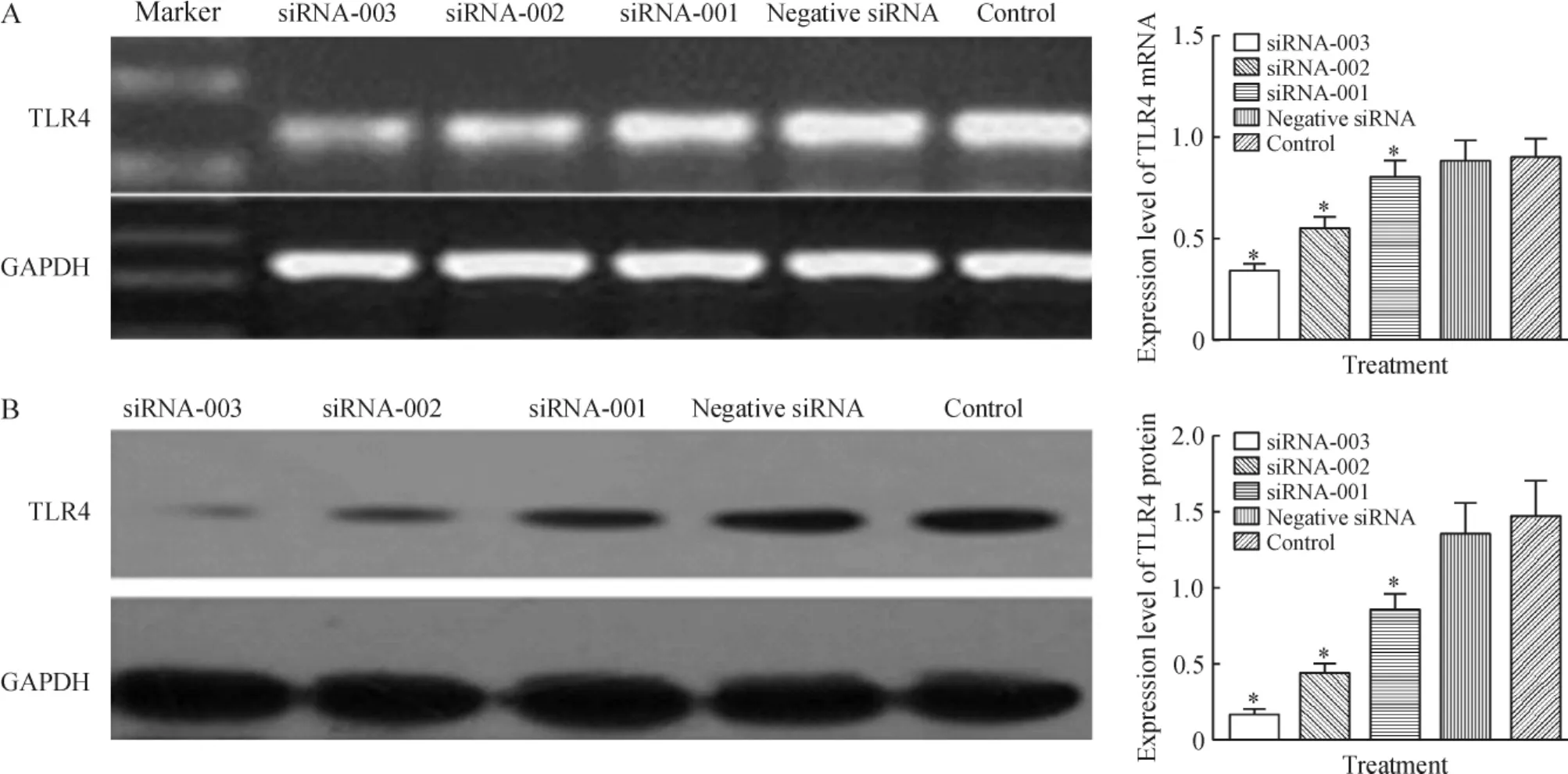
Figure 2.Effects of TLR4 siRNA transfection on the expression of TLR4 at mRNA(A)and protein(B)levels in the cervical cancer HeLa cells.Mean±SD.n=3.*P<0.05 vs control or negative siRNA.图2 TLR4基因特异性siRNA转染对宫颈癌HeLa细胞中TLR4 mRNA和蛋白表达的影响
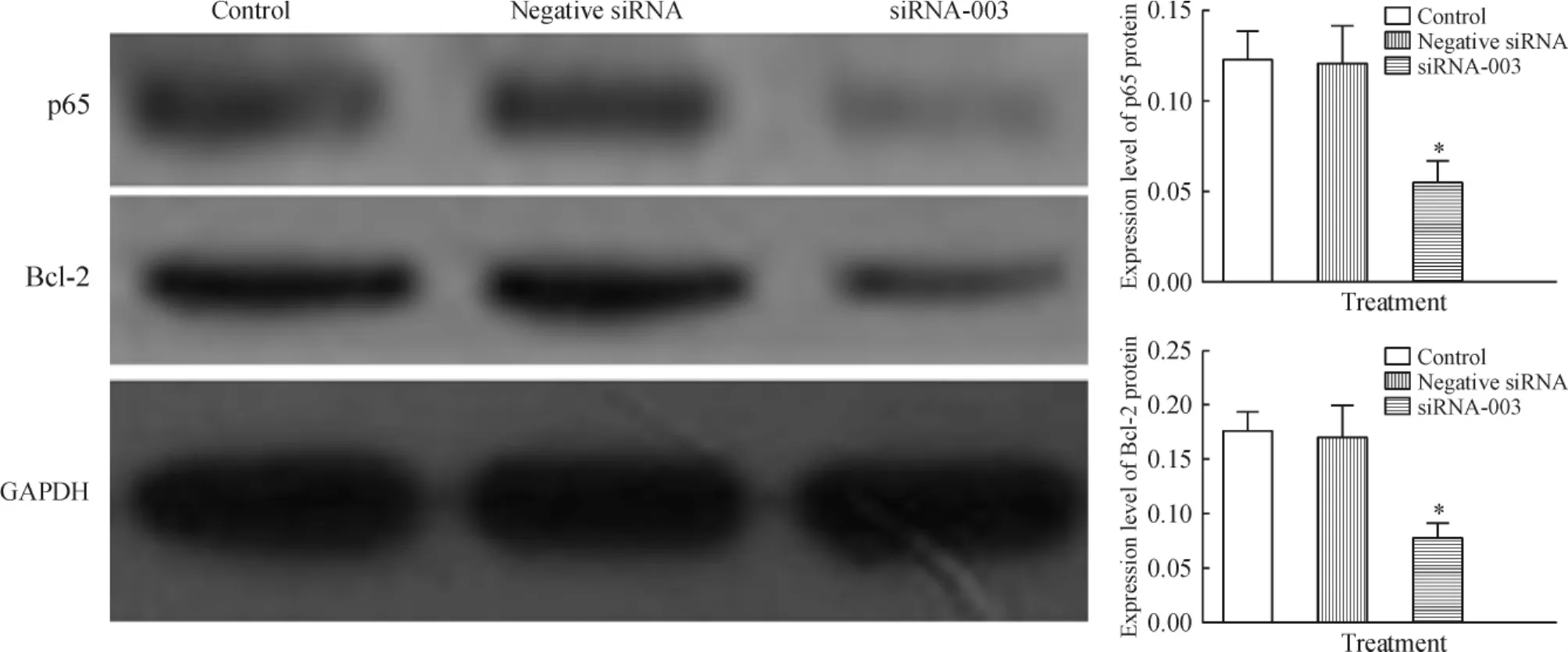
Figure 3.The protein expression of p65 and Bcl-2 in the HeLa cells after silencing TLR4 gene.Mean±SD.n=3.*P<0.05 vs control or negative siRNA.图3 沉默TLR4后HeLa细胞中p65和Bcl-2蛋白的表达水平
5 TLR4-siRNA转染对宫颈癌细胞凋亡的影响
Annexin V-FITC/PI染色流式细胞术检测细胞凋亡,结果显示与空白对照组及阴性siRNA组中宫颈癌细胞的凋亡率差异无统计学意义,而转染TLR4-siRNA-003组,宫颈癌细胞凋亡率为39.21%,与正常组及阴性siRNA组相比显著增高,差异有统计学意义,见图5,提示TLR4-siRNA转染能够明显诱导细胞凋亡。
6 TLR4-siRNA转染对宫颈癌细胞周期分布的影响
流式细胞术检测细胞周期结果显示,空白对照组与阴性siRNA组中宫颈癌HeLa细胞的细胞周期分布差异无统计学意义,而转染TLR4-siRNA-003后G0/G1期HeLa细胞比例显著增高(P<0.05),见图6,提示TLR4 siRNA转染能够阻滞细胞周期在G0/ G1期。

Figure 4.The growth rate of cervical cancer HeLa cells transfected with TLR4siRNA analyzed by MTT assay(A)and colony formation assay(B).Mean±SD.n=3.*P<0.05 vs control or negative siRNA.图4 MTT法及克隆形成实验检测TLR4 siRNA转染对宫颈癌HeLa细胞增殖活性的影响

Figure 5.The apoptotic rate of cervical cancer HeLa cells transfected with TLR4 siRNA detected by flow cytometry with Annexin VFITC/PI staining.Mean±SD.n=3.*P<0.05 vs control or negative siRNA.图5 Annexin V-FITC/PI染色流式细胞术检测TLR4 siRNA转染对宫颈癌HeLa细胞凋亡的影响
讨论
天然免疫的重要模式识别受体Toll样受体的信号转导机制是连接固有免疫系统和获得性免疫系统的重要桥梁。TLRs不仅普遍表达于巨噬细胞、NK细胞和树突状细胞等多种免疫效应细胞,介导各种致病病原体引起的宿主免疫防卫反应,也表达于结肠癌、乳腺癌、宫颈癌、黑色素瘤及肺癌等多种肿瘤细胞,并人白细胞介素1受体的胞内区高度同源。其作为先天免疫的重要组分在一些无明显病原体感染的慢性炎在肿瘤的发生、发展及转移过程中发挥关键作用[7-8]。
TLR4是TLRs受体家族重要成员之一,属于I型跨膜受体,胞外域富含亮氨酸的重复序列,能够识别病原体相关分子模式,胞内区由Toll同源结构域和分子羧基端长短不同的短尾肽(1~22个氨基酸)组成,与症性疾病及炎症相关肿瘤中的作用是目前研究的热点。
NF-κB是属于Rel家族的转录因子。它是一类具有多向转录调节作用的核蛋白因子,广泛存在于多种细胞中,激活后参与许多基因的转录调控,在免疫、炎症、氧化应激、细胞增殖、细胞凋亡等生理病理过程中发挥作用[9]。NF-κB家族由5个蛋白组成,包括c-Rel、RelB、RelA/p65、NF-κB(p50和p105)和NF-κB2[10-11]。大量的实验证明,许多因素可以引起NF-κB信号转导途径的激活,目前公认的主要包括经典途径及旁路途经[12-13]。细胞在静息状态下,细胞质中的p50/p65与IκB结合成3聚体,使p50/p65不能核易位,在经典途径中,当细胞受到如细胞因子、有丝分裂原、内毒素、病毒蛋白、过氧化物、蛋白激酶C、钙离子载体、蛋白合成抑制剂及X射线等细胞外信号刺激时,IKK的IKKβ亚单位被磷酸化激活,继而引起IκBα的Ser32和Ser36位点被磷酸化。磷酸化的IκBα再被泛素化后在26S蛋白水解酶复合体作用下降解,而被释放的p50/p65则进行核易位,与基因上的κB位点发生特异性结合,从而发挥调节细胞功能的作用[14]。目前的许多研究提示NF-κB的激活对细胞的生存具有重要意义。NF-κB抗细胞凋亡是一个涉及多个信号通路的复杂过程,但其主要方式是通过诱导或上调抗凋亡基因的表达实现的,这些基因调节位点上有NF-κB的结合位点,它们的表达产物通过抑制细胞凋亡的死亡受体途径或线粒体途径发挥作用。到目前为止,研究发现细胞凋亡抑制蛋白(inhibitor of apoptosis proteins,IAPs)、Bcl-2家族、TRAF1、TRAF-2、JNK、c-FLIP、IEX-IL等都参与NF-κB激活后的抗细胞凋亡过程[15]。
Bcl-2家族蛋白是在细胞凋亡过程中起关键性作用的一类蛋白质[16]。在线粒体上,Bcl-2家族蛋白通过与其它凋亡蛋白的协同作用,调控线粒体结构与功能的稳定性,发挥着细胞凋亡“主开关”的作用。许多研究结果均表明,线粒体在细胞凋亡过程中起着“主开关”作用,而Bcl-2家族蛋白的主要作用位点就在线粒体膜上[17-18]。Bcl-2和Bcl-xL是Bcl-2家族蛋白成员中主要的抗凋亡分子,Bcl-2和Bcl-xL通过其BH3结构域与Bcl-2家族的促凋亡蛋白形成异二聚体,从而维持促凋亡成员在细胞内的定位分布,保护细胞不进入凋亡程序[19]。
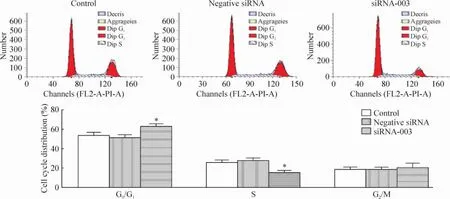
Figure 6.Cell cycle distribution of cervical cancer HeLa cells transfected with TLR4 siRNA analyzed by flow cytometry.Mean±SD.n=3.*P<0.05 vs control or negative siRNA.图6 流式细胞术检测TLR4 siRNA转染对宫颈癌HeLa细胞周期分布的影响
王永军等[20]研究发现,TLR4的表达随着宫颈病变程度的升级而升高。Cheng等[21]研究证实TLR4在宫颈癌中是高表达的,由HPV脂多糖(LPS)激活的TLR4信号有促进细胞增殖和抗凋亡的作用,而且TLR4信号还能通过激活NF-κB信号通路来促进免疫抑制因子IL-6和TGF-β1的分泌,从而促进宫颈癌的发展。推测其可能机制为TLR4与相应配体结合后激活多个下游分子(如NF-κB、AP-1、IRF家族、P38等调节因子)表达,进而导致肿瘤细胞发生和进展[22],因此,推测TLR4可作为宫颈癌复发、化疗耐药和转移的预测标志物,若有效下调TLR4基因在宫颈癌细胞中的过度表达,控制癌细胞的过度增殖,可能对治疗宫颈癌具有重要意义。
本实验选择宫颈癌HeLa细胞株,设计针对TLR4基因中3个干扰靶点的siRNA,转染宫颈癌细胞株后,探讨运用RNA干扰技术沉默TLR4基因的可行性及其对宫颈癌细胞增殖的影响,并探讨是否通过NF-κB信号通路下调Bcl-2导致这种结果。结果表明,宫颈癌细胞在转染48 h后,3条TLR4 siRNA中以TLR4-siRNA-003对TLR4基因的沉默效率最显著,其相对于空白对照组,TLR4的mRNA和蛋白表达水平分别下调62%和89%,差异有统计学意义。进一步研究发现,沉默TLR4基因表达后,p65及Bcl-2蛋白表达水平显著下降,HeLa细胞的增殖明显受到抑制,细胞凋亡率显著升高,细胞周期被阻滞于G0/G1期。
综上所述,本研究成功设计了针对TLR4基因的siRNA,并证实了TLR4 siRNA能够特异性沉默TLR4基因在宫颈癌细胞中的表达,通过抑制NF-κB信号通路的激活,下调p65的表达,从而抑制Bcl-2表达,并有效抑制细胞的生长及克隆增殖能力。上述结果提示TLR4可作为预测宫颈癌细胞增殖的一个新指标,也有望成为应用于宫颈癌基因治疗的一个新靶点。
[1]章文华.子宫颈癌防治展望[J].癌症进展,2010,8 (2):105-108.
[2]Huang B,Zhao J,Li H,et al.Toll-like receptors on tumor cells facilitate evasion of immune surveillance[J].Cancer Res,2005,65(12):5009-5014.
[3]Challa S,Woelfel M,Guildford M,et al.Viral cell death inhibitor MC159 enhances innate immunity against vaccinia virus infection[J].J Virol,2010,84(20):10467-10476.
[4]Ramanathan M,Luo W,Csóka B,et al.Differential regulation of HIF-1α isoforms in murine macrophages by TLR4 and adenosine A2Areceptor agonists[J].J Leukocyte Biol,2009,86(3):681-689.
[5]Hasimu A,Ge L,Li QZ,et al.Expressions of Toll-like receptors 3,4,7,and 9 in cervical lesions and their correlation with HPV16 infection in Uighur women[J].Chin J Cancer,2011,30(5):344-350.
[6]曾治民.Toll样受体4的表达及miR-TLR4干扰对HBV相关肝癌细胞的生物学活性影响[D].南昌:南昌大学医学院,2013.
[7]Chen R,Alvero AB,Silasi DA,et al.Cancers take their Toll:the function and regulation of Toll-like receptors in cancer cells[J].Oncogene,2008,27(2):225-233.
[8]Chen K,Huang J,Gong W,et al.Toll-like receptors in inflammation,infection and cancer[J].Int Immunopharmacol,2007,7(10):1271-1285.
[9]Barnes PJ,Karin M.Nuclear factor-κB:a pivotal transcription factor in chronic inflammatory diseases[J].N Engl J Med,1997,336(15):1066-1071.
[10]Ostuni R,Zanoni I,Granucci F.Deciphering the complexity of Toll-like receptor signaling[J].Cell Mol Life Sci,2010,67(24):4109-4134.
[11]Yang J,Amiri KI,Burke JR,et al.BMS-345541 targets inhibitor of κB kinase and induces apoptosis in melanoma: involvement of nuclear factor κB and mitochondria pathways[J].Clin Cancer Res,2006,12(3 Pt 1):950-960.
[12]Bonizzi G,Karin M.The two NF-κB activation pathways and their role in innate and adaptive immunity[J].Trends Immunol,2004,25(6):280-288.
[13]Luo JL,Kamata H,Karin M.IKK/NF-κB signaling:balancing life and death-a new approach to cancer therapy[J].J Clin Invest,2005,115(10):2625-2632.
[14]Li ZW,Chu W,Hu Y,et al.The IKKβ subunit of IκB kinase(IKK)is essential for nuclear factor κB activation and prevention of apoptosis[J].J Exp Med,1999,189 (11):1839-1845.
[15]Kucharczak J,Simmons MJ,Fan Y,et al.To be,or not to be:NF-κB is the answer-role of Rel/NF-κB in the regulation of apoptosis[J].Oncogene,2003,22(56): 8961-8982.
[16]季红斌,翟琦巍,刘新垣.bcl-2基因的转录调控[J].生物化学与生物物理学报,2000,32(2):95-99.
[17]樊廷俊,夏兰,韩贻仁.线粒体与细胞凋亡[J].生物化学与生物物理学报,2001,33(1):7-12.
[18]林其谁.线粒体与细胞凋亡[J].生物化学与生物物理学报,1999,31(2):116-118.
[19]Degterev A,Lugovskoy A,Cardone M,et al,Identification of small-molecule inhibitors of interaction between the BH3 domain and Bcl-xL[J].Nat Cell Biol,2001,3(2): 173-182.
[20]王永军,翁艳洁,石英,等.TLR4在宫颈癌与不同HPV亚型宫颈癌细胞株中表达及意义[J].医学分子生物学杂志,2012,8(5):419-423.
[21]Cheng YX,Qi XY,Huang JL,et al.Toll-like receptor 4 signaling promotes the immunosuppressive cytokine production of human cervical cancer[J].Eur J Gynaecol Oncol,2012,33(3):291-294.
[22]He W,Liu Q,Wang L,et al.TLR4 signaling promotes immune escape of human lung cancer cells by inducing immunosuppressive cytokines and apoptosis resistance[J].Mol Immunol,2007,44(11):2850-2859.
Effect of Toll like-receptor 4 on proliferation of cervical cancer cells by NF-κB signaling pathway
YAN Wei1,XU Fang-gen2,LIU An-wen1,CAI Jing1,WANG Shuo1
(1Department of Oncology,2Department of Digestive Medicine,The Second Affiliated Hospital of Nanchang University,Nanchang 330006,China.E-mail:awliu666@163.comwhether)
AIM:To investigate whether specific small interfering RNA(siRNA)targeting Toll-like receptor 4 (TLR4)gene inhibits the proliferation of cervical cancer cell line HeLa through NF-κB signaling pathway and down-regulation of Bcl-2 expression.METHODS:Three specific TLR4 siRNAs and 1 negative siRNA were transfected respectively into HeLa cells.The expression of TLR4 at mRNA and protein levels was measured by reverse transcription-polymerase chain reaction(RT-PCR)and Western blotting,respectively.The protein expression of p65 and Bcl-2 was detected by Western blotting.The cell proliferation was determined by MTT assay and plate colony formation assay.The apoptotic rate of the cells and the cell cycle were analyzed by flow cytometry.RESULTS:In comparison with the other 2 kinds of TLR4 siRNAs,TLR4-siRNA-003 demonstrated the strongest silencing effect on TLR4 gene expression in the HeLa cells at 48 h after transfection.The expression of TLR4 at mRNA and protein levels was reduced by 62%and 89%,respectively.The protein levels of p65 and Bcl-2 significantly decreased.The growth rate of HeLa cells transfected with TLR4-siRNA-003 was significantly inhibited.Moreover,the cell apoptotic rate increased significantly and the cell cycle was arrested at G1phase as the HeLa cells were transfected with TLR4-siRNA-003 for 48 h.CONCLUSION:Specific TLR4 siRNA effectively inhibits the expression of TLR4 and inhibits the proliferation of cervical cancer HeLa cells through NF-κB signaling pathway and down-regulation of Bcl-2 expression,indicating that TLR4 may be a new target for the treatment of cervical cancer.
Cervical cancer;Toll-like receptor 4;Small interfering RNA;NF-κB signaling pathway;Cell proliferation
R737.33;R363
A
10.3969/j.issn.1000-4718.2015.02.020
1000-4718(2015)02-301-07
2014-09-30
2014-11-26
△通讯作者Tel:0791-86273751;E-mail:awliu666@163.com
