Hedgehog/Gli1通路在雷奈酸锶促进骨髓间充质干细胞成骨分化过程中的作用*
2015-05-16胡洁芬廖静秋张伟杰许翎智喜梅林凯吴文
胡洁芬,廖静秋,张伟杰,许翎,智喜梅,林凯,吴文△
(1南方医科大学,广东 广州 510515;2广东省人民医院,广东省医学科学院,广东省老年医学研究所东病区内分泌科,广东 广州 510080)
Hedgehog/Gli1通路在雷奈酸锶促进骨髓间充质干细胞成骨分化过程中的作用*
胡洁芬1,2,廖静秋1,2,张伟杰2,许翎2,智喜梅2,林凯2,吴文2△
(1南方医科大学,广东 广州 510515;2广东省人民医院,广东省医学科学院,广东省老年医学研究所东病区内分泌科,广东 广州 510080)
目的:探讨Hedgehog/Gli1信号通路在雷奈酸锶(strontium ranelate,Sr)促进骨髓间充质干细胞(BMSCs)向成骨细胞分化中的作用。方法:体外分离培养大鼠BMSCs,诱导其成骨分化,根据实验目的加入不同浓度的Sr、Hedgehog受体拮抗剂cyclopamine(Cy)及Gli1小干扰RNA(Gli1-siRNA)。用Western blotting法检测Gli1及Runx2的表达,酶标法检测碱性磷酸酶(ALP)活性,茜素红染色法检测钙结节水平。结果:应用不同浓度的Sr (0.1~5 mmol/L)处理BMSCs细胞7 d后,细胞内Gli1蛋白表达增高,Sr的浓度为3 mmol/L时,Gli1表达达到高峰;使用Cy与Sr共处理BMSCs 7 d,能拮抗Sr对Gli1蛋白表达的上调作用;应用Gli1-siRNA转染细胞后,能下调Gli1蛋白的表达,并抑制Sr对Gli1下游Runx2蛋白表达的上调作用,还可拮抗Sr对ALP活性及钙化结节形成的促进作用。结论:Hedgehog/Gli1通路参与了Sr促进骨髓间充质干细胞向成骨分化的过程。
雷奈酸锶;骨髓间充质干细胞;Hedgehog蛋白;Gli1蛋白;Runx2蛋白
雷奈酸锶(strontium ranelate,Sr)是新一代抗骨质疏松药物,可同时作用于破骨细胞和成骨细胞,具有抑制骨吸收和促进骨形成的双重作用。临床研究证实雷奈酸锶能显著提高骨密度,改善骨微结构,降低发生椎体骨折及非椎体骨折的风险[1]。目前,已有一些研究支持Sr可在细胞水平上促进骨形成,例如Choudhary等[2]发现,Sr诱导小鼠的骨髓间质细胞向成骨细胞分化与环氧化酶2和前列腺素E2的介导有关;Peng等[3]发现锶盐能够通过激活Ras/ MAPK信号通路以及下游的转录因子Runx2(为成骨分化重要转录因子)的活性促进MSCs的成骨分化; Fromigue等[4]认为激活活化T细胞核因子c1(nuclear factor of activated T cells c1,NFATc1)以及下游Wnt信号通路在Sr促进BMSCs成骨分化中起重要作用。
我们的前期研究发现能够通过Sr激活转化生长因子β1(transforming growth factor β1,TGF-β1)/ Smad2[5]、骨形态发生蛋白2(bone morphogenetic protein2,BMP2)/Smad1/5/8[6]、SonicHedgehog (Shh)[7]及下游的转录因子Runx2的活性,继而诱导BMSCs向成骨分化。其中,Hedgehog通路在近年来的研究中受到重视,不少研究表明其在成骨发育过程中起重要作用,对脊椎动物骨骼系统的形成和发育起重要调节作用[8]。然而Hedgehog通路能否通过其下游信号分子Gli在Sr促进BMSCs成骨分化中起作用,目前尚未完全明了。为此,本实验拟在前文[7]的研究基础上,进一步观察Hedgehog/Gli通路在Sr促进BMSCs分化为成骨细胞中的作用。
材料和方法
1 主要材料
4周龄雄性SD大鼠购自中山大学实验动物中心;DMEM/F12培养基和胎牛血清购自HyClone; 0.25%胰酶和Opti-MEM购自Gibco;地塞米松、β-甘油磷酸钠和抗坏血酸购自Sigma;Sr干混悬剂由Servier公司惠赠;ALP检测试剂盒购自南京建成生物工程研究所;细胞茜素红(alizarin red)钙染色试剂盒购自上海杰美生物技术有限公司;Gli1抗体购自Santa Cruz;Runx2抗体购自CST;GAPDH购自上海康成生物有限公司;cyclopamine购自Selleckchem;siRNA购自广州锐博生物科技有限公司;Lipofectamine 2000 (Lipo2000)购自Invitrogen。
2 主要方法
2.1 大鼠BMSCs的分离、纯化及培养取4周龄雄性SD大鼠1只,颈椎脱臼法处死后用75%乙醇浸泡5 min,在无菌条件下分离出两侧股骨和胫骨,剔除周围的肌肉、筋膜等组织,剪去股骨近端及胫骨远端,暴露骨髓腔;用含10%胎牛血清的DMEM/ F12培养基反复冲洗骨髓腔,收集细胞,1 000 r/min离心5 min,弃上清,加入5 mL上述培养液重悬细胞,接种于25 cm2的培养瓶中,置于37℃、5%CO2的培养箱中培养;24 h后换液,以后每隔2~3 d换液1次;倒置相差显微镜下观察细胞生长状况,直至细胞接近80%~90%融合时进行1∶2传代纯化。
2.2 BMSCs的成骨分化选取第3~5代BMSCs为研究对象,根据不同实验需要将细胞种植于培养皿或培养板中,待细胞至80%~90%融合后,加入成骨诱导液(含10%胎牛血清、1×10-8mol/L地塞米松、10 mmol/L β-甘油磷酸钠和50 mg/L抗坏血酸的DMEM/F12培养液)培养。
2.3 ALP活性的检测选取第3代细胞按1×108/ L密度接种于24孔板,各实验组给予不同处理因素后,于第7天采用酶标法检测ALP活性。检测时将细胞收集后用裂解液充分裂解,裂解后12 000 r/min离心10 min,取上清液按试剂盒说明书进行操作,于酶标仪492 nm波长处测定吸光度(A)值。
2.4 茜素红钙结节染色选取第3代细胞,接种于预先放置24 mm×24 mm盖玻片的6孔板中。各实验组给予不同处理后,于第21天按照细胞茜素红钙染色试剂盒说明书对样本进行固定、染色剂澄清处理,倒置显微镜下观察钙结节染色情况,每组选3个样本,每样本随机选取1个视野(×100),比较各组间的差异。
2.5 Western blotting法检测Gli1和Runx2蛋白的表达选取第3代细胞接种于60 mm培养皿中,各实验组给予不同的处理因素后,用预冷PBS洗2遍,加入细胞裂解液,4℃裂解30 min,12 000 r/min离心10 min,去上清液,用BCA蛋白定量试剂盒进行蛋白定量。总蛋白经SDS-PAGE分离后,转移到PVDF膜上。用5%脱脂奶粉封闭1 h,分别加入Gli1抗体(1∶200)和Runx2抗体(1∶1 000),4℃过夜,用TBST洗3遍,每次5 min,随后加入Ⅱ抗(1∶4 000)常温孵育1.5 h,再用TBST洗3遍,每次5 min。用发光试剂ECL将膜显色,暗室曝光,凝胶成像系统扫描并分析结果。
2.6 RNA干扰技术设计3条Gli1-siRNA及1条阴性siRNA。瞬时离心后,用灭菌ddH2O将siRNA冻干粉配成20 μmol/L储存液,分装保存,避免反复冻融。转染前1 d,接种适当数量的细胞至培养板或皿中,置于37℃、5%CO2培养箱中过夜,使转染时细胞密度达60%~70%。转染时先制备siRNALipo2000混合液:先用不含血清培养基Opti-MEM分别稀释siRNA储存液、Lipo2000,轻轻混匀,室温放置5 min后将2种混合液混匀,室温孵育20 min,将siRNA-Lipo2000混合液加入不含双抗的细胞培养基中,混匀。6 h后弃去混合液,更换新鲜培养基,进行加药处理。
3 统计学处理
数据以均数±标准差(mean±SD)表示,用SPSS 13.0统计学软件进行统计分析,组间比较采用单因素方差分析(one-way ANOVA)检验,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结果
1 Sr上调BMSCs的Gli1表达
图1A显示,不同浓度Sr(0.1、1、3和5 mmol/L)处理BMSCs 7 d后,Gli1表达均显著高于对照组(P<0.01),且在3 mmol/L Sr时,Gli1表达水平达最高值,呈现一定的浓度依赖性(0~3 mmol/L);在浓度为5 mmol/L时,Sr对Gli1表达的促进作用有所下降,但与对照组比较,仍有统计学意义(P<0.01);而在10 mmol/L Sr浓度组,细胞内Gli1表达水平与对照组差别无统计学意义(P>0.05)。图1B显示,应用3 mmol/L Sr作用BMSCs 3 d时,细胞内Gli1表达水平与对照组差别无统计学意义(P>0.05),而作用5 d、7 d和14 d后,Gli1表达均显著高于对照组(P<0.05),且在7 d时Gli1表达水平达最高值。
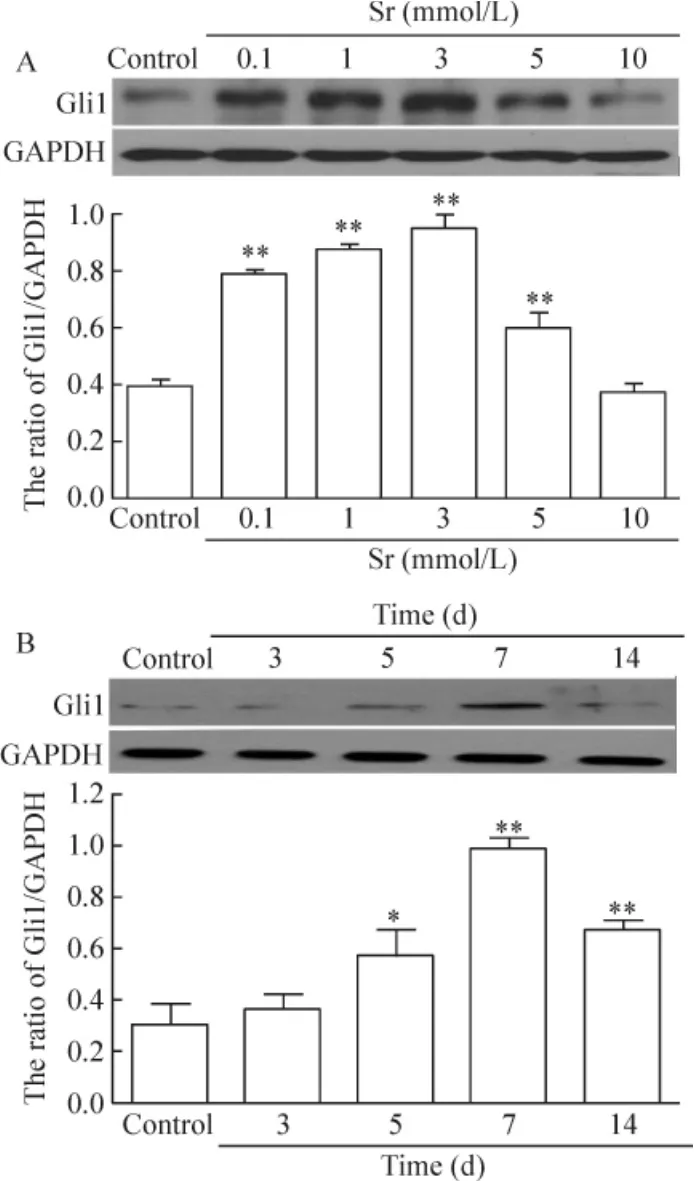
Figure 1.The effects of Sr on the expression of Gli1 in rat BMSCs.A:the cells were treated with the indicated concentrations of Sr for 7 d;B:the cells were treated with 3 mmol/L Sr for different time.Mean±SD.n=3.*P<0.05,**P<0.01 vs control.图1 Sr对BMSCs Gli1表达的影响
2 Hedgehog受体拮抗剂Cy抑制Sr对BMSCs Gli1的上调作用
图2显示,3 mmol/L Sr作用于BMSCs 7 d,可明显地增加Gli1的表达水平,与对照组相比,差异有统计学意义(P<0.01)。当同时应用10 μmol/L Cy与3 mmol/L Sr作用BMSCs 7 d时,可使Gli1表达明显减少,与Sr组相比,差异有统计学意义(P<0.05);单独10 μmol/L Cy对Gli1的基础表达无明显影响。
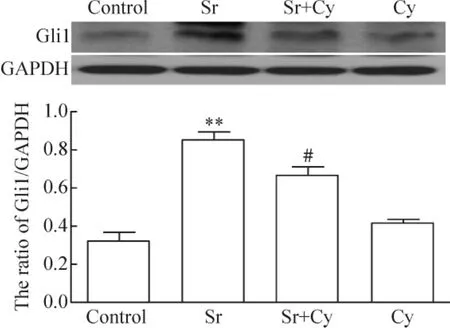
Figure 2.Cyclopamine(Cy,10 μmol/L)inhibited Sr-induced over-expression of Gli1 in rat BMSCs.Mean±SD.n=3.**P<0.01 vs control;#P<0.05 vs Sr.图2 Cy抑制Sr对BMSCs Gli1表达的上调作用
3 Gli1-siRNA有效链的筛选
图3显示,与non-target siRNA组相比较,Gli1-siRNA001未能降低Gli1表达,差别无统计学意义,而Gli1-siRNA002及Gli1-siRNA003均能降低Gli1蛋白的表达(P<0.05),其中Gli1-siRNA002的作用最为明显(P<0.01)。

Figure 3.Screening of the effective Gli1-siRNA.Mean±SD.n=3.*P<0.05,**P<0.01 vs non-target siRNA.图3 Gli1-siRNA有效链的筛选
4 Gli1-siRNA抑制Sr对BMSCs Gli1表达的上调作用
图4显示,3 mmol/L Sr处理BMSCs 7 d,Gli1表达较对照组明显增加(P<0.01);Gli1-siRNA及non-target siRNA分别转染BMSCs后,再予3 mmol/L Sr处理细胞7 d,Gli1-siRNA可使Sr对Gli1表达的上调作用受到明显抑制,与Sr组相比,差异有统计学意义(P<0.01),而non-target siRNA组对Sr上调Gli1表达的作用无明显影响。

Figure 4.Gli1-siRNA inhibited over-expression of Gli1 induced by Sr in rat BMSCs.Mean±SD.n=3.**P<0.01 vs control;##P<0.01 vs Sr.图4 Gli1-siRNA抑制Sr对BMSCs Gli1表达的上调作用
5 Gli1-siRNA抑制Sr对BMSCs Runx2表达的上调作用
图5显示,3 mmol/L Sr处理BMSCs 7 d,Runx2表达较对照组明显增加(P<0.01);Gli1-siRNA及non-target siRNA分别转染BMSCs后,再予3 mmol/L Sr处理细胞7 d,Gli1-siRNA可使Sr对Runx2表达的上调作用受到明显抑制,与Sr组相比,差异有统计学意义(P<0.01),而non-target siRNA组对Sr上调Runx2表达的作用无明显影响。
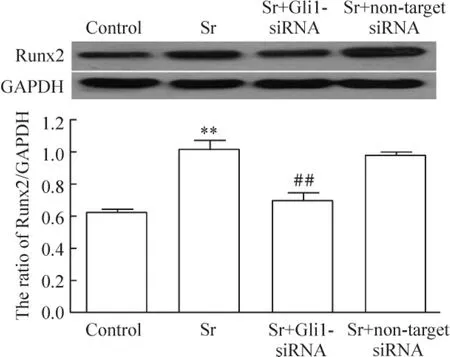
Figure 5.Gli1-siRNA inhibited over-expression of Runx2 induced by Sr in rat BMSCs.Mean±SD.n=3.**P<0.01 vs control;##P<0.01 vs Sr.图5 Gli1-siRNA抑制Sr对BMSCs Runx2表达的上调作用
6 Gli1-siRNA拮抗Sr对ALP活性的促进作用
图6显示,与对照组相比,3 mmol/L Sr处理BMSCs 7 d明显增加ALP活性(P<0.01);Gli1-siRNA及non-target siRNA分别转染BMSCs后,再予3 mmol/L Sr处理细胞7 d,Gli1-siRNA可使Sr对ALP活性的促进作用受到明显抑制,与Sr组相比,差异有统计学意义(P<0.01),而non-target siRNA组对Sr促进ALP活性的作用无明显影响。
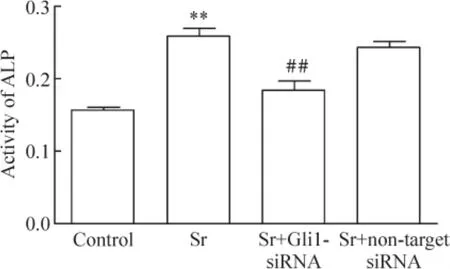
Figure 6.Transfection with Gli1-siRNA inhibited Sr-induced enhancement of ALP activity in rat BMSCs.Mean±SD.n=3.**P<0.01 vs control;##P<0.01 vs Sr.图6 Gli1-siRNA拮抗Sr对BMSCs ALP活性的促进作用
7 Gli1-siRNA拮抗Sr对钙结节形成的促进作用
图7显示,与对照组相比,3 mmol/L Sr处理BMSCs 21 d明显增加钙结节的数量;Gli1-siRNA转染BMSCs后,使Sr对钙结节形成的促进作用受到明显抑制,而non-target siRNA转染后,对Sr促进钙结节形成的作用无影响。
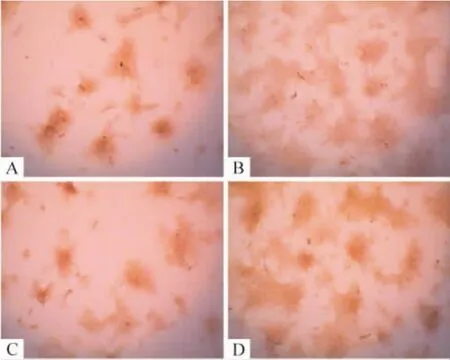
Figure 7.Transfection with Gli1-siRNA inhibited Sr-induced mineralization in rat BMSCs(alizarin red staining,×100).A:control group;B:Sr group;C:Sr+ Gli1-siRNA group;D:Sr+non-target siRNA group.图7 Gli1-siRNA拮抗Sr对BMSCs钙结节生成的促进作用
讨论
Hedgehog信号转导通路由Hh配体、膜蛋白受体复合物(Ptch和Smo)、核转录因子Gli和下游靶基因4部分组成。在脊椎动物中,Hh配体包含3个家族成员:Shh、Desert Hedgehog(Dhh)和Indian Hedgehog(Ihh),其中Shh表达最为广泛。下游转录因子Gli型锌指蛋白家族有3个成员,即Gli1、Gli2和Gli3,其中,起主要激活信号传递的是Gli1、Gli2、Gli3既可表现为激活又可表现为抑制作用。在Hh信号转导过程中,Hh、Smo、Gli作为激动因子发挥正调节作用,而Ptch作为抑制因子发挥负调节作用[8]。在诱导MSCs成骨分化方面,Hedgehog是否通过其下游转录因子Gli1产生作用仍然有争论,Ma等[9]发现地塞米松可通过增加Shh表达诱导BMSCs成骨分化,但此过程不依赖于Gli1的表达;而van等[10]研究表明外源性Shh可增加Gli1表达,刺激未分化KS483细胞向成骨分化,而与Gli2和Gli3无明显相关;Oliveira等[11]在研究中采用hMSCs,在无成骨诱导培养液中培养,添加Hedgehog受体激动剂Purmorphamine可增加Gli1、Gli2及成骨分化重要转录因子Runx2的表达。Runx2在成骨分化和骨形成方面起重要作用,是启动成骨作用的一个关键转录因子[12],然而Gli1对于Runx2表达的影响尚无明确定论,Zunich等[13]、Hojo等[14]表明Gli1在一定程度上不依赖与Runx2参与成骨分化作用,Kim等[15]则发现Gli1可增加Runx2的活性以及转录从而促进软骨钙化。
我们的前期研究表明,Sr可通过上调Shh表达促进大鼠骨髓间充质干细胞向成骨分化[7]。本研究在原有的基础上进一步证实,Sr在促进BMSCs向成骨细胞分化的过程中,明显促进了Gli1的表达。为进一步明确Hedgehog受体在此调控中的影响,本研究在应用Sr前,加入Hedgehog受体的抑制剂Cy。结果表明,Cy可以明显抑制Sr对Gli1的上调作用,提示Hedgehog受体介导Sr对Gli1的上调作用,Oliveira等[11]指出,Hedgehog受体激动剂可增加Gli1的表达,支持本文的结果。另一方面,为了证实Gli1在Sr促进BMSCs向成骨分化中的作用,本研究使用Gli1-siRNA下调Gli1的表达后,发现Sr对Runx2的上调作用明显减弱,并且拮抗了Sr对成骨早期指标ALP的活性及晚期指标钙结节形成的促进作用,提示Gli1分子在Sr促进BMSCs向成骨分化中起着重要作用。
综上所述,本文进一步证实了Sr可通过激活Hedgehog受体调节Gli1表达,而Gli1分子在Sr促进BMSCs向成骨分化中起着重要作用,包括促进Runx2表达、增加ALP活性及钙结节形成。由此可见,激活Hedgehog/Gli1通路可能是Sr促进BMSCs向成骨分化的重要机制之一。这些结果为临床上应用于Sr防治骨质疏松等疾病提供了新颖的实验依据。
[1]Kanis JA,Johansson H,Oden A,et al.A meta-analysis of the effect of strontium ranelate on the risk of vertebral and non-vertebral fracture in postmenopausal osteoporosis and the interaction with FRAX®[J].Osteoporos Int,2011,22(8):2347-2355.
[2]Choudhary S,Halbout P,Alander C,et al.Strontium ranelate promotes osteoblastic differentiation and mineralization of murine bone marrow stromal cells:involvement of prostaglandins[J].J Bone Miner Res,2007,22(7): 1002-1010.
[3]Peng S,Zhou G,Luk KD,et al.Strontium promotes osteogenic differentiation of mesenchymal stem cells through the Ras/MAPK signaling pathway[J].Cell Physiol Biochem,2009,23(1-3):165-174.
[4]Fromigue O,Hay E,Barbara A,et al.Essential role of nuclear factor of activated T cells(NFAT)-mediated Wnt signaling in osteoblast differentiation induced by strontium ranelate[J].J Biol Chem,2010,285(33):25251-25258.
[5]黄晓丹,吕辉珍,靳思思,等.雷奈酸锶通过TGF-β1/ Smad通路促进骨髓间充质干细胞向成骨细胞分化[J].中国病理生理杂志,2013,29(2):302-307.
[6]吕辉珍,黄晓丹,靳思思,等.雷奈酸锶通过骨形态发生蛋白-2/Smad通路促进骨髓间充质干细胞成骨分化[J].南方医科大学学报,2013,33(3):376-381.
[7]靳思思,胡洁芬,吴文.Shh在雷奈酸锶促进骨髓间充质干细胞成骨分化过程中的作用[J].中国病理生理杂志,2014,30(1):159-164.
[8]Pan A,Chang L,Nguyen A,et al.A review of hedgehog signaling in cranial bone development[J].Front Physiol,2013,4:61.
[9]Ma X,Zhang X,Jia Y,et al.Dexamethasone induces osteogenesis via regulation of hedgehog signalling molecules in rat mesenchymal stem cells[J].Int Orthop,2013,37 (7):1399-1404.
[10]van der Horst G,Farih-Sips H,Lowik CW,et al.Hedgehog stimulates only osteoblastic differentiation of undifferentiated KS483 cells[J].Bone,2003,33(6):899-910.
[11]Oliveira FS,Bellesini LS,Defino HL,et al.Hedgehog signaling and osteoblast gene expression are regulated by purmorphamine in human mesenchymal stem cells[J].J Cell Biochem,2012,113(1):204-208.
[12]Gersbach CA,Byers BA,Pavlath GK,et al.Runx2/ Cbfa1 stimulates transdifferentiation of primary skeletal myoblasts into a mineralizing osteoblastic phenotype[J].Exp Cell Res,2004,300(2):406-417.
[13]Zunich SM,Douglas T,Valdovinos M,et al.Paracrine sonic hedgehog signalling by prostate cancer cells induces osteoblast differentiation[J].Mol Cancer,2009,8:12.
[14]Hojo H,Ohba S,Yano F,et al.Gli1 protein participates in Hedgehog-mediated specification of osteoblast lineage during endochondral ossification[J].J Biol Chem,2012,287(21):17860-17869.
[15]Kim EJ,Cho SW,Shin JO,et al.Ihh and Runx2/Runx3 signaling interact to coordinate early chondrogenesis:a mouse model[J].PLoS One,2013,8(2):e55296.
Strontium ranelate promotes osteogenic differentiation of rat bone mesenchymal stem cells through Hedgehog/Gli1 signaling pathway
HU Jie-fen1,2,LIAO Jing-qiu1,2,ZHANG Wei-jie2,XU Ling2,ZHI Xi-mei2,LIN Kai2,WU Wen2
(1Southern Medical University,Guangzhou 510515,China;2Department of Endocrinology,East Ward,Guangdong Geriatric Institute,Guangdong Academy of Medical Sciences,Guangdong General Hospital,Guangzhou 510080,China.E-mail: wuwen1964@163.com)
AIM:To explore whether strontium ranelate(Sr)promotes osteogenic differentiation of rat bone mesenchymal stem cells(BMSCs)through the Hedgehog/Gli1 signaling pathway.METHODS:BMSCs were isolated from 4-week-old rats by adherent culture and induced to differentiate into osteoblasts.According to the experimental purposes,the cells were exposed to different concentrations of Sr,cyclopamine(Cy,an inhibitor of Hedgehog receptor)or Gli1-siRNA.The expression of Gli1 and Runx2 in the cells was detected by Western blotting.The activity of alkaline phosphatase (ALP)was measured by the method of colorimetry,and the mineralized nodules were observed under microscope with alizarin red staining.RESULTS:Exposure to Sr at concentrations of 0.1 to 5 mmol/L for 7 d markedly increased the expression of Gli1 in the BMSCs,and the increase in Gli1 expression was the most obvious following Sr exposure at concentration of 3 mmol/L.Cy at concentration of 10 μmol/L inhibited Sr-induced up-regulation of Gli1 expression.Transfection of the BMSCs with Gli1-siRNA not only obviously inhibited Sr-induced up-regulation of Gli1 and Runx2(a downstream protein of Gli1)expression,but also antagonized Sr-induced enhancement of ALP activity and the formation of mineralized nodules.CONCLUSION:The Hedgehog/Gli1 pathway is involved in Sr-induced osteogenic differentiation of rat BMSCs.
Strontium ranelate;Bone mesenchymal stem cells;Hedgehog protein;Gli1 protein;Runx2 protein
R363.2+1
A
10.3969/j.issn.1000-4718.2015.02.008
1000-4718(2015)02-234-05
2014-11-11
2015-01-07
广东省自然科学基金资助项目(No.S2012010009403);广东省科技计划(No.2011B031800002);广州市科技计划(No.2012J4300082)
△通讯作者Tel:020-83827812;E-mail:wuwen1964@163.com
