光敏核不育水稻幼苗叶片脂氧合酶活性及其基因表达的昼夜变化
2015-05-15黄俊宝曾晓春何永明向妙莲付永琦黄友明
黄俊宝,曾晓春,* ,何永明,向妙莲,付永琦,黄友明
(1.江西农业大学 作物生理生态与遗传育种教育部重点实验室/农业部双季稻生理生态与栽培重点开放实验室,江西 南昌 330045;2.宜春学院 生命科学与资源环境学院,江西 宜春 336000)
脂(肪)氧合酶(lipoxidase,简称 LOX,EC1.13.11.12)是一类含有非血红素离子的双加氧酶,催化含(Z,Z)-1,4戊二烯结构单元的不饱和脂肪酸的加氧反应,产生不饱和脂肪酸的过氧化物。植物LOX基因是一个多基因家族,其基因表达贯穿于植物生活史的整个过程。LOX的一个重要功能是催化新型植物激素茉莉酸类(Jasmonic acid,JA)的生物合成,它是JA生物合成前体亚麻酸(Linolenic acid,LNA)氧化合成13-氢过氧化亚麻酸(13-HPOT)的限速酶[1],且其活性直接影响植物体内JA的水平[2-3]。众多研究表明,LOX或其催化形成的JA与植物生殖关系密切:首先,JA参与日中性植物紫萍(Spirodela polyrrhiza)[4]和短日植物牵牛花(Pharbitis nil或Ipomoea nil)[5]的光周期成花反应;其次,LOX 和 JA参与拟南芥(Arabidopsis thaliana)[6-11]、玉米[12]和水稻等植物花粉育性的建成。而关于LOX和JA与光周期的关系也有报道:光敏色素系统调控牵牛花成花反应的JA代谢[5];玉米叶中克隆出的ZmLOX10,其mRNA的积累严格受到昼夜节律的调控[13]。姚锋先等[14]报道外施茉莉酸甲酯(Methyl jasmonate,Me-JA)能提高不育光温条件下光敏核不育水稻N5088S的花粉染色率和自交结实率,而且在幼穗分化期N5088S叶片LOX活性在可育光温条件下高于不育光温条件。以上研究结果提示LOX和JA可能与光敏核不育水稻育性相关,但迄今鲜见光敏核不育水稻茉莉酸途径的研究报道。本研究拟在苗期控制条件下,研究光敏核不育水稻LOX活性的光暗期变化,以阐明光敏核不育水稻LOX的光周期变化特点,为进一步阐明光敏核不育水稻茉莉酸途径的特征奠定基础。
1 材料与方法
1.1 试验材料
以长光敏核不育水稻N5088S(育性转变临界日长为13.75~14 h)和短光敏核不育水稻D38S(育性转变临界日长为13.5 h)为材料,并以三系水稻不育系东B11A、G2A和常规水稻中早25、中嘉早17、盐粳7号为对比材料。
1.2 试验设计
水稻幼苗培育:水稻种子于25℃浸种40 h后,置于30℃培养箱中催芽48 h,挑选发芽良好一致的种子播种于直径8 cm盛有水稻土的塑料杯中,置于光照培养箱(4 000 lx)中培养20 d。培养过程中,塑料杯土面保持水层。光照培养箱中的光周期设定:设不同光暗期的3个不同的24 h光周期:12L/12D(中日,MD)、14L/10D(长日,LD)、10L/14D(短日,SD)。培养温度设定:设恒温和变温。恒温:光期、暗期温度均为30℃;变温:光期温度30℃,暗期温度26℃。
1.3 测定项目及方法
1.3.1 LOX活性的测定 取样:幼苗培养20 d后,开始取样。在光期和暗期分别以3h的间隔时间取样3次。每次从光照培养箱中取出3~5杯,从中剪取叶片,每0.2 g叶片为一份样品,样品重复3次,样品称量后立即置于液氮中速冻保存备用。暗期取样在绿光灯下进行。
LOX活性测定参照文献[15-17]的方法。将底物溶液和待测酶粗提液置于30℃的条件下平衡15 min;取0.1 mL酶粗提液加入到2.4 mL的底物溶液中,迅速混匀;利用TU-1800紫外可见分光光度计在234 nm条件下测定反应体系的OD值;LOX活性(鲜质量测)以ΔOD234/(g·min)表示。
数据处理与分析:以Excel 2010进行数据整理、绘图和分析。
1.3.2 LOX基因的RT-PCR分析 N5088S和D38S幼苗在12L/12D(光期07:00—19:00;暗期19:00—7:00)、30℃/26℃(L/D)光照培养箱中培养20 d时开始取样,连续取样2个光期和2个暗期,即48 h;光期从10:00开始取样、暗期从22:00开始取样,每隔3小时取样1次;每次取样时剪取生长发育进程基本一致水稻幼苗第1片完全叶,每次取样约10片完全叶,光期取样在自然光照条件下进行,暗期取样在绿光灯下进行;样品采用锡箔纸包裹、液氮速冻约1 h后置于-80℃冰箱保存备用。每样品取3次重复。

表1 目标基因及其引物信息Tab.1 Target genes and their primers used for qRT-PCR analysis
应用TransZolTMUp试剂(北京全式金)抽提样品总RNA。按照TransZolTMUP RNA提取试剂操作说明书提取RNA,电泳检测RNA提取效果,测定RNA浓度及纯度。
采用北京全式金生物技术有限公司生产的TransScriptⒸII All-in-One First-Strand cDNA Synthesis SuperMix for qPCR 合成 cDNA 第一链。20 μL 反转录体系中 RNA 量为 1.0 μg,5×TransScriptⒸII All-in-One SuperMix for qPCR 4 μL,gDNA Remover 1 μL,补足 RNase-free Water至 20 μL,轻轻混匀后 50 ℃孵育 15 min,85℃加热5 s失活TransScriptⒸII RT/RI和gDNA Remover。得到的第一链cDNA使用内参引物Actin进行qPCR试验验证cDNA质量。
根据目标基因组全长序列,利用NCBI的引物在线设计软件Primer-Blast(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计目的基因引物,所检测基因及其引物序列见表1。
qPCR使用北京全式金公司TransStartⒸTop Green qPCR SuperMix试剂盒。20 μL反应体系含50 ng cDNA,10 μL TransStart Top Green qPCR SuperMix(2×),0.4 μL 正、反向引物(10 μmol/L),补足 ddH2O至20 μL。扩增反应在Roche LightCyclerⒸ96系统上进行,反应条件设置为:95℃预变性30 s;95℃变性5 s和60℃退火15 s,72℃延伸10 s,45个循环。反应结束后做溶解曲线,检测引物特异性。每份样品3次重复。
目标基因的表达水平采用2-ΔΔCt方法[18]进行相对定量。数据处理和绘图采用Excel 2010软件。
2 结果与分析
2.1 昼夜恒温和不同光周期条件下光敏核不育系与常规稻幼苗叶片LOX活性的光暗期变化
在12L/12D恒温条件下,光敏核不育系N5088S与D38S苗期叶片LOX活性整体水平明显高于常规水稻中早25、盐粳7号和中嘉早17及三系水稻不育系G2A和东B11A(图1)。光敏核不育水稻叶片LOX活性呈现明显的光期低暗期高的特征,但N5088S与D38S叶片LOX活性在整体水平和昼夜变化上均无显著差异(图1)。常规稻和三系水稻不育系的昼夜LOX活性无显著差别,且各品种间LOX活性在整体水平和昼夜变化上也无显著差异,故后续试验仅用常规稻中早25做对照。
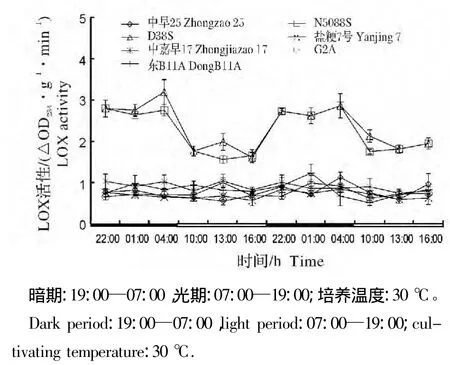
图1 12L/12D恒温条件下水稻苗期叶片中LOX活性的光暗期变化Fig.1 Diurnal fluctuation of LOX activity in rice seedling leaves at constant temperature and 12L/12D photoperiod
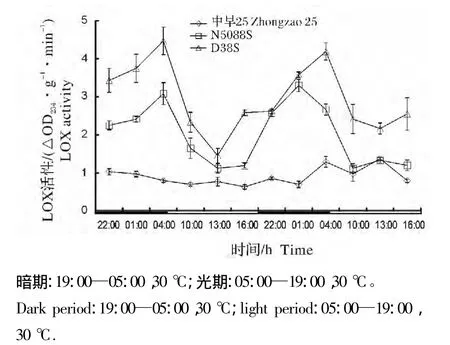
图2 14L/10D恒温条件下光敏核不育系与常规稻幼苗叶片中LOX活性的光暗期变化Fig.2 Diurnal fluctuation of LOX activity in PGMS and conventional rice seedling leaves at constant temperature and 14L/10D photoperiod
从图2和图3可看出,当光暗期温度保持恒定时,LD和SD下,长光敏核不育系N5088S和短光敏核不育系D38S幼苗叶片LOX活性均呈现暗期高光期低的特征,而常规稻中早25幼苗叶片的LOX活性在光暗期无明显差别;且暗期光敏核不育水稻LOX活性显著高于常规稻。
2.2 昼夜变温和不同光周期条件下光敏核不育系与常规稻幼苗叶片LOX活性的光暗期变化
由图4、图5和图6可知,当昼夜处于变温条件时,LD、SD和MD 3个不同光周期条件下,长光敏核不育系N5088S和短光敏核不育系D38S幼苗叶片LOX活性均呈现暗期高光期低的特征,而常规稻中早25幼苗叶片LOX活性光暗期无明显差别。暗期光敏核不育水稻LOX活性显著高于常规稻。
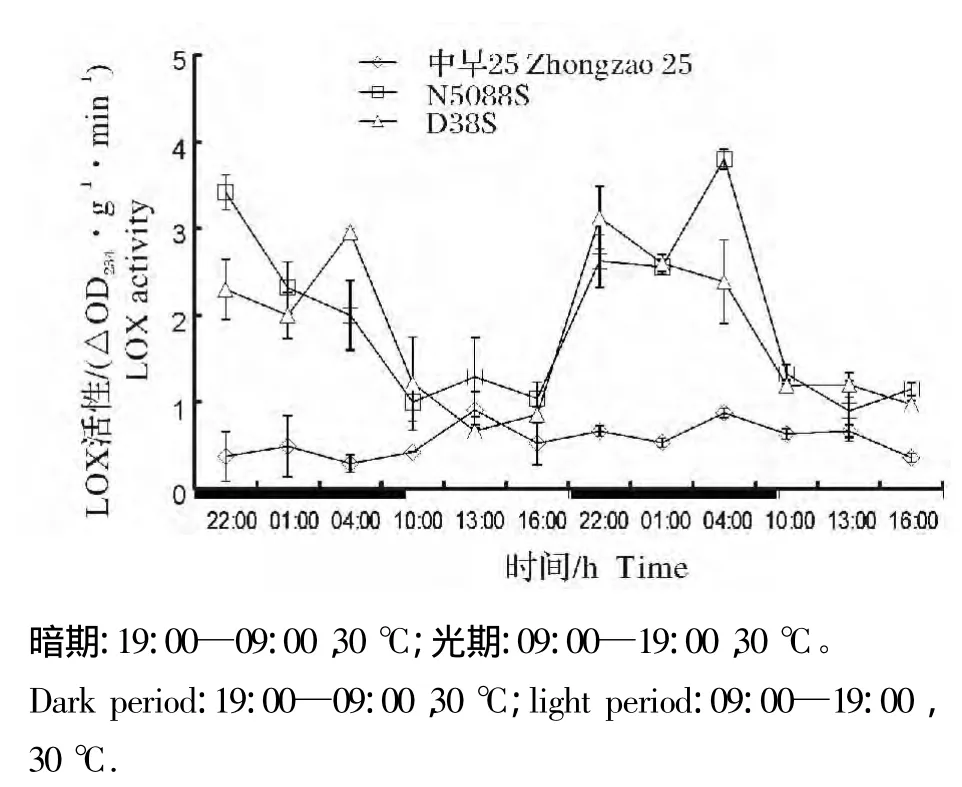
图3 10L/14D恒温条件下光敏核不育系与常规稻幼苗叶片中LOX活性的光暗期变化Fig.3 Diurnal fluctuation of LOX activity in PGMS and conventional rice seedling leaves at constant temperature and 10L/14D photoperiod

图4 14L/10D变温条件下光敏核不育系与常规稻幼苗叶片中LOX活性的光暗期变化Fig.4 Diurnal fluctuation of LOX activity in PGMS and conventional rice seedling leaves at alternating temperature and 14L/10D photoperiod

图5 10L/14D变温条件下光敏核不育系与常规稻幼苗叶片中LOX活性的光暗期变化Fig.5 Diurnal fluctuation of LOX activity in PGMS and conventional rice seedling leaves at alternating temperature and 10L/14D photoperiod
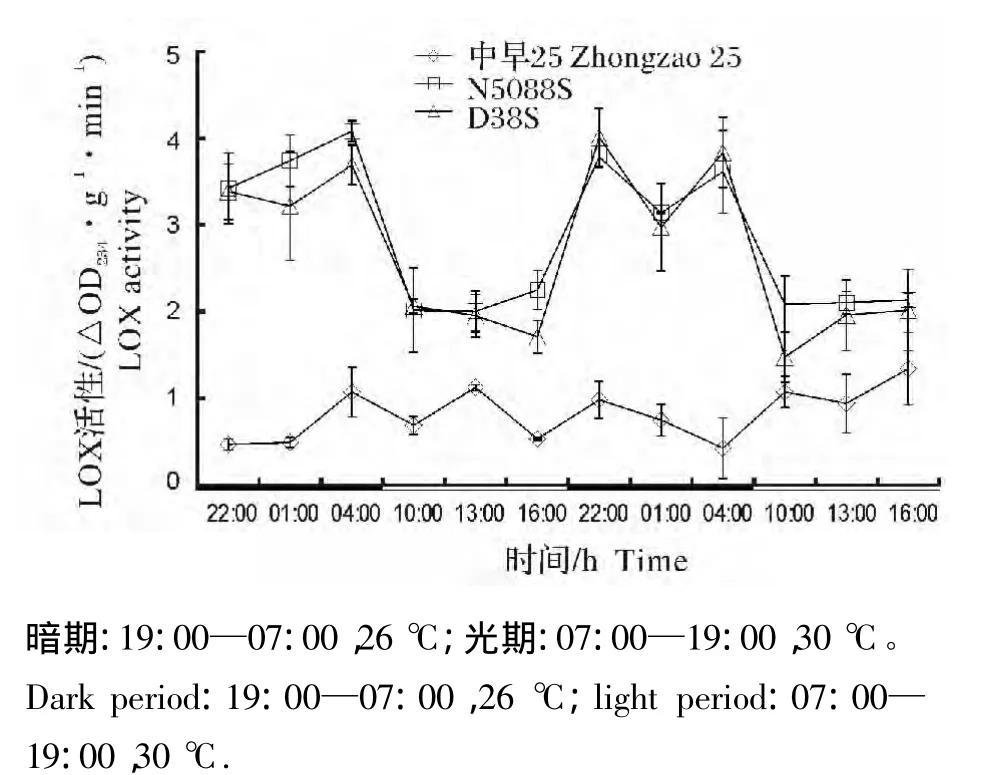
图6 12L/12D变温条件下光敏核不育系与常规稻幼苗叶片中LOX活性的光暗期变化Fig.6 Diurnal fluctuation of LOX activity in PGMS and conventional rice seedling leaves at alternating temperature and 12L/12D photoperiod

图7 样品总RNA电泳Fig.7 Electrophoresis figure of total RNA
2.3 样品总RNA质量检测结果
样品总RNA的琼脂糖凝胶电泳效果见图7,从中可以看出RNA跑胶条带完整。RNA浓度及纯度测定结果显示:N5088S的总 RNA A260/280 为 1.8~1.9,A260/A230为 1.79 ~ 1.90,RNA 的 浓 度 在 800 ~1 000 ng/μL;D38S的总 RNA A260/280为1.56~1.92,A260/A230 为 1.81~2.08,RNA的浓度在920~1 600 ng/μL,表明 RNA的提取质量较好,其纯度与质量符合后续试验的要求。
2.4 水稻苗期叶片LOX基因表达的光暗期变化
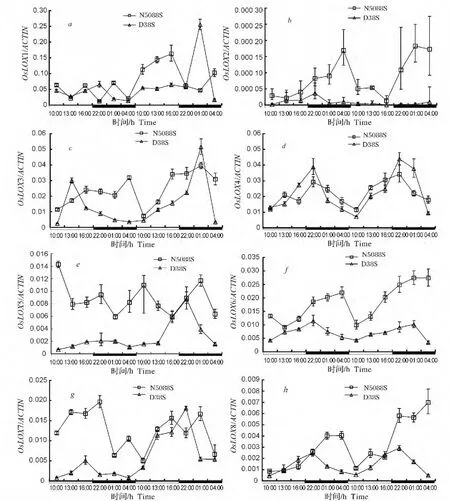
图8 光敏核不育水稻幼苗叶片中OsLOX表达的光暗期变化Fig.8 Diurnal fluctuation of OsLOX expression levels in PGMS rice seedling leaves
在检测的13个LOX基因中,除LOX6、LOX7、LOX10、LOX11和LOX12共5个基因未检出外,共检测到8个OsLOX基因(图8)。检测结果表明:OsLOX1、OsLOX5和OsLOX9基因表达的丰度在N5088S和D38S中均无明显的光暗期变化规律(图8-a、8-e和8-g)。OsLOX2基因表达丰度在N5088S中具有明显的暗期高光期低的变化规律,其最高和最低表达丰度分别出现在暗期和光期,表达丰度从光期转到暗期时升高,而从暗期转到光期时下降;但在D38S中无明显光暗期变化规律(图8-b)。OsLOX3基因的表达丰度在N5088S中具有暗期高光期低的趋势,其最高和最低表达丰度分别出现在暗期和光期;而在D38S中没有明显的光暗期变化特征(图8-c)。OsLOX4基因表达的丰度在N5088S和D38S中均具有暗期高光期低的趋势,其最高和最低表达丰度均分别出现在暗期和光期,表达丰度从光期转到暗期时均升高,而从暗期转到光期时均下降(图8-d)。OsLOX8和OsLOX13基因表达的丰度在N5088S和D38S中均具有暗期高光期低的趋势,N5088S中的最高和最低表达丰度分别出现在暗期和光期,表达丰度从光期转到暗期时升高,而从暗期转到光期时下降;D38S中的最高表达丰度出现在暗期,表达丰度从光期转到暗期时升高,而从暗期转到光期时下降(图8-f,8-h)。N5088S幼苗叶片的 OsLOX2、OsLOX3、OsLOX4、Os-LOX8和OsLOX13等5个基因的表达与其LOX活性的光暗期变化趋势一致,而D38S幼苗叶片的Os-LOX4、OsLOX8和OsLOX13等3个基因的表达与其LOX活性的光暗期变化趋势一致。
3 小结与讨论
3.1 PGMS水稻与三系不育和常规稻间的LOX活性的光暗期变化差异
本研究结果首次揭示,光敏核不育水稻幼苗叶片LOX活性具有显著的暗期高光期低的变化特征。此外,光暗期恒温或变温,并不影响水稻幼苗叶片LOX活性的光暗期变化特征,说明PGMS水稻LOX酶活性的光暗期变化不是由温度引起的,而是受光调控的。PGMS水稻LOX活性受光调控的这一结果与文献中光调控JA水平的报道[19-23]一致,而暗期LOX活性高于光期的结果与光敏色素Pfr能抑制LOX合成的结果相符[19]。本研究中,LOX活性的光暗期变化仅发生于PGMS水稻中,而在常规稻和三系不育系中,LOX活性在光暗期无明显差异;长光敏核不育水稻N5088S和短光敏核不育水稻D38S的LOX活性光暗期变化规律一致。这一结果提示LOX或茉莉酸途径可能与PGMS水稻的光敏感特性有关。
3.2PGMS水稻LOX基因表达的特点
本研究在PGMS水稻幼苗叶片中检测到8个OsLOX基因,其中OsLOX2、OsLOX3、OsLOX4、OsLOX8和OsLOX13的表达丰度在N5088S中呈现暗期高光期低的趋势;而在D38S中,OsLOX4、OsLOX8和Os-LOX13的表达丰度呈现暗期高光期低的趋势。这一结果与本研究LOX活性的测定结果相吻合,也与光敏色素Pfr能抑制LOX合成的结果[19]相一致。Nemchenko[13]曾报道玉米LOX基因ZmLOX10的表达受光周期的调控,但其表达水平却是昼高夜低,不过ZmLOX10编码的LOX的底物是亚油酸,它并不为JA的合成提供前体物。说明LOX家族中的不同基因在不同的植物或不同品种中存在不同的表达调控方式。考虑到LOX是JA途径中的关键酶,并且LOX活性与JA积累呈极显著正相关[2-3],笔者推测PGMS水稻叶片中内源JA水平具有昼夜变化特征。
3.3 PGMS水稻LOX活性的光暗期变化是否与育性转换相关还有待进一步研究
本研究虽未直接涉及PGMS水稻的育性,而仅研究其幼苗叶片的LOX活性和其基因表达特性,但也为进一步研究JA途径与PGMS水稻的育性提供了基础。已知LOX或JA途径参与拟南芥[6-11,24-25]、玉米[12]和水稻[26-28]等植物的雄性育性表达,而且外施MeJA能使不育光温条件下PGMS水稻N5088S的育性部分恢复,并且可育光温条件下N5088S叶片LOX活性高于不育光温条件[14]。在育性转换敏感期,PGMS水稻LOX活性或其基因表达是否也和幼苗期叶片一样存在光暗期的变化呢?是否在长光敏核不育系N5088S与短光敏核不育系D38S[29]中表现同样的光暗变化趋势呢?这些问题值得进一步的研究。
[1]Schaller F,Schaller A,Stintzi A.Biosynthesis and metabolism of jasmonates[J].Journal of Plant Growth Regulation,2005,23(3):179-199.
[2]马崇坚,柳俊,谢从华.抑制脂氧合酶对马铃薯试管块茎形成及膨大的影响[J].园艺学报,2003,30(3):291-295.
[3]宫长荣,李艳梅,杨立均.水分胁迫下离体烟叶中脂氧合酶活性、水杨酸与茉莉酸积累的关系[J].中国农业科学,2003,36(3):269-272.
[4]Krajnˇciˇc B,Nemec J.The effect of jasmonic acid on flowering in Spirodela polyrrhiza(L.)schleiden[J].Journal of Plant Physiology,1995,146(5/6):754-756.
[5]Maciejewska B,Kopcewicz J.Inhibitory effect of methyl jasmonate on flowering and elongation growth in Pharbitis nil[J].Journal of Plant Growth Regulation,2002,21(3):216-223.
[6]Feys B J F,Benedetti C E,Penfold C N,et al.Arabidopsis mutants selected for resistance to the phytotoxin coronatine are male sterile,insensitive to methyl jasmonate,and resistant to a bacterial pathogen[J].The Plant Cell,1994,6(5):751-759.
[7]Mcconn M,Browse J.The critical requirement for linolenic acid is pollen development,not photosynthesis,in an arabidopsis mutant[J].The Plant Cell,1996,8(3):403-416.
[8]Sanders P M,Lee P Y,Biesgen C,et al.The arabidopsis DELAYED DEHISCENCE1 gene encodes an enzyme in the jasmonic acid synthesis pathway[J].The Plant Cell,2000,12(7):1041-1061.
[9]Stintzi A,Browse J.The Arabidopsis male-sterile mutant,opr3,lacks the 12-oxophytodienoic acid reductase required for jasmonate synthesis[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(19):10625-10630.
[10]Ishiguro S,Kawai-Oda A,Ueda J,et al.The DEFECTIVE IN ANTHER DEHISCENCE1 gene encodes a novel phospholipase A1 catalyzing the initial step of jasmonic acid biosynthesis,which synchronizes pollen maturation,anther dehiscence,and flower opening in Arabidopsis[J].The Plant Cell,2001,13:2191-2209.
[11]Park J H,Halitschke R,Kim H B,et al.A knock-out mutation in allene oxide synthase results in male sterility and defective wound signal transduction in Arabidopsis due to a block in jasmonic acid biosynthesis[J].The Plant Journal,2002,31(1):1-12.
[12]Acosta I F,Laparra H,Romero S P,et al.Tasselseed1 is a lipoxygenase affecting jasmonic acid signaling in sex determination of maize[J].Science,2009,323(5911):262-265.
[13]Nemchenko A,Kunze S,Feussner I,et al.Duplicate maize 13-lipoxygenase genes are differentially regulated by circadian rhythm,cold stress,wounding,pathogen infection,and hormonal treatments[J].Journal of Experimental Botany,2006,57(14):3767-3779.
[14]姚锋先,曾晓春,熊伟,等.茉莉酸类与光敏核不育水稻N5088S育性的关系[J].江西农业大学学报,2007,29(1):6-10.
[15]Gökmen V,Bahçeci S,Acar J.Characterization of crude lipoxygenase extract from green pea using a modified spectrophotometric method[J].European Food Research and Technology,2002,215(1):42-45.
[16]张志良,瞿伟.植物生理学实验指导[M].北京:高等教育出版社,2003:262-264.
[17]姚锋先,曾晓春,蒋海燕,等.水稻中以亚麻酸为底物的脂氧合酶活性测定[J].江西农业大学学报,2006,28(2):183-186.
[18]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[19]Oelze-karow H,Schopfer P,Mohr H.Phytochrome-mediated repression of enzyme synthesis(lipoxygenase:a threshold phenomenon)[J].Proc Natl Acad Sci USA,1970,65:51-57.
[20]Radhika V,Kost C,Mithöfer A,et al.Regulation of extrafloral nectar secretion by jasmonates in lima bean is light dependent[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(40):17228-17233.
[21]Carvalho R F,Campos M L,Azevedo R A.The role of phytochrome in stress tolerance[J].Journal of Integrative Plant Biology,2011,53(12):920-929.
[22]Kazan K,Manners J M.The interplay between light and jasmonate signalling during defence and development[J].Journal of Experimental Botany,2011,62(12):4087-4100.
[23]Svyatyna K,Riemann M.Light-dependent regulation of the jasmonate pathway[J].Protoplasma,2012,249:137-145.
[24]Huang H,Wang C,Tian H,et al.Amino acid substitutions of GLY98,LEU245 and GLU543 in COI1 distinctively affect jasmonate-regulated male fertility in Arabidopsis[J].SCIENCE CHINA(Life Sciences),2014,57(1):145-154.
[25]Caldelari D,Wang G,Farmer E E,et al.Arabidopsis lox3 lox4 double mutants are male sterile and defective in global proliferative arrest[J].Plant Molecular Biology,2011,75:25-33.
[26]Riemann M,Muller A,Korte A,et al.Impaired induction of the jasmonate pathway in the rice mutant hebiba[J].Plant Physiology,2003,133(4):1820-1830.
[27]Bae H K,Kang H G,Kim G J,et al.Transgenic rice plants carrying RNA interference constructs of AOS(allene oxide synthase)genes show severe male sterility[J].Plant Breeding,2010,129(6):647-651.
[28]Liu G,Tian H,Huang Y Q,et al.Alterations of mitochondrial protein assembly and jasmonic acid biosynthesis pathway in honglian(HL)-type cytoplasmic male sterility rice[J].The Journal of Biological Chemistry,2012,287(47):40051-40060.
[29]黎世龄.水稻短光低温敏雄性核不育系D38S在宜春的育性表现[J].宜春学院学报:自然科学版,2004,26(4):78-81.
