玫烟色棒束孢IfB01菌株原生质体制备与转化条件研究
2015-05-15陈秀润崔朝宇蒋军喜胡琼波
李 霖,刘 冰,陈秀润,崔朝宇,蒋军喜*,胡琼波*
(1.江西农业大学 农学院,江西 南昌 330045;2.华南农业大学 资源环境学院,广东 广州 510510)
玫烟色棒束孢(Isaria fumosorosea)(又称玫烟色拟青霉Paecilomyces fumosoroseus)是一类分布广泛的昆虫病原真菌,也是目前已知颇具应用前景的温室害虫生防真菌之一[1-2];在国外已有PreFeRal、PF97等多个玫烟色棒束孢生防药剂登记注册[3-4]。然而从昆虫尸体上分离筛选出的野生菌株往往由于防效不稳定、毒力易退化等原因,限制了其田间的实际应用[5-6]。因此,需进一步筛选优良菌株,采用细胞工程、基因工程等多种生物技术对菌株进行改良,进而获得高效工程菌株,为开发玫烟色棒束孢杀虫剂提供一种有效的途径。
外源基因转化是进行玫烟色棒束孢基因工程改良的关键步骤之一,其前提条件是能获得该菌大量原生质体细胞和具有高效的基因转化方法。目前较为常见的基因转化方法有原生质体-PEG法、农杆菌介导转化法[7]、醋酸锂转化法、限制酶介导转化法[8]、电转化法[9]等,其中应用于丝状真菌转化系统构建多采用原生质体-PEG法,并且该方法已在若干实验菌株中成功应用[10-11]。
2012年,本实验室研究人员从田间烟粉虱(Bemisia tabaci)尸体上分离到一株虫生真菌(Isaria fumosorosea),命名为菌株IfB01,前期实验表明该菌株对烟粉虱有较强的毒力[12],考虑到其良好的生防应用前景,本研究拟采用原生质体-PEG法构建起玫烟色棒束孢IfB01菌株外源基因转化系统,并对其原生质体制备和转化条件进行了初步探索,为下一步利用细胞工程、基因工程等技术对菌株进行遗传改良奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌株与含有外源基因载体 玫烟色棒束孢(Isaria fumosorosea)IfB01菌株,由华南农业大学农药毒理实验室提供,pSilent-1质粒由美国FGSC中心惠赠。
1.1.2 试剂及配制 (1)试剂:不同浓度的NaCl渗透压稳定剂溶液;(2)蜗牛酶(Snailase)、纤维素酶(Cellulase)分别购自BBI公司和Worthington公司,按试验要求称取一定量的酶溶于配制的特定浓度的稳渗剂中,经0.45 μm细菌滤器过滤除菌,4℃下保存备用;(3)潮霉素B购自Roch公司;(4)NaNO3、K2HPO4、MgSO4·7H2O、KCl、FeSO4·7H2O、NaCl、蛋白胨、蔗糖等试剂均为国产分析纯。
1.1.3 培养基 (1)改良的察氏培养基:蛋白胨 5 g,NaNO33 g,K2HPO41 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·7H2O 0.01 g,蔗糖 30 g,琼脂 15~20 g,加蒸馏水至 1 L;(2)液体基础培养基:改良的察氏培养基中不加琼脂;(3)原生质体再生培养基:改良的察氏培养基加入相应的渗透压稳定剂;(4)原生质体保存 STC 培养液:1.2 mol/L 山梨醇,10 mmol/L Tris-HCl(pH 7.5),50 mmol/L CaCl2;(5)PTC 转化培养基:PEG4000,10 mmol/L Tris-HCl(pH 7.5),50 mmol/L CaCl2。
1.2 方 法
原生质体制备参照Yoo[13]和李丽花等[14]的方法并作适当修改。
1.2.1 菌丝体制备 玫烟色棒束孢IfB01菌株于改良的察氏培养基上25℃培养2周;待产孢后,用0.05%的吐温-80溶液冲洗平板,并配制成浓度为108个/mL的孢子悬浮液;取1 mL悬浮液接种于100 mL液体基础培养基中,置于25℃,150 r/min振荡培养30 h;无菌条件下,用双层纱布将菌丝过滤至100 mL离心管中;5 000 r/min,离心10 min,弃上清;用0.7 mol/L的NaCl溶液清洗2遍;并用无菌纸吸干沉淀,得到幼嫩菌丝体。
1.2.2 原生质体制备条件初探 (1)酶液配比。分别配制不同质量浓度的蜗牛酶、纤维素酶,然后按照等体积混合原则进行组合,共进行7种组合处理,分别是3%蜗牛酶、3%纤维素酶、1%蜗牛酶+2%纤维素酶、1.5%蜗牛酶+1.5%纤维素酶、2%蜗牛酶+1%纤维素酶、2%蜗牛酶+4%纤维素酶、4%蜗牛酶+2%纤维素酶7种酶解液,将酶解液按1 g/mL的量加入到幼嫩菌丝体中,进行酶解,制备原生质体。7种处理在同一试验中完成,以减少误差。在7种不同处理中,除酶种类不同外,其他试验条件均相同:以0.7 mol/L的NaCl溶液为渗透压稳定剂、酶解温度30℃、酶解pH6.0、在100 r/min转速下振荡酶解,每隔2 h在显微镜下观察原生质体数量,直至酶解10 h。然后用血球计数板计数,分别计算原生质体产量(每mL酶液产生的原生质体数量,以原生质体个数/mL表示,下同)。(2)酶解时间。设定5个酶解时间:2,4,6,8,10 h。除酶解时间不同外,其他试验条件均相同:以1%蜗牛酶+2%纤维素酶作为酶解液,0.7 mol/L的NaCl溶液为渗透压稳定剂、酶解温度30℃、酶解pH6.0、在100 r/min转速下振荡酶解。在设定的5个时间点定时取样,然后用血球计数板计数,分别计算原生质体产量。(3)酶解温度。分别设定5个酶解温度:26,28,30,32,34℃。除酶解温度不同外,其他试验条件同步骤(2)。在设定的不同温度下酶解8 h。用血球计数板计数,分别计算原生质体产量。(4)酶液pH值。分别配制pH值5.0、5.5、6.0、6.5和7.0的0.2 mol/L磷酸缓冲液,在缓冲液中加入NaCl作为渗透压稳定剂,NaCl溶液的终浓度为0.7 mol/L,然后配制1%蜗牛酶和2%纤维素酶混合液,除酶液pH值不同外,其他试验条件同步骤(2)。用血球计数板计数,分别计算原生质体产量。(5)渗透压稳定剂浓度。将供试的NaCl渗透压稳定剂分别设定 5 个浓度:0.5、0.6、0.7、0.8、0.9 mol/L。除渗透压稳定剂浓度不同外,其他试验条件同步骤(2)。用血球计数板计数,分别计算原生质体产量。(6)转速。分别设定5个不同转速条件:0,50,100,150,200 r/min。除振荡转速不同外,其他试验条件同步骤(2)。用血球计数板计数,分别计算原生质体产量。
1.2.3 原生质体的纯化 菌丝酶解后,用4层灭菌的擦镜纸过滤混合液;将滤液转移至100 mL离心管中,4 000 r/min离心5 min;弃上清,0.7 mol/L的NaCl溶液冲洗2次;再用10 mL STC溶液洗涤1次;在离心管中加入1 mL STC溶液,轻轻混合均匀;用血球计数板计数。
1.2.4 原生质体转化及转化子筛选 在上述原生质体溶液中加入10 μL pSilent-1质粒,轻轻混合均匀;4℃冰箱内放置1 h;然后逐滴加入200 μL PTC溶液,室温放置20 min;再逐滴加入800 μL PTC溶液,放入摇床中轻摇20 min;在离心管内加入5 mL液体再生培养基,置于25℃,150 rpm条件下振荡培养过夜;将过夜的培养液离心,弃部分上清,并将培养液中原生质体浓度稀释至104个/mL;取200 μL培养液(含原生质体浓度1×104个/mL)涂于含有200 μg/mL潮霉素B的原生质体再生培养基平板上,25℃条件下培养30 h,记录平板上菌斑数,并计算原生质体转化率。培养基上生长的菌落即为转化子。原生质体转化率计算公式:
转化率=再生菌落数/涂布原生质体个数×100%(1)
1.2.5 原生质体转化条件优化 分别配制含20%、30%、40%、50%的 PEG4000的 PTC溶液,按照1.2.4方法分别进行原生质体转化及转化子筛选,统计各浓度下再生菌斑数,并计算各浓度下原生质体转化率。
2 结果与分析
2.1 玫烟色棒束孢原生质体制备条件初探
2.1.1 酶液配比对原生质体制备的影响 真菌细胞壁成分结构复杂,选择合适的酶系统对原生质体产量具有重要影响。为筛选到理想的酶组合,选用2种常用酶(蜗牛酶和纤维素酶)及其组合进行试验,观察其对原生质体产量的影响,结果表明,单独进行纤维素酶或蜗牛酶处理的原生质体产量相差不大,但2种酶混合使用效果明显好于单个酶处理。当混合酶系统中蜗牛酶∶纤维素酶=1∶2,酶的总浓度为30 mg/mL时,其原生质体产量最高,可达6.72×106个/mL。因此,玫烟色棒束孢菌株IfB01细胞壁的最适溶解酶系统为1%蜗牛酶+2%纤维素酶。
中共十九大报告指出:“我国社会主要矛盾已经转化为人民日益增长的美好生活需要和不平衡不充分的发展之间的矛盾。”[1]11美好生活理念的出场是对新时代美好生活需要的现实回应,也是人民对美好生活憧憬的价值取向。但美好生活究竟是什么样、美好生活何以成为人通达意义世界的栖息之地,仍然是一个有待深入探讨的问题。鉴于此,本文拟从马克思人的解放理论的视角切入,阐释美好生活的内涵和生成逻辑,以期为达成人民美好生活愿景提供理论坐标和路径参考。
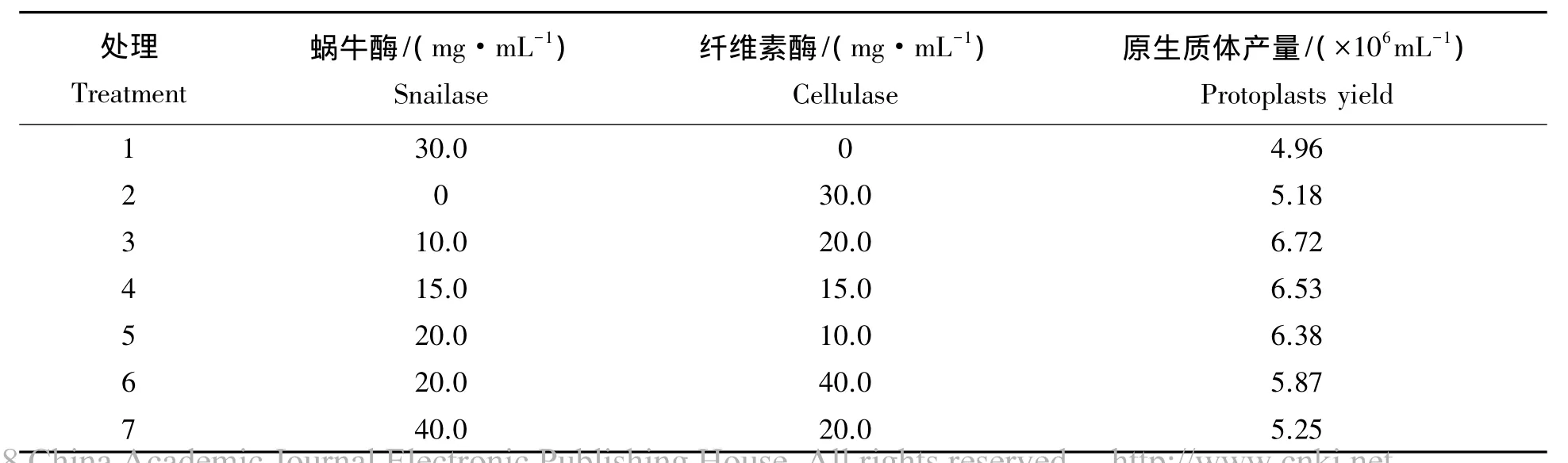
表1 酶的种类及配比对原生质体产量的影响Tab.1 Effects of category of enzymes and mixture ratio on the protoplast yield of I.fumosorosea
2.1.2 酶解温度和酶解时间对原生质体制备的影响 对玫烟色棒束孢菌原生质体制备的最佳酶解温度进行筛选,试验结果如图1-A所示,开始时随着酶解温度的增加,原生质体的产量逐渐增加,酶解温度为30℃时,原生质体产量为最高,达到6.49×106个/mL,随着酶解温度的升高,原生质体产量下降逐渐下降。这一结果表明在一定温度范围内,随着温度的升高,复合酶的活性也在提高,原生质体的产量也随之增加;当温度过高时,复合酶的活性也会受到影响,进而影响原生质体产量。
比较不同酶解时间对玫烟色棒束孢菌原生质体制备的影响,结果如图1-B所示,在供试时间内,玫烟色棒束孢菌原生质体产量随酶解时间的延长而不断升高,至8 h为最高点,产量达到6.65×106个/mL,之后开始呈下降的趋势,所以8 h玫烟色棒束孢菌原生质体制备的最佳酶解时间。这一结果也表明酶解时间达到一定时间点后,酶解液会对菌株细胞膜造成破坏,进而造成细胞消溶死亡,导致原生质体产量下降。
2.1.3 酶解液pH值对原生质体制备的影响 由图1-C可知,酶解液pH对玫烟色棒束孢菌原生质体制备存在一定的影响,在供试的5个pH处理中,当酶解液pH为6.0时,其原生质体产量最高,为5.50×106个/mL;此外,酶解液 pH 为 7.0 时,其原生质产量仅为 4.03×106个/mL。
2.1.4 稳渗液浓度对原生质体制备的影响 稳渗液浓度对玫烟色棒束孢菌原生质体的产量有较大的影响,开始时原生质产量随着稳渗液浓度的增大而增加,当浓度为0.7 mol/L时,其产量达到最大值,为5.83×106个/mL;而后随着稳渗液浓度的进一步增大,原生质体的产量随之减少(图1-D)。因此,玫烟色棒束孢菌原生质体制备时,其稳渗液最佳浓度为0.7 mol/L。
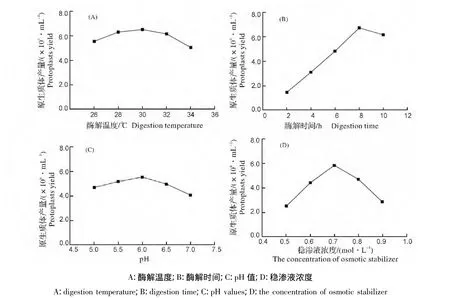
图1 不同酶解条件对原生质产量的影响Fig.1 Effects of different digestion conditions on the protoplast yield of I.fumosorosea
2.1.5 酶解时振荡转速对原生质体制备的影响 研究不同振荡转速对玫烟色棒束孢菌原生质体制备的影响,结果表明不同的振荡转速对IfB01菌株原生质体制备影响差异较小,当转速为100 r/min时,其原生质体产量最高,为6.07×106个/mL;其振荡转速设置为0,50,200 r/min时,原生质体的产量分别是5.35×106个/mL、5.74×106个/mL、5.59×106个/mL。由此,将 100 r/min 条件确定为玫烟色棒束孢菌原生质体制备时最佳振荡转速条件。
2.2 玫烟色棒束孢原生质体转化条件优化
2.2.1 PEG4000浓度对原生质体转化的影响 比较不同PEG4000浓度对玫烟色棒束孢原生质体转化的影响,结果如表2所示,当PEG4000浓度为40%时,其转化效率最高,达7.05%;当PEG4000浓度为20%时,其转化效率仅为2.1%。结果表明PEG4000浓度对玫烟色棒束孢原生质体转化效率有较大影响,其原生质体转化最优PEG4000浓度为40%。
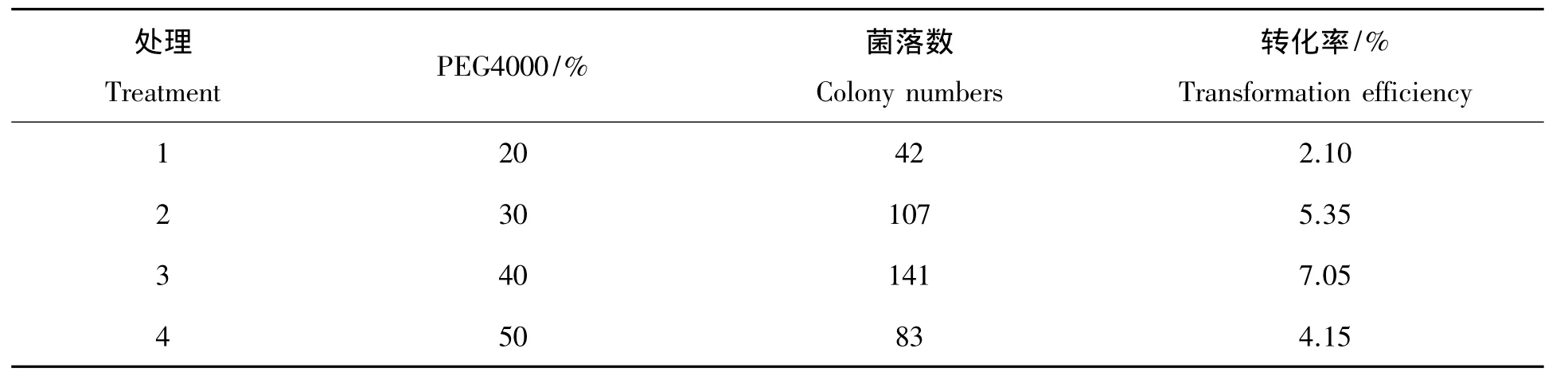
表2 PEG4000浓度对原生质体转化的影响Tab.2 Effects of the concentration of PEG4000 to protoplast transformation
3 结论与讨论
由于丝状真菌细胞壁组成比较复杂,不同种属之间存在一定的差异,因此,在原生质体制备实验中,细胞壁酶解体系组成及浓度是影响原生质体释放的关键因素[15-16]。杨旭芬等[8]用蜗牛酶、裂解酶对玫烟色拟青霉Pfr116进行酶解获得成功,但其最优原生质体产量仅为1.11×106个/mL。本试验比较了蜗牛酶、纤维素酶及其酶系组合对玫烟色棒束孢原生质体的释放效果,发现不同脱壁酶处理均能使玫烟色棒束孢释放出原生质,并且释放效果存在明显差异,多种酶组合比单种酶表现出更好的酶解效果,其中以1%蜗牛酶+2%纤维素酶酶解效果最好,其原生质产量达6.72×106个/mL。此外,蜗牛酶、纤维素酶在其他丝状真菌原生质体制备实验中也被广泛应用,在本研究应用中也表现出较好的酶解效果,玫烟色棒束孢在不同酶系处理后均无大量团状菌丝结构残存。
在原生质体制备实验中,除细胞壁酶解体系组成及浓度外,影响原生质体制备产量的因素还有菌丝菌龄、酶解温度、酶解时间、pH和稳渗液的浓度等[15]。经过对实验结果的分析发现,稳渗液浓度对玫烟色棒束孢原生质体的产量有较大的影响,当稳渗液浓度为0.7 mol/L时,其产量达到最大值,为5.83×106个/mL,这一试验结果表明,稳渗液浓度变化会对玫烟色棒束孢细胞水分吸收造成影响,进而影响其原生质体产量,当NaCl溶液浓度为0.7 mol/L时,其浓度与细胞内离子浓度相差不大,能为其细胞提供稳定的生存环境。
在PEG介导真菌的原生质体转化实验中,PEG浓度是影响其转化效率的重要因素[11]。本试验比较了不同PEG浓度对玫烟色棒束孢原生质体转化效率的影响,发现在一定范围内,其浓度越高,介导效果越好,即转化效率越高;但当其浓度过高时,PEG的毒性可能杀死细胞,反而造成原生质体转化率降低。
[1]Zimmermann G.The entomopathogenic fungi Isaria farinose(formerly Paecilomyces farinosus)and the Isaria fmosorosea species complex(formerly Paecilomyces fumosoroseus):biology,ecology and use in biological control[J].Biocontrol Science and Technology,2008,18(9):865-901.
[2]陈巍巍,冯明光.玫烟色拟青霉的研究与应用现状[J].昆虫天敌,1999,21(3):140-144.
[3]Faria M,Wraight S P.Biological control of Bemiaia tabaci with fungi[J].Crop Protection,2001,20(9):767-778.
[4]Mesquita A L M,Lacey L A,Mercadier G,et al.Entomopathogenic activity of a whitefly-derived isolate of Paecilomyces fumosoroseus(Deuteromycotina:Hyphomycetes)against the Russian wheat aphid,Diuraphis noxia(Hemiptera:Sternorrhyncha:Aphididae)with the description of an effective bioassay method[J].European Journal of Entomology,1996,93(2):69-75.
[5]Vandenberg J D,Cantone F A.Effect of serial transfer of three strains of Paecilomyces fumosoroseus on growth in vitro,virulence,and host specificity[J].Journal of Invertebrate Pathology,2004,85(1):40-45.
[6]Thomas M B,Read A F.Can fungi biopesticides control malaria?[J].Nature Reviews Microbiology,2007,5(5):377-383.
[7]Vera M,Dirk M,Till S.Comparison of different transformation methods for Aspergillus giganteus[J].Current Genetics,2003,43(5):371-377.
[8]杨旭芬,应盛华,冯明光.限制性内切酶介导的玫烟色拟青霉原生质转化体系构建[J].浙江大学学报:农业与生命科学版,2006,32(6):606-612.
[9]Ozeki K,Kyoya F,Hizume K,et al.Transformation of intact Aspergillus niger by electroporation[J].Bioscience,Biotechnology and Biochemistry,1994,58(12):2224-2227.
[10]刘士旺,王政逸,郭泽建.绿色木霉的原生质体制备与转化条件[J].农业生物技术学报,2004,12(1):96-101.
[11]Giczey G,Kerenyi Z,Dallmann G,et al.Homologous transformation of Trichoderma hamatum with an endochitinase encoding gene,resulting in increased levels of chitinase activity[J].FEMS Microbiology Letters,1998,165(2):247-252.
[12]Zou C H,Li L,Dong T Y,et al.Joint action of the entomopathogenic fungus Isaria fumosorosea and four chemical insecticides against the whitefly Bemisia tabaci[J].Biocontrol Science and Technology,2014,24(3):315-324.
[13]Yoo S D,Cho Y H,Sheen J.Arabidopsis mesophyll protoplasts:a versatile cell system for transient gene expression analysis[J].Nature Protocols,2007,2(7):1565-1572.
[14]李丽花.玉米大斑病菌钙调磷酸酶基因的功能研究[D].保定:河北农业大学,2010.
[15]徐进,莫明和,张克勤.影响捕食线虫真菌原生质体形成的因素分析[J].江西农业大学学报,2005,27(2):249-253.
[16]张志光,李东屏,方芳,等.丝状真菌原生质体技术的研究:培养条件对原生质体的影响(VII)[J].湖南师范大学学报,1998,21(1):60-65.
