高产虾青素的雨生红球藻胁迫条件和中试研究*
2015-05-12廖兴辉王明兹李小妹黄键傅燕秋陈必链郑行
廖兴辉,王明兹,2,3,李小妹,黄键,2,3,傅燕秋,陈必链,2,3,郑行
1(福建师范大学生命科学学院,福建福州,350117)2(福建师范大学工业微生物教育部工程研究中心,福建福州,350117)3(福建省现代发酵技术工程研究中心,福建 福州,350117)4(福清市新大泽螺旋藻有限公司,福建福清,350300)
虾青素由于具有超强的抗氧化能力和出色的着色能力,被广泛地运用到水产养殖业、化妆品行业、健康食品行业和制药行业[1-4]。雨生红球藻(Haematococcus pluvialis)是一种常见的生存于淡水中的单细胞绿藻,生长周期中明显地呈现出2个阶段:在生长条件适宜的情况下,以绿色带鞭毛的可游动细胞形态大量繁殖;在生长环境不利的情况下,绿色游动细胞逐渐丧失鞭毛,细胞壁加厚,形成红色包囊,同时细胞质油脂小泡中大量积累虾青素。在不利条件下积累虾青素的含量可高达干重的5%[5],并且具有所需营养简单的特点,因此被认为是生产虾青素最好的自然资源。
然而与螺旋藻、小球藻等已工业化生产的微藻相比,雨生红球藻由于生长缓慢、生长温度较低、易受污染等原因使得大规模高密度培养受到限制[6-7],同时这也是如何利用雨生红球藻实现虾青素高产的研发热点与难点。国外有少数几家企业能够商业化培养雨生红球藻,但它们对技术实行了严格的保密,形成垄断[8]。国内也有不少的研究者对雨生红球藻进行了研究,但所得到的虾青素含量和生物量都比较低[9-15]。
本文对1株高产虾青素的雨生红球藻胁迫培养条件进行研究,在此基础上,于2013年8月~2014年1月到位于四川省米易县的宇昌微藻有限公司采用平板式光照生物反应器进行中试实验,以期为该雨生红球藻的大规模培养提供理论依据。
1 材料与方法
1.1 实验藻种
实验用雨生红球藻藻种保存于本研究室。
1.2 胁迫条件对雨生红球藻积累虾青素的影响
500 mL三角瓶装200 mL培养液,培养基为BG11,培养温度(25±2)℃,日光灯提供光照,光强900~1 100 Lux,每天振摇3次,培养14 d。将细胞浓度调整至2.5×105个/mL的藻液作为接种液,按接种液和新鲜培养基的体积之比1∶4,将接种液接种至各胁迫培养基中,每个处理设3个重复。
氮、磷饥饿对雨生红球藻积累虾青素的影响,采用含原培养基1/10、1/5和不含氮、磷的BG11培养基,培养温度(25±2)℃,每天摇3次,在光照强度4 000~6 000 Lux下连续胁迫培养11 d,以完整的BG11培养基培养作为对照。
进行盐浓度胁迫时,采用含NaCl质量浓度为4、6和8 g/L的BG11培养基,以不含NaCl的基本BG11培养基作为对照,其余条件与氮、磷饥饿时相同。
光照强度对雨生红球藻积累虾青素的影响,采用4 000~6 000 Lux(I1)、6 000 ~8 000 Lux(I2)、8 000 ~10 000 Lux(I3)3个范围的光照,使用基本的BG11培养基与完全缺氮培养基培养,其余条件与氮、磷饥饿时相同。
装液量对雨生红球藻积累虾青素的影响,用500 mL三角瓶作为培养容器,使用基本BG11在4 000~6 000 Lux光照强度下培养,完全缺氮和缺磷培养基在6 000~8 000 Lux光照强度下培养,设置接种后总体积分别为100、150、200 mL三个实验组,其余条件与氮、磷饥饿对雨生红球藻积累虾青素的影响相同。
1.3 平板式光照生物反应器培养雨生红球藻
利用自行构建的平板式光照生物反应器培养雨生红球藻,反应器由支架框、PE材质透明袋、曝气系统、取样管四部分构成。在营养细胞培养阶段采用长1 m、宽0.1 m、高1 m的平板式生物反应器,使用BG11培养基,培养液体积为40 L,以8 L/min的通气量通入空气,光强为4 000~5 000 Lux,每日取样测量生物量。在胁迫阶段采用长1 m、宽0.06 m、高1 m的平板式光照生物反应器,使用缺氮的BG11培养基,培养液体积为50 L。每天10∶30~16∶30于室外通过增减表面遮盖的透光性良好的PE薄膜袋数量来控制光强,利用增大表面通风量的方法控制温度不超过27℃。每天16∶30至次日10∶30将反应器搬至恒温室内[(25±2)℃],由日光灯从两侧提供光照,光强为8 000~10 000 Lux,以10 L/min的通气量通入空气,每隔48 h取样测量生物量及虾青素含量。
1.4 生长指标测定
1.4.1 细胞计数
按照金传荫等的方法,用“浮游生物计数框”进行细胞计数[9]。
1.4.2 细胞干重的测定
取30 mL 藻液,8 000 r/min,4 ℃,离心 15 min,去上清液,蒸馏水洗涤1次,置于70℃烘箱内烘至恒重,冷却后称重。
1.4.3 虾青素含量与浓度的测定
参照Boussiba等的方法,使用DMSO作为萃取剂,测量藻细胞中虾青素的含量与培养液中虾青素浓度[16]。
1.4.4 生产率的测定
生产率[g/(L·d)]计算:

其中DWt和DW0分别指培养t天和起始生物量干重,g/L;t指培养时间,d。
2 结果与讨论
2.1 胁迫条件对雨生红球藻积累虾青素的影响
促进雨生红球藻积累虾青素的方法中,营养饥饿处理和高光处理较为容易实现且效果明显。不同胁迫条件对雨生红球藻积累虾青素的影响见图1。
从图1-A中可以看出,虾青素浓度随着培养基中氮含量的下降而上升,在不含氮的培养条件下,虾青素浓度可达到(13.92±0.24)mg/L。缺氮之所以能够引起雨生红球藻积累虾青素,董庆霖等认为是由于培养基中氮浓度下降到一定程度时会抑制1,5-二磷酸核酮糖羧化酶和硝酸还原酶的活性,当两种酶的活性下降到一定水平时会引发雨生红球藻积累虾青素[10];同时缺氮情况下1,5-二磷酸核酮糖羧化酶作为氮库为虾青素的积累提供氮源[11]。同氮饥饿处理一样虾青素浓度随着培养基中磷含量的下降而上升,在不含磷的培养条件下,虾青素浓度可达到(17.52±1.43)mg/L(见图1-B)。缺磷有助于雨生红球藻从游动细胞转向不动包囊体细胞,同时有效地刺激虾青素的合成[17]。
从图1-C中可以看出,虾青素浓度先随着NaCl浓度的增加而增加,但NaCl浓度超过6 g/L时,随着NaCl浓度的增加会引起虾青素含量的下降。这是由于NaCl在较低浓度时可以在不损坏藻细胞的情况下促进虾青素的积累,而当NaCl浓度过高时,藻体细胞会完全失去繁殖能力甚至裂解死亡[18]。最适合该藻积累虾青素的NaCl质量浓度为6 g/L,虾青素质量浓度达(13.86±0.83)mg/L。
从图1-D中可以看到,高光强对雨生红球藻积累虾青素的影响,在基本培养基中,虾青素浓度在光强4 000~6 000 Lux和光强6 000~8 000 Lux的培养条件下无明显区别,分别为(8.32±0.12)mg/L和(8.02±0.37)mg/L。而在缺氮培养基中,6 000~8 000 Lux光强的培养条件下的虾青素浓度为(22.98±0.11)mg/L,比4 000~6 000 Lux光强的培养条件下高出66.34%。无论是在基本培养基或缺氮培养基,光强超过8 000 Lux时虾青素浓度会出现明显的下降。这是因为光强过高时会损害藻体细胞积累虾青素的能力,并引起细胞死亡[19]。才金玲等单独使用高光胁迫培养雨生红球藻,最终得到的虾青素含量为 0.62%(干重比),生物量为 0.44 g/L[12];庄惠如等结合氮饥饿和高光胁迫培养,得到的虾青素含量为6.34 mg/L[13]。本实验在光强 6 000 ~8 000 Lux、缺氮、培养液体积为100 mL/500 mL三角瓶的条件下得到的虾青素含量和生物量都比上述的实验结果高,但低于Boussiba等使用缺氮或缺磷结合高光处理的方法,得到虾青素含量超过100 mg/L的实验结果[20],以及Kang等人采用高光、缺氮、通入含5%CO2的空气、培养液体积为130 mL(500 mL三角瓶)培养时得到的虾青素含量大于7%,生物量为2.28 g/L的实验结果[21]。

图1 胁迫条件对雨生红球藻积累虾青素的影响Fig.1 Effects of stress induced conditions on the accumulation of astaxanthin in Haematococcus pluvialis
装液体积的变化会影响光径和培养液中气体的交换,进而影响藻体细胞的生长和虾青素的积累。从图1-E可以看到,无论是在基本培养基还是缺氮、缺磷培养基中,虾青素的浓度都随着培养体积的增加而下降,培养液体积为100 mL时最适合该藻积累虾青素,配合缺氮、6 000~8 000 Lux光强胁迫培养时,虾青素浓度为(59.23±2.13)mg/L,可达藻细胞干重的(4.20±0.19)%。
在综合各单因子实验得出的条件下胁迫培养雨生红球藻12 d,虾青素的积累情况如图1-F所示,雨生红球藻中的虾青素含量在前10天都在增加,第10天达到最高水平为(4.16±0.25)%;而生物量一直都在增加,到第12天达到(1.1±0.02)g/L,虾青素质量浓度最终为(44.58±2.68)mg/L。
2.2 平板式光照生物反应器中雨生红球藻的生长情况
实验于(25±2)℃恒温室内进行。从图2可以看到,在平板式反应器中,当接种浓度为OD681=0.24时,雨生红球藻生长过程未有明显的生长延滞期,接种后进入对数生长阶段直到12 d,期间生产率为0.048 5 g/(L·d),第13天后进入平稳期,大部分细胞转变为不动孢子,最终生物量可达到0.88 g/L。当接种浓度为OD681=0.14时,前3天为生长延滞期,从第4天到第8天为对数生长时期,而后进入平稳期。这主要是由于接种浓度较高时,可使藻细胞较快地适应新的培养环境。
采用半室外条件下平板式反应器培养雨生红球藻,实验于与外界气温相同,但无阳光直射的房间内进行,光照主要由自然光提供,附加日光灯,确保光强度为4 000 ~5 000 Lux,每日最低温度于4∶00 ~5∶00测得,最高温度于14∶00~15∶00测得。由于温度的变化,雨生红球藻的生长情况与在室内恒温条件下有所不同。从表1中可以看出在半室外条件下,当接种浓度为OD681=0.24,藻细胞经过1天的适应后开始快速生长直至第13天,前13天的生产率为0.057 1 g/(L·d),14 d后进入生长稳定期,藻细胞大部分转变为不动孢子,最终生物量为1.04 g/L。
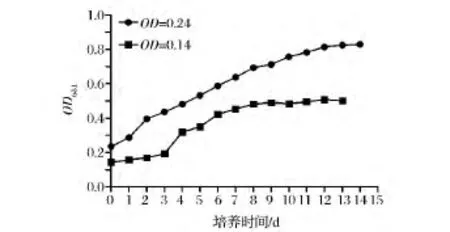
图2 室内平板式光生物反应器中雨生红球藻的生长曲线Fig.2 The growth curve of Haematococcus pluvialis in indoor flat-photobioreactor
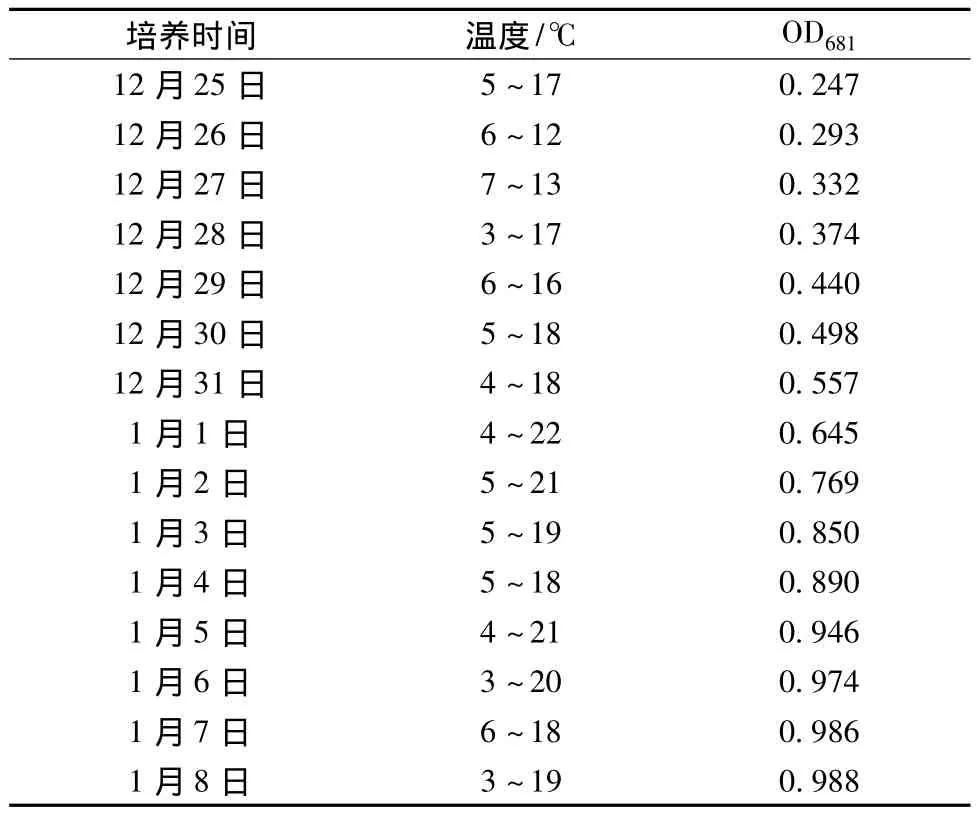
表1 半室外平板式光照生物反应器中雨生红球藻的生长Table 1 The growth of Haematococcus pluvialis in flatphotobioreactor in semi-outdoor process
在半室外培养雨生红球藻绿色细胞时,在接种浓度较低时(OD681=0.14),几乎无法生长。
2.3 平板式光照生物反应器中雨生红球藻积累虾青素情况
由于室外昼夜温差较大且室内光强无法胁迫平板式光照生物反应器内的藻细胞变红,因此采取半室外的胁迫培养方式,实验结果见表2和图3。

表2 半室外胁迫培养过程中雨生红球藻积累虾青素Table 2 Astaxanthin accumulated in Haematococcus pluvialis in stress induced process and semi-outdoor condition

图3 半室外胁迫培养过程中雨生红球藻生物量和虾青素生产率的变化Fig.3 The biomass and astaxanthin productivities of Haematococcus pluvialis in stress induced process and semi-outdoor condition
从表2可看到在胁迫起始阶段(开始2 d)虾青素的含量会有所下降,这是由于在胁迫起始阶段的光强偏弱,且培养液中的氮源仍未消耗完全,导致藻细胞仍可以分裂繁殖;而后随着光强的提高,藻细胞繁殖受到抑制,细胞转变为包囊状态开始较快地积累虾青素,培养16 d,虾青素生产率为1.05 mg/(L·d),最终虾青素浓度可达到17.49 mg/L,生物量为1.17 g/L。
在半室外胁迫变红过程中,生物量的生产率先随着光强的增加而提高,在第6天时达到最大值0.086 g/(L·d),而后随着光强的增加而下降。这主要是由于在胁迫培养前期光照较弱,部分藻细胞仍能分裂繁殖,随着光照强度的提高,藻细胞受到的胁迫压力逐渐增大,细胞繁殖功能受影响,造成生物量增加但产率下降。虾青素生产率由藻体生物量和藻细胞中的虾青素含量共同决定,因此虾青素生产率的变化和生物量的不同。胁迫培养前6天,由于生物量和藻细胞中虾青素含量的快速增加,虾青素生产率快速提高,从第6到第8天虽然藻生物量的增加幅度变小,但藻细胞中虾青素的积累仍十分迅速,致使此时间段虾青素生产率仍快速增长。第8天后由于藻生物量增长速度和藻细胞中虾青素积累速度放缓,造成虾青素生产率下降,而后进入缓慢增长阶段(见图3)。
李晓梦等利用混养培养的方法在室外实现了雨生红球藻的扩大培养,其放大规模(10 L)下所得到的藻粉产量(0.20 g/L)和虾青素含量(0.86%)均低于本实验的结果[14];沈渊等在室内利用气升式光生物反应器培养雨生红球藻取得了单位体积虾青素产量和本实验相当的结果(18 mg/L),但扩大规模仅为20 L,且反应器结构复杂、造价昂贵(NHL-Ⅲ型光生物反应器)[15];WANG等利用气升式光生物反应器培养雨生红球藻,在室外扩大培养中得到了高达160 mg/L的虾青素浓度,但放大规模仅为0.6 L[22];刘伟等利用生物幕技术成功地进行了雨生红球藻的规模化培养,培养体积在营养阶段达到40 t,但胁迫变红的生物幕技术使用固定化培养,造成生物量低[23]。
3 结论
胁迫条件探究实验表明,完全缺氮有利于雨生红球藻积累虾青素,虾青素产量可达到(13.92±0.24)mg/L。完全缺磷有利于雨生红球藻积累虾青素,虾青素产量可达到(17.52±1.43)mg/L。NaCl胁迫培养时,藻细胞中虾青素的含量随着NaCl浓度的增加而升高,但浓度过高时会对藻细胞的生长产生抑制,甚至引起藻体的裂解死亡,最适合此藻积累虾青素的氯化钠浓度为6 g/L,虾青素产量可达到(13.86±0.83)mg/L。光强在较低水平时可以提高虾青素在藻细胞中的含量,当光强超过8 000 Lux时不仅会抑制藻细胞的生长还会损害其积累虾青素的能力,适合此藻积累虾青素的光强为6 000~8 000 Lux,在缺氮情况下可获得(22.98±0.11)mg/L的虾青素产量。培养液体积的改变可通过改变光径和气体的交换影虾青素在藻中的积累,100 mL的装液体积培养时虾青素浓度可到达(20.29±1.01)mg/L。综合上述各因子最优条件胁迫培养时,虾青素浓度为(44.58±2.68)mg/L。
利用平板式光照生物反应器进行中试试验。在绿色细胞培养阶段,使用平板式光照生物反应器在室内和半室外培养时,培养液中的生物量可达到0.88 g/L与1.04 g/L,在进入稳定期前生产率分别为0.048 5 g/(L·d)和0.057 1 g/(L·d);在胁迫变红阶段,使用平板式光照生物反应器在半室外的培养条件下生物量可达到1.17 g/L,藻细胞中虾青素含量为1.49%,单位体积虾青素产量为17.49 mg/L,虾青素生产率为1.05 mg/(L·d)。
[1] Sheikhzadeh N,Panchah I K,Asadpour R,et al.Effects of Haematococcus pluvialis in maternal diet on reproductive performance and egg quality in rainbow trout(Oncorhynchus mykiss)[J].Animal Reproduction Science,2012,130(1):119-123.
[2] Tominaga K,Hongo N,Karato M,et al.Cosmetic benefits of astaxanthin on humans subjects[J].Acta Biochimica Polonica,2012,59(1):43 -47.
[3] Palozza P,Torelli C,Boninsegna A,et al.Growth-inhibitory effects of the astaxanthin-rich alga Haematococcus pluvialis in human colon cancer cells[J].Cancer Letters,2009,283(1):108-117.
[4] Fassett R G,Coombes J S.Astaxanthin,oxidative stress,inflammation and cardiovascular disease[J].Future Cardiolgy,2009,5(4):333 -342.
[5] Grung M,D'Souza F M,Borowitzka M,et al.Algal carotenoids 51.Secondary Carotenoids 2.Haematococcus pluvialis aplanospores as a source of(3S,3'S)-astaxanthin esters[J].Journal of Applied Phycology,1992,4(2):165 -171.
[6] Harker M,Tsavalos A J,Young A J.Autotrophic growth and carotenoid production of Haematococcus pluvialis in a 30 liter air-lift photobioreactor[J].Journal of Fermentation and Bioengineering,1996,82(2):113 -118.
[7] Choi S-L,Suh I S,Lee C-G.Lumostatic operation of bubble column photobioreactors for Haematococcus pluvialis cultures using a specific light uptake rate as a control parameter[J].Enzyme and Microbial Technology,2003,33(4):403-409.
[8] Del Campo J A,García-González M,Guerrero M G.Outdoor cultivation of microalgae for carotenoid production:current state and perspectives[J].Applied Microbiology and Biotechnology,2007,74(6):1 163 -1 174.
[9] 金传荫,宋立荣,刘永定.红球藻水生784株营养需求的研究[J].水生生物学报,1996,20(3):292-296.
[10] 董庆霖,赵学明,邢向英,等.碳和氮代谢被抑制诱导雨生红球藻细胞内虾青素的合成[J].化学工程,2006,34(12):48 -57.
[11] 韦韬,顾文辉,李健,等.不同碳氮浓度对雨生红球藻生长及虾青素累积的影响[J].海洋科学,2012,36(11):55-61.
[12] 才金玲,欧阳泽瑞,陈国兴,等.光照强度对雨生红球藻细胞生长和虾青素积累的影响[J].食品科技,2013,38(1):17 -25.
[13] 庄惠如,施巧琴,卢海生,等.营养胁迫对雨生红球藻虾青素积累的影响[J].水生生物学报,2000,24(3):208-212.
[14] 李晓梦,齐安翔,蔡明刚,等.雨生红球藻室外大体积培养与虾青素积累初步研究[J].厦门大学学报,2006,45(S1):245-249.
[15] 沈渊,蔡明刚,黄水英,等.利用光生物反应器培养雨生红球藻的研究初探[J].海洋科学,2010,34(10):83-89.
[16] Boussiba S,Fan L,Vonshak A.Enhancement and determination of astaxanthin accumulation in green alga Haematococcus pluvialis[J].Methods in Enzymology,1992,213:386-391.
[17] 胡章立,吴玉荷,罗杏桃.雨生红球藻细胞类型转化影响因子的协同作用[J].深圳大学学报,2002,19(3):8-12.
[18] Cifuentes A S,Gonzalez M A,Vargas S,et al.Optimization of biomass,total carotenoids and astaxanthin production in Haematococcus pluvialis Flotow strain Steptoe(Nevada,USA)under laboratory conditions[J].Biological Research,2003,36(3-4):343 -357.
[19] 董伟婷.雨生红球藻Haematococcus pluvialis CG-11积累虾青的生态调控[D].广州:暨南大学,2007:31-35.
[20] Boussiba S,Bing W,YUAN J P,et al.Changes in pigments profile in the green alga Haeamtococcus pluvialis exposed to environmental stresses[J].Biotechnology Letters,1999,21(7):601 -604.
[21] Kang C D,Lee J S,Park T H,et al.Complementary limiting factors of astaxanthin synthesis during photoautotrophic induction of Haematococcus pluvialis:C/N ratio and light intensity[J].Applied Microbiology and Biotechnology,2007,74(5):987 -994.
[22] WANG J,Sommerfeld M R,LU C,et al.Combined effect of initial biomass density and nitrogen concentration on growth and astaxanthin production of Haematococcus pluvialis(Chlorophyta)in outdoor cultivation[J].Algae,2013,28(2):193-202.
[23] 刘伟,刘建国,林伟,等.雨生红球藻规模化培养工艺的构建与应用[J].饲料工业,2006,27(12):12-17.
