肌醇对结肠癌HT-29细胞体外生长的抑制作用
2015-05-11赵倩倩宋扬刘桂园陈沉
赵倩倩,宋扬,刘桂园,陈沉
(青岛大学医学院营养研究所,山东 青岛 266021)
·肿瘤专题·
肌醇对结肠癌HT-29细胞体外生长的抑制作用
赵倩倩,宋扬,刘桂园,陈沉
(青岛大学医学院营养研究所,山东 青岛 266021)
目的 观察肌醇对人结肠癌HT-29细胞体外生长的影响,探讨肌醇对结肠癌细胞增殖及凋亡方面的作用。方法 采用MTT实验,检测不同浓度肌醇对结肠癌HT-29细胞的抑制率;免疫细胞化学实验测定增殖细胞核抗原(PCNA)的表达情况;流式细胞仪检测细胞周期变化及凋亡发生率。结果 MTT实验结果显示,随着肌醇剂量的增加,肌醇对结肠癌HT-29细胞的抑制率明显增高(F=682.048,q=8.293~44.146,P<0.05);免疫细胞化学实验显示,与对照组比较,肌醇干预组对PCNA的表达有显著抑制的作用(F=149.973,q=4.450~20.826,P<0.05);流式细胞仪检测结果显示,随着肌醇剂量的增加,HT-29细胞停留在G0/G1期比例增加,S期、G2/M期的比例减少(F=31.109~59.178,q=2.660~12.783,P<0.05);与对照组相比,各肌醇干预组HT-29细胞凋亡率均有明显升高(F=1 214.826,q=16.587~56.885,P<0.05),并且随着肌醇剂量的增大,各肌醇干预组细胞凋亡率逐渐升高。结论 肌醇通过阻滞HT-29细胞周期,抑制细胞增殖,诱导细胞凋亡,从而发挥抑制结肠癌HT-29细胞生长的作用。
肌醇;结肠肿瘤;HT-29细胞;细胞增殖;细胞凋亡
结肠癌是一种常见恶性肿瘤,严重危害人们的健康,在世界范围内年发病率较高,仅次于肺癌及胃癌[1]。近年来,人们的生活质量越来越高,饮食习惯也发生了很大的变化,结肠癌发病率呈现逐步上升的趋势。肌醇六磷酸(IP6)是一种含6个磷酸的肌醇酯,能抑制多种癌细胞系的生长,具有广谱抗癌活性[2-6]。IP6进入体内会迅速水解,在肠道中可解离形成其次级磷酸化形式。IP6可能是通过其次级磷酸化形式,参与细胞的增殖、分化、凋亡等过程而发挥抗癌功能。肌醇是IP6的次级磷酸化形式之一,它广泛存在于谷类、豆类和干果中[7]。近年来研究显示,肌醇能抑制肺癌、乳癌细胞的生长分化[8-9],但关于肌醇直接干预结肠癌细胞的研究较少。本实验探讨肌醇对结肠癌HT-29细胞增殖和凋亡的作用。
1 材料与方法
1.1材料
1.1.1细胞 人结肠癌细胞系HT-29,购自中国科学院上海细胞库。
1.1.2主要试剂 肌醇、四甲基偶氮噻唑盐(MTT)均购自美国Sigma公司;胎牛血清、RPMI 1640培养基均购自美国Hyclone公司;兔抗人增殖细胞核抗原(PCNA)蛋白抗体购自北京博奥森生物技术有限公司;Annexin V-FITC/PI细胞凋亡、细胞周期与凋亡检测试剂盒均购自碧云天生物技术研究所。
1.2方法
1.2.1细胞培养 HT-29细胞常规培养于含体积分数0.10胎牛血清的RPMI 1640培养液中,细胞在37 ℃、体积分数为0.05的CO2细胞培养箱中贴壁生长,取对数生长期细胞用于实验。
1.2.2MTT实验检测细胞的抑制率 选用生长状态较好的细胞,采用胰蛋白酶消化得到单细胞悬液,调整细胞密度为5×107/L。吹打均匀后,将其接种在96孔板(每孔100 μL)中,每组设立5个复孔。12 h后显微镜下观察细胞贴壁较好,吸除各孔细胞液,各组分别加入100 μL含0 mmol/L肌醇(对照)及1、2、4 mmol/L肌醇的培养液。48 h后,每孔加20 μL的MTT溶液(5 g/L),置于培养箱中继续培养4 h后,除去各孔培养液,分别加入150 μL二甲基亚砜(DMSO),连续震荡5 min,待结晶物完全溶解后,使用酶标仪检测各孔吸光度(A)值(490 nm波长处),选取复孔A值的平均值作为统计数据,计算肿瘤细胞生长的抑制率。肿瘤细胞抑制率(%)=(1-A干预组/A对照组)×100%。
1.2.3免疫细胞化学实验检测PCNA的表达①使用胰蛋白酶消化细胞,可得密度为5×108/L的细胞悬液。把载玻片(已高压灭菌)置于培养皿中,载玻片中心滴加已调好密度的细胞悬液,培养皿中滴加一定量的培养液(含体积分数0.10胎牛血清)。每一组设3个平行样,将其置于37 ℃、含体积分数0.05的CO2的恒温培养箱中培养。②12 h后吸去载玻片上液体,加入含0 mmol/L肌醇(对照)及1、2、4 mmol/L肌醇的培养液继续培养48 h。③用镊子取出载玻片,PBS清洗3次后,用冰浴的丙酮固定细胞5 min。④向载玻片中心加入Trition-X100溶液(体积分数0.01),10 min后用PBS清洗3次。⑤继续向载玻片中心加体积分数为0.30的H2O2,15 min后用PBS清洗3次。⑥对细胞进行染色。其中包括DAB显色、苏木精复染、梯度乙醇脱水,中性树胶封片4个步骤。在光镜下观察,视野中细胞里出现棕黄(褐)色颗粒者视为阳性。任取8个以上高倍视野,每个视野计数120个细胞,同等条件下用Image Pro Plus图像分析系统检测平均值。
1.2.4流式细胞仪检测细胞周期分布的改变①选取状态较好的细胞,用胰蛋白酶消化后得到细胞悬液,调整细胞密度为1×109/L,接种于6孔板,每个组设3个复孔,置于 37 ℃恒温CO2培养箱中培养1 d。②除去培养液,各组加入含0 mmol/L肌醇(对照组)及1、2、4 mmol/L肌醇培养液后,培养48 h。③用胰蛋白酶消化细胞,得到的细胞悬液以1 000 r/min离心5 min,PBS清洗3次后,用冰浴乙醇(体积分数为0.70)固定细胞4 h。④再用预冷的PBS冲洗细胞,以1 000 r/min离心5 min。⑤加入PI染液10 μL,慢慢吹打混匀细胞悬液,在37 ℃水浴锅内孵育30 min(此过程需避光),上流式细胞仪检测细胞周期情况。实验重复3次。
1.2.5Annexin V-FITC/PI双染法检测细胞凋亡①取生长状态较好的细胞消化、计数,以每孔1×105接种于6孔板中,每组设置3个复孔,置于37 ℃、含体积分数0.05的CO2培养箱中培养24 h。②吸去每孔培养液,分别加入含0 mmol/L肌醇(对照)及1、2、4 mmol/L的肌醇培养液后,继续培养48 h。③用胰蛋白酶消化各孔细胞,制成单细胞悬液,使细胞数达到105以上。PBS冲洗2次后,用Binding Buffer(400 μL)悬浮,加入AnnexinV-FITC(5 μL)混匀,在室温下避光孵育15 min。④加入PI染色液(5 μL)混匀,冰浴避光静置5 min,30 min内上流式细胞仪检测。混匀后用流式细胞仪检测细胞凋亡情况。实验重复3次。
1.3统计学处理
2 结 果
2.1MTT实验检测不同浓度肌醇干预对HT-29细胞增殖的影响
对照组及1、2、4 mmol/L肌醇干预组48 h HT-29细胞的A值分别为1.503±0.017、1.309±0.016、1.207±0.018、0.959±0.018,各组间HT-29细胞A值比较,差异均有显著性(F=682.048,q=8.293~44.146,P<0.05)。1、2、4 mmol/L肌醇干预组对细胞抑制率分别为12.9%、19.7%、46.2%。
2.2肌醇干预对HT-29细胞PCNA表达的影响
对照组及1、2、4 mmol/L肌醇干预48 h HT-29细胞PCNA的表达水平分别为0.496±0.014、0.396±0.004、0.348±0.018、0.2700±0.020。各肌醇干预组与对照组相比较,差异均有显著意义(F=149.973,q=4.450~20.826,P<0.05)。
2.3肌醇干预对HT-29细胞周期的影响
流式细胞仪检测结果表明,随着肌醇干预浓度的升高,HT-29细胞周期分布产生了改变,阻滞于G0/G1期的细胞比例上升,S期和G2/M期的细胞比例下降。各肌醇干预组与对照组相比,差异均有显著性(F=31.109~59.178,q=2.660~12.783,P<0.05)。见表1。
2.4肌醇干预对HT-29细胞凋亡的影响
对照组及1、2、4 mmol/L的肌醇干预48 h HT-29细胞的凋亡率分别为(2.585±0.065)%、(8.523±0.565)%、(15.665±0.287)%、(22.950±0.787)%。组间比较差异均有显著性(F=1 214.826,q=16.587~56.885,P<0.05)。见图1。

表1 不同浓度肌醇干预对HT-29细胞周期的影响
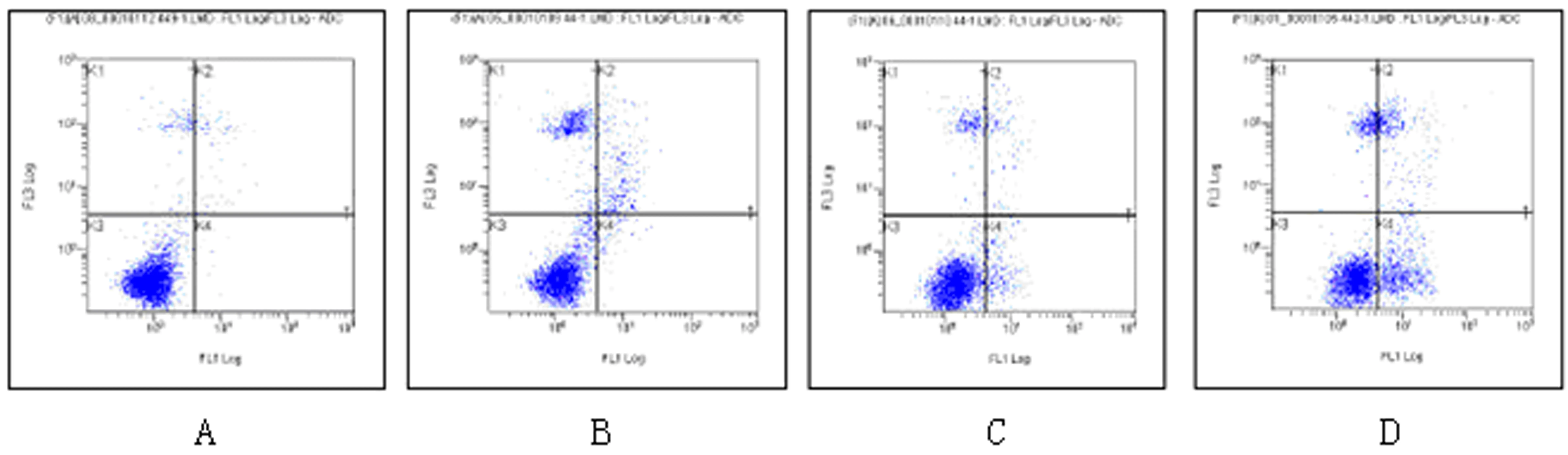
A:对照组,B:1 mmol/L肌醇干预组,C:2 mmol/L肌醇干预组,D:4 mmol/L肌醇干预组。
3 讨 论
癌症发生的本质为细胞增殖失控和细胞凋亡受阻[10],因此,抑制癌细胞增殖和促进癌细胞凋亡在抗癌研究中尤为重要。本实验以结肠癌HT-29细胞为研究对象,从增殖和凋亡方面研究肌醇对癌细胞体外生长的影响。
MTT法是常用的体外药敏试验方法,通过该法可测定细胞内线粒体脱氢酶活性,从而反映癌细胞增殖状态[11]。本研究通过观察不同浓度肌醇干预对HT-29细胞增殖的影响,结果显示,各干预组与对照组相比A值均降低,说明肌醇对HT-29细胞的增殖具有抑制作用,且抑制作用随浓度的增加而增强。其中肌醇在4.0 mmol/L浓度时,抑制率可达46.2%,显示出较优的抗癌特性。
PCNA是DNA聚合酶δ的辅酶,能够直接参与细胞的增殖(如DNA复制)。PCNA在未分裂的细胞中含量非常少,一般从DNA合成时的G1末期上升,至S期可达到峰值,G2期逐步下降,至M期含量降到最少,此变化正和细胞增殖相一致[12-13]。本研究通过免疫细胞化学实验测定肌醇干预前后HT-29细胞PCNA的表达情况,结果显示,各肌醇干预组和对照组比较,平均PCNA的表达均明显下降,表明肌醇能够抑制细胞内PCNA的表达,从而对癌细胞的增殖产生抑制作用。
癌细胞的增殖异常,关键点在于细胞周期的调节失控。在细胞周期中,G1→S→G2→M期相互转换过程中有多个关卡调节着细胞周期的演进速度,G1期能否成功进入S期决定了细胞是否继续增殖、停滞或死亡[14-15]。通过流式细胞仪检测不同浓度肌醇对HT-29细胞周期的分布的影响,可知肌醇能够将结肠癌HT-29细胞阻滞于G1期,且随着肌醇剂量的增加,对细胞的周期阻碍作用更加显著。从而可以认为肌醇能够阻滞细胞周期,进而阻碍DNA合成而发挥抗增殖作用。
凋亡能够清理已损的细胞,维持机体本身的平衡稳态。癌症发生的重要危险因素之一就是阻碍了细胞的凋亡。本实验采用Annexin V-FITC/PI双染法检测细胞凋亡率的变化,实验结果表明,肌醇能诱导HT-29细胞发生凋亡,且随着肌醇剂量的增加,HT-29细胞凋亡率逐步增加。
综上所述,本研究从细胞增殖及细胞凋亡方面证实了一定浓度的肌醇可通过阻滞HT-29细胞周期,抑制细胞增殖,诱导细胞发生凋亡,从而发挥抑制HT-29细胞生长的作用。其深层次的作用机制,有待于进一步探讨。
[1] 宋莉,宋扬. IP6对人结肠癌细胞HT-29凋亡Caspase3基因作用[J]. 青岛大学医学院学报, 2008,44(3):201-204.
[2] TANTIVE JKUL K, VUCENIK I, SHAMSUDDIN A M. Inositol hexaphosphate (IP6) inhibits key events of cancer metastasis: Ⅱ. Effects on integrins and focal adhesions [J]. Anticancer Res, 2003,23 (5A):3681-3689.
[3] SINGH R P, AGARWAL R. Prostate cancer and inositol hexaphosphate: efficacy and mechanisms [J]. Anticancer Res, 2005,25(4):2891-2903.
[4] 王路,杨志平,崔洪斌. 植酸对胃癌细胞恶性增殖的抑制作用研究[J]. 卫生研究, 2008,37(3):299-301.
[5] 杨伟品,宋扬,孟显锋. 肌醇六磷酸对肝癌HepG2细胞增殖的影响[J]. 青岛大学医学院学报, 2011,47(4):293-295.
[6] 刘晓燕,宋扬. 肌醇六磷酸对结肠癌HT-29细胞分化的影响[J]. 齐鲁医学杂志, 2008,23(3):189-194.
[7] MALVASI A, CASCIARO F, MINERVINI MM, et al. Myo-inositol, D-chiro-inositol, folic acid and manganese in second trimester of pregnancy: a preliminary investigation [J]. Eur Rev Med Pharmacol Sci, 2014,18(2):270-274.
[8] LAM S, MVWILLIAMS A, LERICHE J. A phase I study of myo-inositol for lung cancer chemoprevention [J]. Cancer Epidemiol Biomarkers Prev, 2006,15(8):1526-1531.
[9] IVAN B, NIKICA D, ROBERT K, et al. Efficacy of IP6+inositol in the treatment of breast cancer patients receiving chemotherapy: prospective, randomized, pilot clinical study[J]. J Exp Clin Cancer Res, 2010,29(1):12.
[10]方细堂. 细胞分化停滞是肿瘤形成的本质[J]. 中国病理生理杂志, 2000,16(10):1072-1073.
[11]AMBROSINI G, ADIDA C, ALTIERI DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma[J]. Nat Med, 1997,3(8):917-921.
[12]HALL P A, LEVISON D A, WOODS A L. Proliferating cell nuclear antigen (PCNA) immunolocalization in paraffin sections: an index of cell proliferation with evidence of deregula-ted expression in some neoplasms [J]. J Pathol, 1990,162(4):285-294.
[13]DIERENDONCK J H. WIJSMAN J U, KEIJZER R, et al. Cell-cycle-related staining patterns of antiprol ferating cell nuclear antigen monoclonal antibodies. Comparison with Brd Urd labeling and Ki-67 staining[J]. Am J Pathol, 1991,138(5):1165.
[14]宋扬,张铮,马葆兰. 肌醇六磷酸对人结肠癌细胞系HT-29细胞周期的影响[J]. 营养学报, 2007,29(3):246-249.
[15]张笑雪,于壮,宋扬. 刺参黏多糖对Hela细胞PCNA表达及细胞周期的影响[J]. 山东医药, 2008,48(46):19-21.
(本文编辑 厉建强)
INHIBITION OF INOSITOL ON IN VITRO GROWTH OF COLON CANCER CELLS HT-29
ZHAOQianqian,SONGYang,LIUGuiyuan,CHENChen
(Department of Nutrition, Qingdao University Medical College, Qingdao 266021, China)
ObjectiveTo investigate the effects of inositol on in-vitro growth of human colon cancer cell lines HT-29 and explore its action on the proliferation and apoptosis of the cells.MethodsEmploying MTT test to detect the inhibition rates of different concentrations of inositol on HT-29 cells. Applying immunocytochemistry to determine the expression of PCNA. Using flow cytometry to measure the cell circle changes and incidence of apoptosis.ResultsMTT result showed that the inhibition rate of inositol on HT-29 cells increased along with the increase of the dose of inositol (F=682.048,q=8.293-44.146,P<0.05). Immunocytochemical experiment indicated, compared with the control group, inositol-treated groups had a higher inhibition on expression of PCNA (F=149.973,q=4.450-20.826,P<0.05). Flow cytometry result demonstrated that along with the increase of the dose of inositol, the proportion of HT-29 cells stayed in G0/G1phase increased and the cells of phase S and phase G2/M decreased (F=31.109-59.178,q=2.660-12.783,P<0.05). Compared with the control group, the apoptosis rates of HT-29 cells in all inositol-treated groups increased (F=1 214.826,q=16.587-56.885,P<0.05), and along with the increase of the dose of inositol, apoptosis rates of HT-29 cells in inositol-treated groups were gradually elevated.ConclusionInositol plays a role to inhibit the growth of HT-29 cells of colon cancer through blocking HT-29 cell cycle, inhibiting cell proliferation and inducing apoptosis of HT-29 cells.
inositol; colonic neoplasms; HT-29 cells; cell proliferation; apoptosis
2014-10-18;
2015-01-19
国家自然科学基金资助项目(81373001)
赵倩倩(1988-),女,硕士研究生。
宋扬(1968-),男,博士,教授,硕士生导师。
R151.3
A
1008-0341(2015)03-0253-04
