重组人KNDC1腺病毒表达载体的构建及其促HUVEC衰老作用
2015-07-31李开济郝晓方章广玲魏静波林雅军甄永占
李开济,郝晓方,章广玲,魏静波,魏 洁,林雅军,甄永占*
(1.华北理工大学 基础医学院 河北省慢性疾病重点实验室 唐山市慢性病临床基础研究重点实验室,河北 唐山 063000; 2.卫生部北京医院 卫生部北京老年医学研究所,北京 100730)
研究论文
重组人KNDC1腺病毒表达载体的构建及其促HUVEC衰老作用
李开济1,郝晓方1,章广玲1,魏静波1,魏 洁2,林雅军2,甄永占1*
(1.华北理工大学 基础医学院 河北省慢性疾病重点实验室 唐山市慢性病临床基础研究重点实验室,河北 唐山 063000; 2.卫生部北京医院 卫生部北京老年医学研究所,北京 100730)
目的构建人KNDC1腺病毒表达载体,观察其在人脐静脉内皮细胞(HUVEC)中的表达及功能。方法扩增KNDC1基因并与腺病毒骨架载体进行体外重组连接,经筛选、测序确认后转染进HEK293A细胞进行包装;按pAdenoX试剂盒的步骤纯化重组腺病毒,通过终点稀释法测定病毒滴度;用pAdeno Ⅹ-KNDC1感染HUVEC,48 h后用Western blot检测KNDC1蛋白表达水平;用SA-β-gal染色检测细胞衰老情况。结果经测序确认目的基因KNDC1成功克隆入腺病毒载体中。转染HEK293A细胞后观察到细胞变圆、部分细胞漂浮的特征性病变效应,病毒滴度达到1×1011PFU。感染了pAdeno Ⅹ-KNDC1的HUVEC中KNDC1蛋白表达水平显著升高(P<0.05)。随着pAdeno Ⅹ-KNDC1剂量的增加,衰老HUVEC数量增多。结论人KNDC1腺病毒表达载体构建成功并能促进HUVEC衰老。
KNDC1;腺病毒;同源重组;脐静脉内皮细胞
细胞衰老是生物体机能退行性改变的基础,血管内皮细胞衰老是内皮失功能的常见原因,也是动脉粥样硬化发生的病理生理机制之一。因此,研究与内皮细胞衰老相关的基因改变是探讨血管衰老机制的基础[1]。KNDC1(kinase non-catalytic C-lobe domain (KIND) containing 1, v-KIND)是2006年发现的基因,其存在于神经元树突、鸟苷酸交换因子复合物以及神经元细胞体中。在许多信号传导通路的蛋白间分子识别和功能调控中扮演着重要角色。但目前KNDC1域的结构和功能特征仍未知[2]。前期研究发现敲低KNDC1的表达能够促进人脐静脉内皮细胞增殖,延缓血管内皮细胞衰老[3]。但是,如果使KNDC1过表达是否能够抑制人脐静脉内皮细胞增殖呢?为回答这一问题,本研究构建了携带KNDC1基因的腺病毒载体,通过转染内皮细胞观察细胞衰老情况。
1 材料与方法
1.1 细胞与试剂
HEK293A细胞(卫生部北京老年医学研究所陈北冬博士馈赠)用含10%胎牛血清(HyClone公司)、100 U青霉素、100 U链霉素的DMEM培养基(HyClone公司)、在37 ℃、5% CO2孵箱(Thermo公司)传代培养。脐静脉内皮细胞(HUVEC)为本室从脐静脉中分离,用含20%胎牛血清的M199培养基(HyClone)培养,培养条件同上。KNDC1真核表达质粒pCMV6-AC-GFP-KNDC1(北京傲锐东源生物公司)。腺病毒构建系统Adeno-Ⅹ(Clontech公司),其中包括感受态细胞(StellaTM Competent Cells,E.coliHST08 strain)及腺病毒骨架载体(pAdeno Ⅹ-CMV)。限制性内切酶(NEB公司)。BCA 试剂盒(北京索莱宝公司)。抗KNDC1、β-actin抗体(Santa Cruz公司),兔抗山羊和山羊抗兔的二抗(Santa Cruz公司)。转染试剂lipofectamine 2000(Invitrogen公司)。衰老β-半乳糖苷酶染色试剂盒(SA-β-gal)(Sigma公司)。
1.2 获取目的基因
以pCMV6-AC-GFP-KNDC1质粒为模板进行PCR扩增获得KNDC1,再用琼脂糖胶回收法纯化目的基因。获得的目的基因KNDC1的两侧分别含有与pAdeno Ⅹ-CMV上重组位点两端同源的15 bp碱基对。用于扩增的上下游引物(Invitrogen公司合成)分别为:上游引物5′-GTAACTATAACGGTCATG CAGGCCATGGACC-3′;下游引物5′-ATTACCTCT TTCTCCGGAGCTCGCCGGCGCTA-3′,用于扩增的聚合酶为PrimeSTAR HS DNA polymerase with GC Buffer(TaKaRa公司)。
1.3克隆pAdeno Ⅹ-KNDC1
100 ng KNDC1(两端分别连接了15 bp的同源臂)与200 ng pAdeno Ⅹ-CMV混合,加入In-Fusion®HD酶(Clontech公司),50 ℃孵育15 min。取1.5 μL反应液加入一管感受态菌(100 μL)中进行转化。转化过程:冰上孵育30 min,42 ℃热激90 s,冰上孵育2 min后立即加入900 μL SOC培养基,37 ℃振荡培养1 h后取100 μL均匀涂布于含氨苄青霉素LB平板,37 ℃培养过夜后挑取单个克隆(图1)。
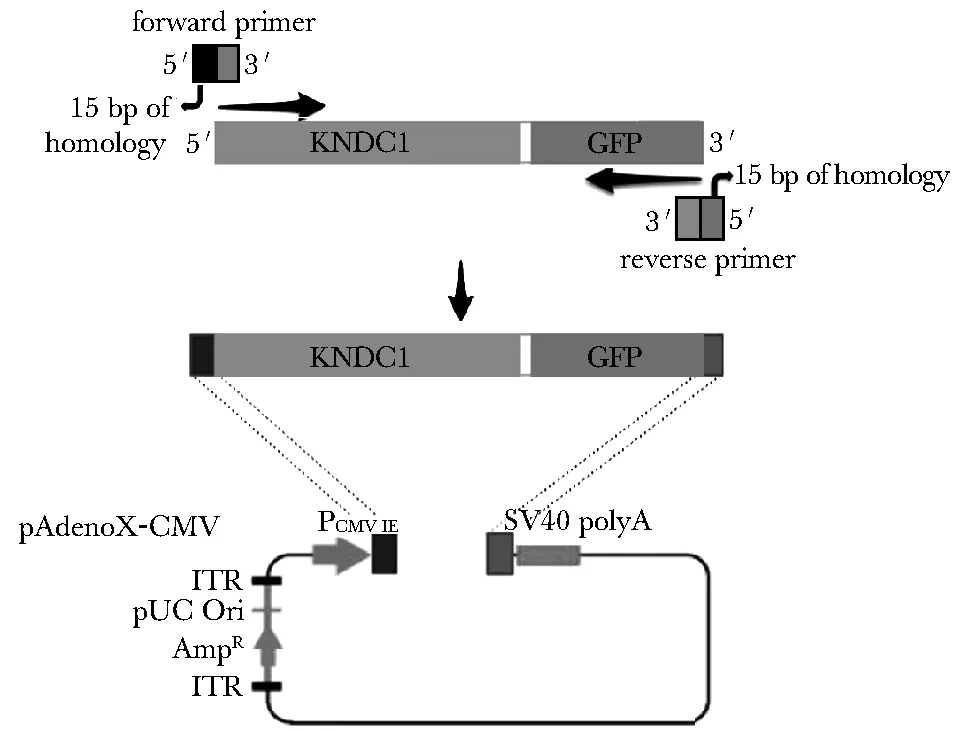
PCMV IE.cytomegalovirus immediate early promoter; SV40 polyA.simian virus 40 polyA signals; ITR.inverted terminal repeat; Amp: ampicillin图1 KNDC1腺病毒同源重组示意图Fig 1 Schematic diagram of homologous recomb-ination of pAdeno Ⅹ-KNDC1
1.4 pAdeno Ⅹ-KNDC1质粒的鉴定
挑取的单个克隆取少量作为模板进行菌落PCR,上游引物为5′-TAGTGTGGCGGAAGTGTGATG TTGC-3′;下游引物为5′-TACCGTAGCTGAGCTTC TAG-3′。选取能扩增出5.2 kb左右片段的的单个菌落于LB培养基中振荡生长至A600值为0.8,离心收集菌体,NucleoBond Xtra Midi(Macherey-Nagel公司)提取重组腺病毒质粒,质粒经XhoⅠ限制性内切酶酶切,琼脂糖电泳分析后进行测序(Invitrogen公司)。
1.5 人KNDC1腺病毒颗粒的产生
取10 μg pAdeno Ⅹ-KNDC1质粒经PacⅠ酶切,异丙醇沉淀、纯化回收后,将0.8 μg线性化pAdeno Ⅹ-KNDC1质粒和2 μL lipofectamine2000混合与100 μL无血清无双抗MEM培养基(HyClone公司)混合,转染HEK293A细胞。每天于倒置显微镜(Olympus CKX31)下观察细胞状态,待细胞出现病变效应后,收集细胞,反复冻融3次裂解细胞,简单离心沉淀细胞碎片,取细胞裂解液上清感染正常HEK293A细胞获取高滴度病毒。
1.6 终点稀释法检测病毒滴度
实验前24 h,将HEK293细胞接种于96孔板中,保证每孔实验时的细胞数约为5×103个;准备10个无菌的离心管,在第一个离心管中加入990 μL的完全培养液,其余的9个管子中各加入900 μL的完全培养液。待测病毒液的稀释:取10 μL腺病毒原液加入990 μL 的离心管中,做1∶100稀释(10-2);然后以此为起点,再取100 μL稀释液加入到900 μL 的离心管中做1∶10稀释(10-3),直至稀释到10-13。从细胞培养箱中取出96孔板,在显微镜下确定每孔的细胞均生长良好。吸弃旧培养液,然后依次将10-13至10-6稀释的病毒液加入96孔板中,每1稀释度占用1行,每1行的第1~10每孔加入90 μL病毒稀释液,而每1行的第11~12每孔均加入90 μL不含病毒的完全培养基作为对照。将96孔板置于置37 ℃、5% CO2细胞培养箱中继续培养,10 d后观察细胞病变,并计算病毒滴度(Spearman-Karber method),公式如下:病毒滴度=10(x+0.8) (PFU),x=10-1到10-13依次稀释度下细胞病变效应(CPE)阳性率总和[4]。
项目片区选择要充分考虑对生态环境的影响,严禁在水资源开发接近限值的地区规划灌溉面积,水资源条件难以满足或取水对生态环境有明显影响的项目区要在论证阶段及时调整。水资源论证要重点分析项目实施对湿地、湖泊和河流等生态环境敏感的地区和生态环境脆弱区的影响,科学评价同一水文地质单元内长期取水后的累积影响和连续枯水年份地下水的保证程度和风险分析,按照水功能区纳污能力控制管理要求,合理分析项目退水可能引发的地表水体和地下水体污染以及面源污染威胁等,防止出现生态环境问题和生态灾难。
1.7 Western blot 分析
将HUVEC细胞接种于25 cm2细胞培养瓶,24 h后分别加入PBS、pAdeno Ⅹ-CMV,继续培养48 h后,收集各组细胞用BCA 试剂盒进行蛋白定量。蛋白变性后进行SDS-聚丙烯酰胺凝胶电泳,采用湿转法将凝胶上的蛋白转印到PVDF 膜上。2 h后将转印好的PVDF 膜置于含8%脱脂牛奶的TBST缓冲液中,室温封闭2 h后加入含抗KNDC1或抗β-actin的一抗孵育液(1∶1 000),4 ℃振荡孵育过夜,TBST 洗3次,每次15 min,加入TBST 缓冲液稀释的辣根过氧化物酶标记的羊抗兔二抗(1∶5 000)室温振荡1 h,TBST 洗3次,每次15 min。Millipore发光试剂盒进行显色,将PVDF膜在Alpha凝胶成像仪上照相并分析各条带吸光度变化。
1.8 细胞衰老检测
将HUVEC细胞接种于25 mL细胞培养瓶,24 h后分别加入PBS、30、60或90 MOI(multiplicity of infection)pAdeno Ⅹ-KNDC1处理48 h,然后按照衰老β-半乳糖苷酶染色试剂盒说明书进行衰老检测[5]。
2 结果
2.1 pAdeno Ⅹ-KNDC1的克隆
测序验证确认pAdeno Ⅹ-CMV的重组克隆位点已准确连接了目的基因KNDC1的开放阅读框(图2)。
2.2 人KNDC1腺病毒颗粒的产生和感染效率
PAdeno Ⅹ-KNDC1重组质粒转染HEK293A细胞后第10天可观察到特征性细胞病变效应(CPE),即细胞变圆,折光性增强,并开始出现明显噬斑甚至细胞脱落,收集的细胞裂解液(初代腺病毒)感染HEK293A细胞48 h后,感染组细胞60%以上变圆飘起呈串珠状,荧光显微镜下观察转染效率可达60%以上(图3)。
由于稀释度为10-10的孔中CPE均为阳性,所以认为稀释度为10-1至10-9的孔中CPE也都为阳性,则根据x=10-1到10-13依次稀释度下CPE阳性率总和X=1×10+0.3=10.3。根据滴度计算公式,本样品的滴度=10(x+0.8)=10(10.3+0.8)=1011=1×1011PFU(图4)。
图2 KNDC1基因测序图谱Fig 2 KNDC1 gene sequencing map

A.light microscopy picture of control group; B.fluorescent microscopy picture of control group; C.light microscopy picture of pAdeno Ⅹ-KNDC1 treated group; D.fluorescent microscopy picture of pAdeno Ⅹ-KNDC1 treated group
图3 初代腺病毒感染HEK293A细胞48 h
Fig 3 Primary pAdeno Ⅹ-KNDC1 was amplified in HEK293A (48 hours after HEK293A was infected)(×100)

A.light microscopy picture of 10-12dilution degrees; B.fluorescent microscopy picture of 10-12dilution degrees; C.light microscopy picture of 10-11dilution degrees; D.fluorescent microscopy picture of 10-11dilution degrees; E.light microscopy picture of 10-10dilution degrees; F.fluorescent microscopy picture of 10-10dilution degrees
图4 KNDC1腺病毒载体滴度测定
Fig 4 The titer of pAdeno Ⅹ-KNDC1(×100)
2.4 KNDC1蛋白在脐静脉内皮细胞中的表达
Western blot检测到相对分子质量56 ku特征条带,其大小与KNDC1蛋白基本吻合,且其含量较PBS 和pAdeno Ⅹ-CMV 处理的HUVEC细胞明显增高(图5)。
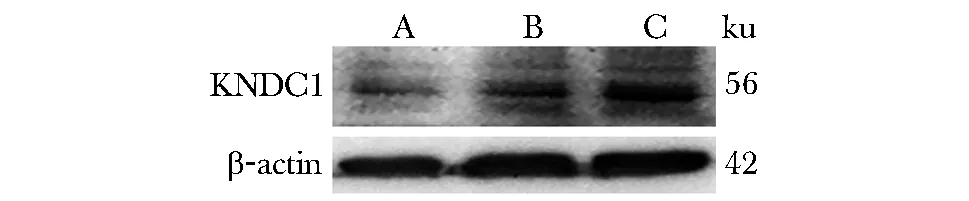
A.the expression of KNDC1 in HUVEC of control group; B.the expression of KNDC1 in HUVEC of pAdeno Ⅹ-CMV treated group; C.the expression of KNDC1 in HUVEC of pAdeno Ⅹ-KNDC1 treated group图5 KNDC1在HUVEC细胞中的表达Fig 5 The expression of KNDC1 in HUVEC
2.5 Ad-KNDC1诱导内皮细胞衰老
随着pAdeno Ⅹ-KNDC1浓度的增加,衰老细胞数量显著增多。对照组、30、60和90 MOI pAdeno Ⅹ-KNDC1处理衰老细胞百分比分别为0%、10%、30%和60%。

A.control group; B.30 MOI treated group; C.60 MOI treated group; D.90 MOI treated group图6 pAdeno Ⅹ-KNDC1诱导HUVEC细胞衰老Fig 6 Cell senescence of HUVEC was induced bypAdeno Ⅹ-KNDC1(×100)
3 讨论
过氧化氢(H2O2)、氧化型LDL或TNF-α等促动脉粥样硬化和促炎性反应因子能够通过Akt依赖的机制诱发端粒失活,从而诱导内皮细胞早衰[6- 7]。血管内皮细胞衰老是动脉粥样硬化和其他年龄相关心血管疾病的基础。KNDC1是2006年发现的基因,其功能与Ras鸟苷酸交换因子活性和蛋白丝/苏氨酸激酶活性相关。前期研究发现KNDC1 siRNA处理内皮细胞后,细胞增殖能力增强[3]。本研究利用腺病毒载体构建重组人KNDC1腺病毒颗粒,使其可以在原代细胞中高表达KNDC1蛋白,为进一步阐明其作用机制奠定了基础。
腺病毒载体的构建方法大致可分为体外连接法、同源重组法及位置特异性重组,其中在原核细胞中进行同源重组的方法应用比较广泛[8]。本研究选用的腺病毒载体为人腺病毒Ⅹ型。首先将KNDC1基因片段插入到pAdeno Ⅹ-CMV载体中,通过同源重组的方法,获得了pAdeno Ⅹ-KNDC1重组腺病毒质粒。测序结果显示目的基因片段KNDC1成功克隆至载体的多克隆位点。脂质体法转染HEK293细胞,获得大量具有稳定感染性的重组腺病毒pAdeno Ⅹ-KNDC1。终点稀释法检测病毒滴度表明pAdeno Ⅹ-KNDC1重组腺病毒质粒滴度能够达到1×1011PFU。为了证明pAdeno Ⅹ-KNDC1能够感染内皮细胞,采用了Western blot进行检测,结果表明包装出的病毒颗粒感染HUVEC后,其KNDC1蛋白的表达量显著升高。通过SA-β-gal染色证实,pAdeno Ⅹ-KNDC1能够诱导脐静脉血管内皮细胞衰老,且表现出明显量效关系。
综上所述,本研究采用了新型的腺病毒构建系统pAdeno-Ⅹ成功构建出重组人KNDC1腺病毒表达载体。构建的人KNDC1腺病毒表达载体可用于原代细胞,为研究KNDC1在细胞衰老方面的作用提供了可靠的技术支持。
[1] 王燕,孙晓东,王珺,等. Bmi- 1基因表达与血管内皮细胞衰老的相关性 [J]. 湖北医药学院学报, 2014,33:318- 320.
[2] Huang J, Furuya A, Hayashi K,etal. Interaction between very-KIND Ras guanine exchange factor and microtubule-associated protein 2, and its role in dendrite growth—structure and function of the second kinase noncatalytic C-lobe domain [J]. FEBS J, 2011,278:1651- 1661.
[3] Zhang C, Zhen YZ, Lin YJ,etal. KNDC1 knockdown protects human umbilical vein endothelial cells from senescence [J]. Mol Med Rep, 2014,10:82- 88.
[4] Darling AJ, Boose JA, Spaltro J. Virus assay methods: accuracy and validation [J]. Biologicals, 1998,26:105- 110.
[5] Lin YJ, Zhen YZ, Wei J,etal. Effects of Rhein lysinate on H2O2-induced cellular senescence of human umbilical vascular endothelial cells [J]. Acta Pharmacol Sin, 2011,32:1246- 1252.
[6] Zhan H, Suzuki T, Aizawa K,etal. Ataxia telangiectasia mutated (ATM)-mediated DNA damage response in oxidative stress-induced vascular endothelial cell senescence [J]. J Biol Chem, 2010,285:29662- 29670.
[7] Sun C, Liu X, Qi L,etal. Modulation of vascular endothelial cell senescence by integrin β4 [J]. J Cell Physiol, 2010,225:673- 681.
[8] 何金生,王健伟,洪涛. 腺病毒载体构建原理与方法的研究进展 [J]. 中华实验和临床病毒学杂志, 2001,15:398- 400.
Construction of human recombinant KNDC1adenovirus and its effect of promoting HUVEC senescence
LI Kai-ji1, HAO Xiao-fang1, ZHANG Guang-ling1, WEI Jing-bo1, WEI Jie2, LIN Ya-jun2, ZHEN Yong-zhan1*
(1.Hebei Key Laboratory for Chronic Diseases, Tangshan Key Laboratory for Preclinical and Basic Research on Chronic Diseases,School of Basic Medical Sciences, North China University of Science and Technology, Tangshan 063000;2.Beijing Hospital & Beijing Institute of Geriatrics,Ministry of Health,Beijing 100730,China)
Objective To construct the human recombinant KNDC1 adenovirus and to investigate the expression and function of KNDC1 protein in human umbilical vein endothelial cells (HUVECs). Methods Human KNDC1 gene was firstly amplified by PCR and directly cloned into the linearized adenoviral vectorinvitro, followed by screening and gene sequencing. Finally, the linearized recombinant plasmid was transfected into HEK293A cells for packaging. PAdeno Ⅹ-KNDC1 was purified by pAdeno Ⅹ kits and the endpoint dilution method was used for titering recombinant pAdeno Ⅹ-KNDC1. For observing the expression level of KNDC1 proteins, pAdeno Ⅹ-KNDC1 was used to infect HUVECs and then examined by Western blot. The function of pAdeno Ⅹ-KNDC1 was detected by senescence β-galactosidase staining kit. Results Gene sequencing indicated that pAdeno Ⅹ-KNDC1 contained KNDC1 gene. HEK293A cells turned round and partially floated in the tenth day after transfection. The titer was 1×1011PFU. Meantime, significant upregulation of KNDC1 protein expression in HUVECs at 48h after infection was observed. The number of senescence cells was increased with the increase of pAdeno Ⅹ-KNDC1 infection. Conclusions PAdeno Ⅹ-KNDC1 is successfully constructed and can promote the senescence of HUVECs.
KNDC1; adenoviruses; homologous recombination; human umbilical vein endothelial cells
2015- 02- 11
2015- 05- 26
国家自然科学基金(81001439);河北省自然科学基金(H2012401030);河北联合大学大学生创新性实验计划(X2014078)
1001-6325(2015)11-1447-06
Q782
A
*通信作者(corresponding author):yongzhanzhen @126.com
