抗疟药在狼疮性肾炎治疗中的应用
2015-05-10王少凡综述胡伟新审校
王少凡 综述 胡伟新 审校
抗疟疾药物用于治疗风湿病已有100多年历史,随着作用机制和疗效逐渐被认识,目前已越来越广泛地应用于风湿病,尤其是系统性红斑狼疮(SLE)的治疗。最常用的抗疟药是氯喹(CQ)和羟氯喹(HCQ)。HCQ起效较CQ缓慢,但副作用明显低于CQ,耐受性和安全性较好,因此临床中大多选用HCQ。研究表明抗疟药通过免疫调节、抗凝、避光、改善代谢等机制发挥多种治疗作用,包括降低狼疮活动性、保护脏器、提高生存率和减少血栓、感染等并发症[1],且适用于妊娠患者。虽然KDIGO已推荐HCQ作为狼疮性肾炎(LN)治疗的基础用药,但肾脏科医师使用率仍明显低于风湿科,相关的临床研究也较少。本文对抗疟药在SLE和LN治疗中的应用做一概述。
抗疟药的作用机制
免疫调节
对自身抗原表达的抑制 抗疟药脂溶性强,易穿过细胞膜进入包括溶酶体在内的胞内酸性囊泡,通过提高溶酶体囊泡的pH值(1~2个指数)来改变其功能,由此减少抗原肽和Ⅱ类主要组织相容性复合体(MHC)的结合,而抗原肽-MHC复合物为刺激CD4+细胞所必需,因此可使针对自身抗原肽的免疫反应性降低。由于高亲和力抗原(如细菌)不受此影响,所以抗疟药不会实质性抑制针对外来抗原的免疫应答[2]。
对Toll样受体信号的阻断作用 Toll样受体(TLR)是通过激活固有免疫系统来诱发炎症反应的细胞受体。其活化使树突细胞生产大量的干扰素α(IFN-α),并刺激B细胞产生更多的免疫球蛋白和细胞因子。研究显示抗疟药对溶酶体的碱化可干扰TLR内涵体对抗原提呈细胞的信号,以抑制TLR的活化,从而减少炎症反应[3]。
减少细胞因子和前列腺素 抗疟药通过影响巨噬细胞和单核细胞来抑制肿瘤坏死因子(TNF)、白细胞介素 6(IL-6)、IFN-γ、IL-1β 和 IL-18 的产生[4]。同时作为前列腺素的拮抗剂可抑制磷脂酶A2,减少花生四烯酸(多种炎症介质的前体)生成,由此减少炎症反应。
抗增殖作用 抗疟药通过激活半胱天冬酶来促进细胞凋亡,也可能使细胞对Fas介导的凋亡致敏,从而使滑膜细胞凋亡,并抑制内皮细胞增殖和淋巴细胞的功能[5]。
降低金属蛋白酶活性 金属蛋白酶参与了炎症和免疫应答过程。抗疟药减少了血浆中金属蛋白酶基质并提高了其抑制因子的水平[6]。
干扰DNA功能 抗疟药可阻断脱氧核糖核酸酶的解聚作用,并通过抑制DNA和RNA多聚酶反应来抑制DNA复制和RNA转录,从而干扰蛋白质合成,阻断DNA与抗DNA抗体反应。
减少白细胞活化 使用抗疟药治疗后血白细胞活化的标记物减少,B细胞活化因子血浆平均水平降低[7]。同时抗疟药还可抑制中性粒细胞释放超氧化物。
光防护 抗疟药可降低被紫外线照射的皮肤中IL-1β、IL-6 和 TNF 的 mRNA 水平,从而可能抑制UVB辐射产生的致炎细胞因子[8]。
抗凝作用 抗体介导的膜联蛋白A5(AnxA5)抗凝保护物的破坏参与了血栓形成,而抗疟药通过显著减少IgG连接而减少抗磷脂抗体与合包体滋养层的结合,也可直接减少抗磷脂抗体β2糖蛋白I复合物与磷脂双分子层的结合,并修复AnxA5的表达[11],同时还能抑制血小板聚集和黏附,从而预防血栓形成。
调节内分泌代谢 抗疟药可以抑制内源性胆固醇酯的水解,显著降低三酰甘油、低密度脂蛋白和极低密度脂蛋白,并提高高密度脂蛋白水平[9]。另外可以增加胰岛素和受体的结合,从而提高糖耐量,减轻胰岛素抵抗[10]。HCQ还可以减少25羟维生素D3羟化,由此减轻高钙血症。
在SLE治疗中的作用
控制病情活动、提高生存率及器官保护 1975年,首次有研究显示服用HCQ者皮肤症状改善、激素用量减少、复发率降低[12]。后来的多项研究陆续证实了抗疟药对SLE病情控制、器官保护及减少并发症方面的作用(表1)。1991年,加拿大一项前瞻性随机对照研究显示相较于持续服药者,停止HCQ治疗的病人因病情恶化而必须退出研究的几率增加(4%vs 23%,P=0.06),复发率也明显升高(36%vs 73%,P=0.02)[13]。而美国的 Hopkins队列研究和LUMINA (Lupusin Minorities:Nature Versus Nurture)对照研究观察了墨西哥和中美洲人、非裔美国人和欧洲白种人,结果表明HCQ可以减少已有脏器损害,并延长出现新发损害的时间,即对终末脏器提供长期保护,同时可以显著提高人生存率[14,17]。研究者将此归功于其心脏保护、减少复发,以及减轻慢性损伤和减少新生物形成的作用。另一项包括了9个拉美国家1 480例患者的GLADEL(Grupo latino Americano de Estudio del lupus Eritematoso)研究证实使用HCQ或CQ6个月以上可使总体死亡率降低38%,且效果存在时间依存性,延长用药疗程可达到更高的人存活率[20]。
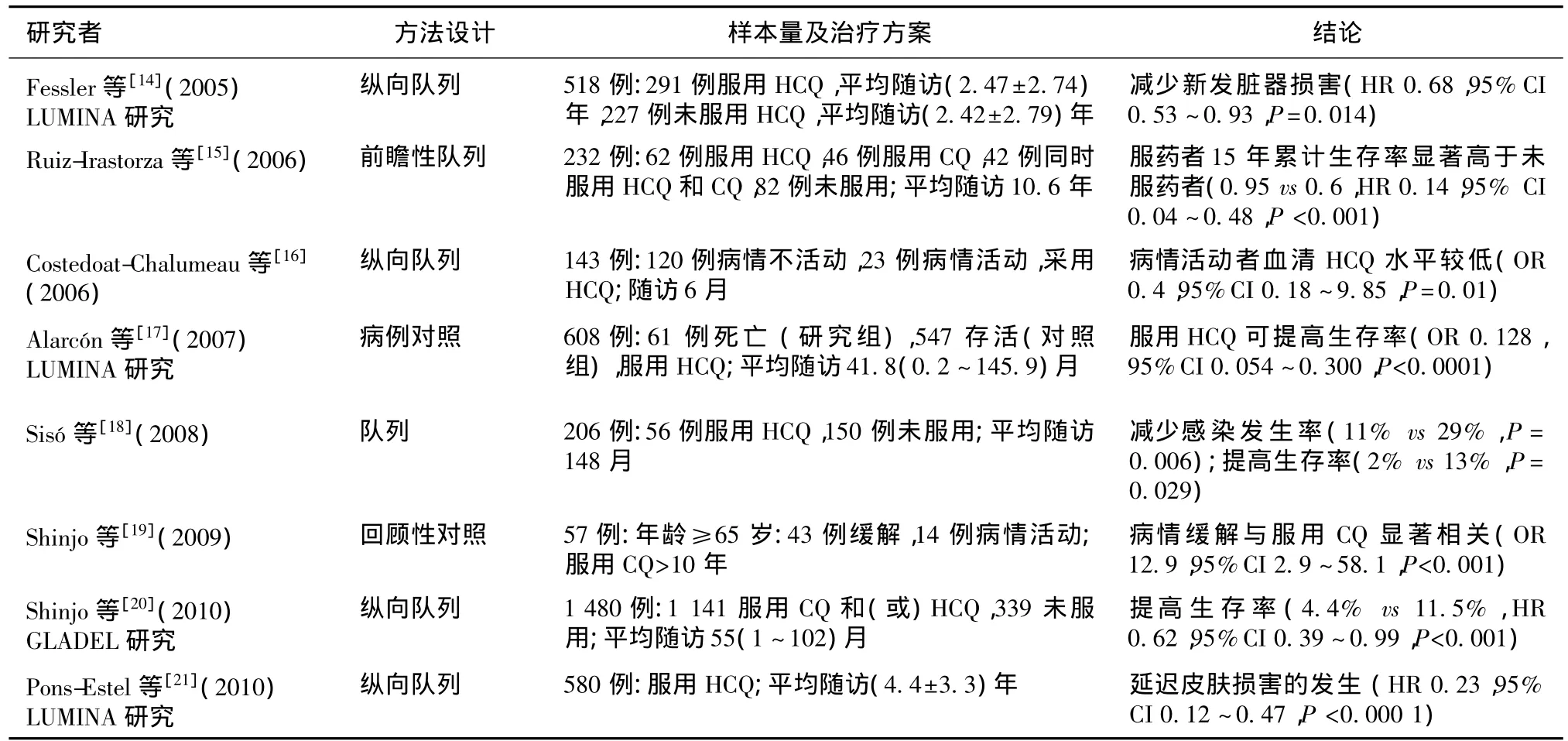
表1 抗疟药对SLE及LN患者的病情控制及器官的保护作用
抗血栓作用 SLE患者伴发抗磷脂综合征、血栓性微血管病及大血管血栓形成的情况并不少见,可能会造成严重的器官损害甚至生命危险,同时长期抗凝治疗带来的出血风险及监测凝血指标带来的依从性下降较为明显。多项研究证实抗疟药可预防血栓形成(表2),使用HCQ或CQ的患者发生血栓的风险明显低于不接受此治疗者[15,18],Jung 等[22]研究显示HCQ可使血栓的发生率减少68%。而且抗血栓作用在心磷脂抗体阳性或阴性的SLE患者中同样显著[23]。
在狼疮性肾炎治疗中的作用 抗疟药在LN的治疗中作用多样(表2)。加拿大HCQ研究组最早观察了抗疟药在LN中的应用效果,共随访3年,结果显示持续服用HCQ者比停药者肾脏复发率减少(4%vs 14%)[24]。由于此研究的样本量较少(47例),因此统计学意义较低,但其结果仍为HCQ减少肾脏复发提供了早期证据。
2005年LUMINA研究发现HCQ可减少SLE患者肾病进展的风险[14],在203例LN中79.3%接受了HCQ治疗,这部分病例比未使用HCQ者更少发生Ⅳ型LN,狼疮活动度较低,使用的激素剂量也较小[25]。考虑到适应征、用药人次和其他未知偏差,研究者使用纵向方法进行时间依从性分析,发现HCQ减少肾脏病变发生或减轻肾脏损害程度的作用依然显著。Hopkins狼疮协作组发表的研究报道显示29例接受霉酚酸酯联合HCQ治疗的Ⅴ型或Ⅴ型合并增殖性病变的LN患者治疗12个月时完全缓解显著提高(64%vs 22%)[26]。另西班牙一项囊括206例患者的队列研究表明LN患者服用HCQ后血清肌酐升高、高血压、感染、血栓的发生率和死亡率均下降,发展至终末期肾病的时间也延长了[18]。GLADEL研究者报道1 141例(77%)患者接受CQ或HCQ治疗超过6个月,这部分患者生存时间延长,肾脏损害发生率也较未服用抗疟药者显著减少(28.4%vs 42.8%)[20],这可能是因为抗疟药对血管内皮细胞有益,并可减轻肾脏炎症反应。
这些研究结果表明抗疟药可能减少SLE患者肾脏损害的发生并延缓其进展,与其他免疫抑制剂合用可提高肾脏缓解率、延长持续缓解的时间,并减少激素的累积用量。但因为研究对象局限于部分人种且相关研究大多为队列观察,尚缺少对其他人种的及大样本的随机对照研究,是目前研究存在的不足。
在SLE患者妊娠中的应用
妊娠可能导致狼疮复发或加重肾损害,增加了母亲和婴儿发生并发症的风险,同时停用免疫抑制剂(包括抗疟药)更增加了这一风险。因为HCQ易于穿过胎盘,孕妇和胎儿的血药浓度相差无几[3],有体外试验表明HCQ可在胎儿小鼠的黑色素组织中沉积,因此妊娠SLE患者是否应继续使用抗疟药存在一定争议。目前相关研究均是采用HCQ进行治疗和观察,结果显示HCQ没有致畸作用,孕妇在妊娠期服用推荐剂量[<4 mg/(kg·d)]HCQ的婴儿发生视网膜病和耳毒性的风险并没有增加[27],同时HCQ可降低妊娠患者SLE活动性和复发率,而停用HCQ者比妊娠期间持续服用者病情加重,需要更大剂量的激素维持。因此HCQ对妊娠期狼疮患者安全、有效,但要把握服药剂量,并对婴儿进行相关监测。
抗疟药的副作用
最常见的副作用是胃肠道反应,如恶心、呕吐、腹泻、厌食以及肝酶升高(少见),或神经系统症状(头疼、头晕)以及肌肉酸痛。其他副作用发生率较低,其中最重要的是视网膜病。
视网膜病 抗疟药与黑色素的结合性较强,其在黑色素储存细胞中的累积易改变溶酶体PH值,从而破坏视网膜色素上皮细胞的代谢,造成光感受器退化[28]。视网膜损害的早期症状是中央视野缺损和色觉缺失,该症状会随着病变扩展至中央凹和基底膜而加重。如果在最早期停用HCQ,此损害可能逆转,但是黄斑病变大多不可逆。美国眼科协会(AAO)2011年发表的指南建议在抗疟药治疗的第一年进行基础筛查,在累计治疗5年内不需年检,但5年后需开始每年检查。虽然视网膜病发生率较低(0.4% ~0.65%),但有些因素可能增加其风险,包括累积服用剂量较大(>1 000 g)、每日服用剂量较大[>400 mg/d或>6.5 mg/(kg·体重)]、高龄、肝/肾功能不全、已有视力受损或眼病。另外因为抗疟药不积存于脂肪组织,所以肥胖患者的服药剂量应按去脂体质量来计算[29]。
神经肌肉和心脏毒性 表现为双下肢进行性肌无力,可伴有多发神经病。急性心脏毒性包括心肌收缩力减弱、低血压和传导异常。慢性心脏毒性表现为心脏传导阻滞,双侧心室肥厚和(或)心肌病(通常是限制性)。大多见于服药剂量较大或肾功能不全的患者[30]。
皮肤的毒性反应 表现为皮肤、黏膜黄褐色或青灰色色素沉着,多于用药4个月后出现[31]。抗疟药可能使小部分患者(1~2%)银屑病加重,但尚未得到进一步证实。
医源性磷脂质病 有个案报道使用HCQ治疗的女性患者出现类似Fabry病的磷脂质病,但DNA基因分析未见相关半乳糖苷酶基因的异常,考虑可能与长期服用HCQ抑制了半乳糖苷酶循环活性有关[32]。
中枢神经系统症状 偶见引起精神失常、过度兴奋或癫痫发作,所以抗疟药不宜用于未控制的精神异常患者,也不宜与中枢兴奋剂或大量甲状腺素药物合用。对有癫痫病史的患者应从推荐剂量的25% ~50%开始用药,后缓慢增加剂量。
血液系统 CQ可使葡萄糖-6-磷酸脱氢酶(G6PD)缺乏者发生溶血,也可引起粒细胞缺乏和再生障碍性贫血[3],而 HCQ则较少引起此类副作用。
小结:抗疟药联合其他免疫抑制剂已经成为SLE的重要治疗方案。抗疟药的免疫调节和抗炎作用能极大地改善SLE患者的疗效和预后,包括提高缓解率和生存率,降低疾病活动性,减少新发损害和感染率,延缓肾脏慢性病变,同时还有抗凝和血管保护作用。对接受抗疟药治疗尤其是合并肝、肾功能不全的患者需密切监测副作用的发生,其中最重要的是视网膜病、心脏毒性和神经肌肉病变。抗疟药对SLE患者包括妊娠期妇女都是有效和安全的,其益处远大于风险,是风湿病及肾脏科医师不应忽视的治疗药物。
1 Ruiz-Irastorza G,Ramos-Casals M,Brito-Zeron P,et al.Clinical efficacy and side effects ofantimalarials in systemic lupus erythematosus:a systematic review.Ann Rheum Dis,2010,69(1):20-28.
2 Fox R.Anti-malarialdrugs:possiblemechanismsofaction in autoimmune disease and prospects for drug development.Lupus,1996,5(Suppl 1):S4-10.
3 Kalia S,Dutz JP.New concepts in antimalarial use and mode of action in dermatology.Dermatol Ther,2007,20(4):160-174.
4 Wozniacka A,Lesiak A,Narbutt J,et al.Chloroquine treatment influences proinflammatory cytokine levels in systemic lupus erythematosus patients.Lupus,2006,15(5):268-275.
5 Potvin F,Petitclerc E,Marceau F,et al.Mechanisms of action of antimalarials in inflammation:induction of apoptosis in human endothelial cells.J Immunol,1997,158(4):1872-1879.
6 Lesiak A,Narbutt J,Sysa-Jedrzejowska A,et al.Effect of chloroquine phosphate treatment on serum MMP-9 and TIMP-1 levels in patients with systemic lupus erythematosus.Lupus,2010,19(6):683-688.
7 Toubi E,Kessel A,Rosner I,et al.The reduction of serum B-lymphocyte activating factor levels following quinacrine add-on therapy in systemic lupus erythematosus.Scand J Immunol,2006,63(4):299-303.
8 Wozniacka A,Lesiak A,Boncela J,et al.The influence of antimalarial treatment on IL-1beta,IL-6 and TNF-alpha mRNA expression on UVB-irradiated skin in systemic lupus erythematosus.Br J Dermatol,2008,159(5):1124-1130.
9 Hodis HN,Quismorio FP Jr,Wickham E,et al.The lipid,lipoprotein,and apolipoprotein effects of hydroxychloroquine in patients with systemic lupus erythematosus.J Rheumatol,1993,20(4):661-665.
10 Bevan AP,Christensen JR,Tikerpae J,et al.Chloroquine augments the binding of insulin to its receptor.Biochem J,1995,311(Pt 3):787-795.
11 Wu XX,Guller S,Rand JH.Hydroxychloroquine reduces binding of antiphospholipid antibodies to syncytiotrophoblasts and restores annexin A5 expression.Am J Obstet Gynecol,2011,205(6):576.e7-e14.
12 RudnickiRD,Gresham GE,Rothfield NF.The efficacy of antimalarials in systemic lupus erythematosus.J Rheumatol,1975,2(3):323-330.
13 [No authors listed].A randomized study of the effect of withdrawing hydroxychloroquine sulfate in systemic lupus erythematosus.The Canadian Hydroxychloroquine Study Group.N Engl J Med,1991,324(3):150-154.
14 Fessler BJ,Alarcón GS,McGwin G Jr,et al.Systemic lupus erythematosus in three ethnic groups:XVI.Association of hydroxychloroquine use with reduced risk of damage accrual.Arthritis Rheum,2005,52(5):1473-1480.
15 Ruiz-Irastorza G,Egurbide MV,Pijoan JI,et al.Effect of antimalarials on thrombosis and survivalin patients with systemic lupus erythematosus.Lupus.2006;15(9):577-83.
16 Costedoat-Chalumeau N,Amoura Z,Hulot JS,et al.Low blood concentration of hydroxychloroquine is a marker for and predictor of disease exacerbations in patients with systemic lupus erythematosus.Arthritis Rheum,2006,54(10):3284-3290.
17 Alarcón GS, McGwin G, Bertoli AM, et al. Effect of hydroxychloroquine on the survival of patients with systemic lupus erythematosus:data from LUMINA,a multiethnic US cohort(LUMINA L).Ann Rheum Dis,2007,66(9):1168-1172.
18 Sisó A,Ramos-Casals M,Bové A,et al.Previous antimalarial therapy in patients diagnosed with lupus nephritis:influence on outcomes and survival.Lupus,2008,17(4):281-288.
19 Shinjo SK.Systemic lupus erythematosus in the elderly:antimalarials in disease remission.Rheumatol Int,2009,29(9):1087-1090.
20 Shinjo SK,Bonfá E,Wojdyla D,et al.Antimalarial treatment may have a time-dependent effect on lupus survival:data from a multinational Latin American inception cohort.Arthritis Rheum,2010,62(3):855-862.
21 Pons-Estel GJ,Alarcón GS,González LA,et al.Possible protective effect of hydroxychloroquine on delaying the occurrence of integument damage in lupus:LXXI,data from a multiethnic cohort.Arthritis Care Res(Hoboken),2010,62(3):393-400.
22 Jung H,Bobba R,Su J,et al.The protective effect of antimalarial drugs on thrombovascular events in systemic lupus erythematosus.Arthritis Rheum,2010,62(3):863-868.
23 Tektonidou MG,Laskari K,Panagiotakos DB,et al.Risk factors for thrombosis and primarythrombosis prevention in patientswith systemiclupuserythematosuswith orwithoutantiphospholipid antibodies.Arthritis Rheum,2009,61(1):29-36.
24 Tsakonas E,Joseph L,Esdaile JM,et al.A long-term study of hydroxychloroquine withdrawal on exacerbations in systemic lupus erythematosus.TheCanadian Hydroxychloroquine Study Group.Lupus,1998,7(2):80-85.
25 Pons-Estel GJ,Alarcón GS,McGwin G Jr,et al.Protective effect of hydroxychloroquine on renal damage in patients with lupus nephritis:LXV,data from a multiethnic US cohort.Arthritis Rheum,2009,61(6):830-839.
26 Kasitanon N,Fine DM,Haas M,et al.Hydroxychloroquine use predicts complete renal remission within 12 months among patients treated with mycophenolate mofetil therapy for membranous lupus nephritis.Lupus,2006,15(6):366-370.
27 Parke A,West B.Hydroxychloroquine in pregnant patients with systemic lupuserythematosus.JRheumatol,1996,23(10):1715-1718.
28 Sundelin SP,Terman A.Differenteffectsofchloroquine and hydroxychloroquine on lysosomal function in cultured retinal pigment epithelial cells.APMIS,2002,110(6):481-489.
29 Mavrikakis I,Sfikakis PP,Mavrikakis E,et al.The incidence of irreversible retinal toxicity in patients treated with hydroxychloroquine:a reappraisal.Ophthalmology,2003,110(7):1321-1326.
30 Nord JE,Shah PK,RinaldiRZ,etal.Hydroxychloroquine cardiotoxicity in systemic lupus erythematosus:a report of 2 cases and review of the literature.Semin Arthritis Rheum,2004,33(5):336-351.
31 Puri PK,Lountzis NI,Tyler W,et al.Hydroxychloroquine-induced hyperpigmentation:the staining pattern.J Cutan Pathol,2008,35(12):1134-1137.
32 Bracamonte ER, Kowalewska J, Starr J, et al.Iatrogenic phospholipidosis mimicking Fabry disease.Am J Kidney Dis,2006,48(5):844-850.
