肾静脉高压与急性肾损伤
2015-05-10许书添综述李世军校审
许书添 综述 李世军 校审
早期观点认为心输出量下降是导致心肾综合征肾功能恶化的主要原因。然而,近期研究发现,静脉淤血与肾功能恶化程度相关[1]。20世纪30年代,犬模型研究证明急性肾静脉梗阻出现肾功能异常、肾血流减少及钠潴留。20世纪60年代研究发现,慢性充血性心力衰竭时存在肾静脉高压。20世纪80年代,首次提出了肾静脉高压是水钠潴留直接原因的假说。近期研究发现肾静脉高压导致急性肾损伤(AKI),可能与肾素-血管紧张素-醛固酮系统(RAAS)、交感神经系统(SNS)、细胞因子通路、压力感受器及神经活性等密切相关[2-4]。本文主要简述肾静脉高压导致AKI的机制(图1)及干预方法。
肾静脉高压的病理生理改变
压力效应 肾静脉压升高,导致肾动静脉压力差缩小,肾脏血流下降,肾小球滤过压下降,最终肾小球滤过率(GFR)急剧下降;由于肾脏血流的强大代偿机制,肾脏血流不随动脉灌注压力的变化而改变。然而,肾静脉压力升高,肾实质充血,受肾包膜限制,肾间质压力增加,最终导致肾小球毛细血管床和肾小管缺血缺氧。对肾小管的压迫使肾小管管腔压力增加,肾小球滤过压下降,最终使GFR下降。20世纪50年代,动物研究发现一旦肾静脉压力>15 mmHg则GFR下降。基于犬模型研究表明肾静脉压力在10~20 mmHg,肾间质压力将增加6 mmHg以上[5]。肾静脉充血导致肾间质压力增加,与动脉压增加产生利尿效应的病理生理机制不同。
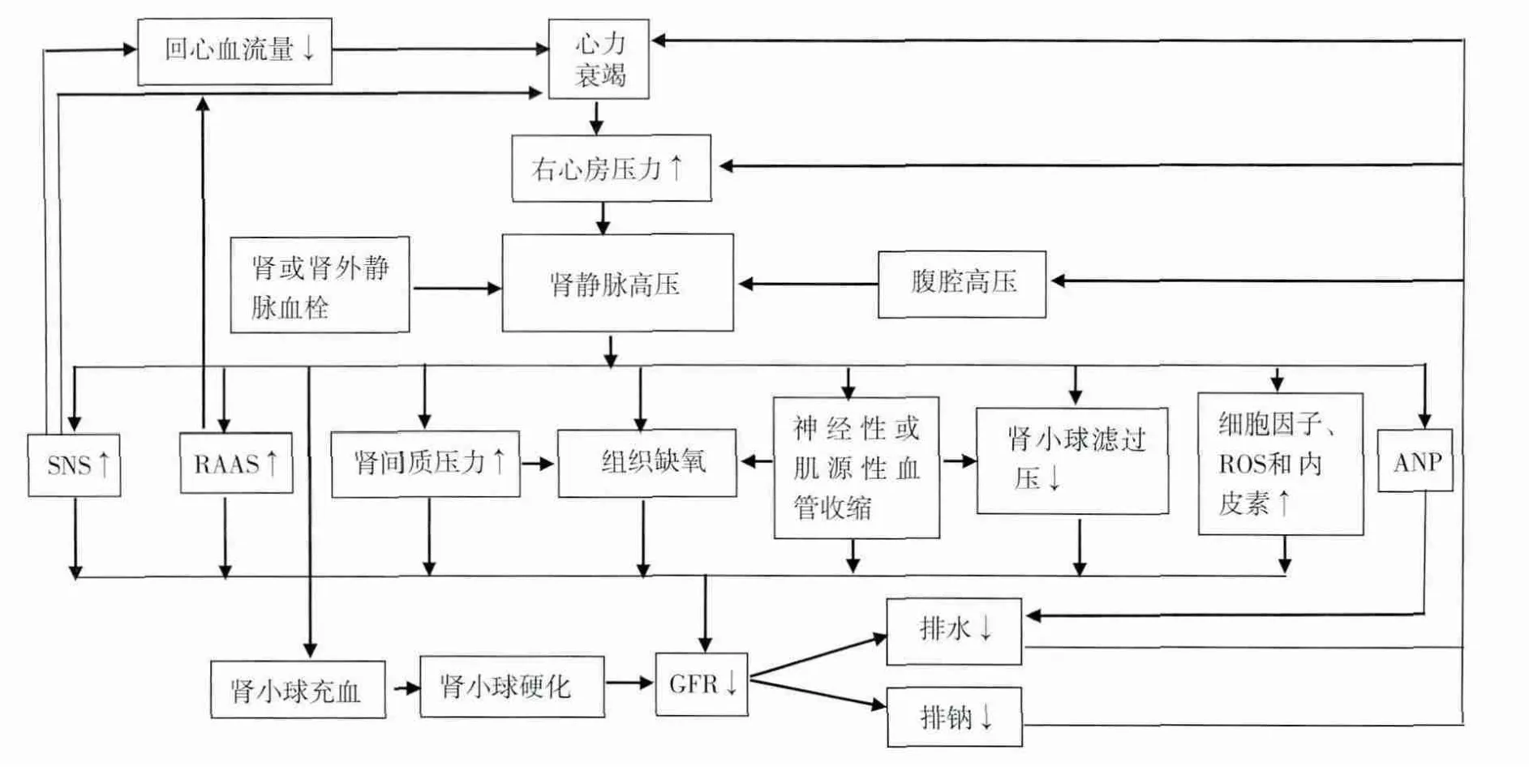
图1 肾静脉高压导致AKI的病理生理机制
神经性、肌源性机制 肾静脉压力升高受GFR、管球反馈(TGF)、RAAS及血管固有神经反射途径调节。肾静脉淤血会产生血管肌源性反应,即通过神经反射途径调节动脉微循环[6]。采用肾静脉部分梗阻导致血管收缩来研究神经或局部滴定α受体阻滞剂的效应,轻度肾静脉充血会导致肾间质压力升高,但由于固有肌源性血管扩张抵消其压力升高效应,最终使得肾脏灌注压维持稳定。但随着肾静脉压力进一步升高,通过肾内(肾实质受体)和肾外(肾包膜上的机械感受器经由脊髓神经传导)神经反射途径促发交感神经引起血管收缩,最终导致肾静脉充血。手术或药物阻断交感神经可起到部分抑制静脉充血的效应。此外,腹腔内静脉梗阻或肝硬化动物模型发现,激活肝内、肠道和脾脏的传入神经与交感神经兴奋性增加、肾素释放量增加和肾血流量下降有关[7]。尽管是否存在内脏-肾脏神经反射通路仍有争议,但能肯定的是,手术或药物达到去神经化可减少肾静脉充血[7]。
压力感受器 肾静脉压力升高源于多种因素激活机械性压力感受器。如心力衰竭伴随高中心静脉压,肝硬化伴门静脉高压、肝肾和脾肾静脉充血,肠系膜静脉血栓性疾病,腹腔高压,静脉因血栓、肿瘤、外伤出现梗阻等。心房利钠肽水平升高不仅仅是静脉充血的标志物,也是心力衰竭患者利尿利钠效果不佳的表现。肾静脉充血而肾间质压力升高使得GFR下降,主要是源于心房利钠肽失去调节TGF的作用[8]。血管压力感受器神经网络相当广泛而复杂,目前尚无证据证明可通过冷冻、射波或手术去除神经压力感受器来治疗心力衰竭。
SNS和RAAS机制 早期研究发现肾静脉梗阻心衰患者存在水钠潴留。20世纪40年代发现单侧肾静脉狭窄的犬模型会迅速出现水钠潴留,且与自身血压、肾血流量或GFR无关。20世纪60年代以后也有研究发现肾静脉狭窄后伴GFR下降会影响钠排泄。尽管肾静脉压轻度升高会导致血浆肾素和醛固酮水平迅速升高,但是仍难以除外全身血流动力学变化对此影响。随后在肾静脉狭窄的猪模型观察到,尽管心脏指数或全身血压无明显变化,但肾脏静脉血流量减少和GFR下降,伴肾素活性和醛固酮水平升高[9]。当肾静脉压力高达30 mmHg,2h后会出现上述激素水平急剧可逆性变化。此现象与腹腔间隔综合征导致肾功能不全,解压后肾功能有所改善相类似。腹部血管解剖结构异常复杂,如交感神经兴奋会影响肾脏血液灌注和肾素的释放,最终导致门静脉高压而非下腔静脉收缩。
肾实质或循环中肾素水平升高,同时血管紧张素Ⅱ的一致升高,提示可能与交感神经活性升高有关。目前对肾脏缺血时GFR下降是否会导致交感神经兴奋仍不得而知[10]。
静脉血容量机制 Fallick等[11]认为急性充血性心力衰竭是由于静脉血管张力增加所致,血容量下降、静脉回流量和有效血容量增加,最终心脏功能失代偿。全身内脏静脉血容量短期调节主要受交感神经活性影响,且以α肾上腺素能受体为主。因此,心力衰竭患者病情好坏与血管内血容量重新分布密切相关,而非全身水盐总量的变化。按此理论可设计肾静脉高压与肾充血并存的实验模型。如果实验证实此理论成立,这将有利于指导药物治疗,如通过使用α肾上腺素能受体阻滞剂和(或)含有α受体的β受体阻滞剂,甚至可通过射频消融或其他手段来抑制交感神经的活性。
内皮细胞活化 充血性心力衰竭患者血管内皮从静止状态激活导致促炎反应、促强氧化和促血管收缩反应[12]。在充血性心力衰竭时,心肾功能恶化,形成恶性循环。静脉充血是内皮细胞激活的生物化学信号,可激活活性氧簇、内皮素、白细胞介素6、肿瘤坏死因子-α和一氧化氮发生氧化还原反应。在犬模型,上述指标升高预示急性液体超负荷及静脉充血[13]。此外,人前臂血管急性充血也观察到内皮细胞的促炎反应性改变[12]。
慢性肾脏病(CKD) 如果肾静脉压力持续升高,急性肾损伤逐渐演变至 CKD(即 AKI转为CKD)。在右心负荷过重导致肾静脉高压的犬模型中,存在肾小球过度充血和肾小球硬化,可能与肾动脉张力增加、血管平滑肌过度肥大有关。
影响肾脏静脉压力的因素
心力衰竭 心源性因素导致肾功能恶化的主要原因是肾脏静脉压力升高。急性心力衰竭患者肾功能恶化与右房压力相关,而与肺动脉压、心脏指数、全身血管阻力等无关[14]。肾静脉压力升高引起肾脏损伤的病理生理机制很多,如中心静脉压升高会阻碍肾静脉回流,降低肾脏灌注压(平均动脉压-中心静脉压=肾脏灌注压),当肾脏灌注压<80 mmHg,超过肾血流自动调节的压力阈值,将引起肾小球滤过压降低,导致GFR下降;肾静脉高压会直接引起肾间质水肿和缺血缺氧,导致肾间质压力及肾小管内压力增高,进一步降低 GFR[15-16]。
心脏和肾脏关系密切,急性透析质量指导组织(ADQI)将心肾综合征分为5个亚型。其中Ⅰ型和Ⅱ型为急性和慢性心肾综合征,均为心脏病变在先,肾脏受累在后,心功能失代偿导致肾静脉压力增加是其重要原因。另外,肌源性反应和压力感受器的激活、SNS和RAAS的激活及促炎反应的增强也与肾静脉压力升高有关。
容量超负荷 重症患者的容量调节能力下降,易出现容量不足或负荷过重。当机体处于低血容量状态时,液体复苏可有效地改善心输出量,提高平均动脉压,从而改善肾脏灌注、避免肾脏损伤。容量过负荷可加重AKI,甚至影响预后[17]。容量过负荷会引起组织水肿,水肿阻碍氧和代谢产物的弥散,破坏组织结构,妨碍毛细血管和淋巴回流,从而可能引起器官功能障碍。
右心房压力增高可能通过增加肾静脉压力,导致肾间质水肿及压力增高,从而降低肾脏灌注。此外,由于肾脏是一个有包膜的器官,器官水肿会产生更高的反向压力形成“囊内填塞”,进一步降低肾脏血流和肾脏灌注,尿量减少,引起更多的液体潴留甚至水肿。这一恶性循环极易导致利尿剂耐受。液体潴留会引起心肌扩张、心排量下降和全身血压下降,肾功能进一步恶化。
腹腔高压 20世纪早期,人们就注意到腹腔高压常常伴随尿量减少。近来发现,轻度腹腔高压患者,也会出现肾功能下降。腹腔内压力>18 mmHg是重症监护患者发生AKI的独立危险因素,且AKI的严重程度与腹腔压力升高呈正相关。腹腔压力为20 mmHg时,肾血流从621 ml/min降至488 ml/min,GFR从117 ml/(min·1.73m2)降至88 ml/(min·1.73m2)。
当腹腔内压增高时,肾静脉受压,肾静脉阻力增加,静脉压力随之升高。此时肾脏灌注压下降,进一步引起肾皮质、肾小球血流减少,GFR下降。此外,在一些恶性肿瘤引起的腹腔高压中,肿瘤侵犯输尿管造成尿路梗阻成为AKI的肾后性因素。
其他 肝硬化时,门静脉压力传至肾静脉,导致肾静脉压力增高;慢性阻塞性肺疾病急性加重时,内源性呼吸末正压(PEEP)的升高也会引起腹腔及肾静脉压力增高;另外急性呼吸窘迫综合征机械通气治疗时采用较高的PEEP也可导致肾静脉压力增高。综上所述,肾静脉高压引起肾脏间质水肿和肾脏灌注压下降可导致GFR下降,引发AKI。
肾静脉高压处理
解除病因 病因处理十分重要,对于心力衰竭患者,应该予限盐、限水、强心、利尿、扩血管等干预措施;如果是容量负荷过重,应该在血流动力学指导下,采用利尿剂或肾脏替代治疗维持液体负平衡;对于腹腔高压综合征,应积极采取措施降低腹腔内高压,并适当限制液体入量。
利尿剂 利尿剂虽然在临床上经常使用,但大量使用袢利尿剂是否造成AKI尚存争议。大剂量使用袢利尿剂与肾功能恶化的不良后果相关。但这些观点也存在争议,因为接受大剂量利尿剂的患者往往病情较重或并发症较多。心力衰竭患者接受大剂量利尿剂治疗可迅速缓解淤血症状,虽然可能引起一过性血清肌酐增高,但与持续淤血引起肾功能恶化相比,可能对机体更为有益[18]。对于重症患者应设定每天的液体平衡目标,并监测每小时液体出入量,及时调整利尿剂的剂量[19]。
超滤与肾脏替代治疗 肾脏替代治疗是缓解肾静脉高压的重要方法,通过超滤去除过多液体,使中心静脉压降至8 mmHg,可降低肾脏充血,减少心肾综合征的发生。有研究表明,与常规利尿剂治疗相比,采用超滤技术不仅使心力衰竭患者快速改善症状,并且可减少呋塞米用量及其再住院率[20-21],但需注意超滤的脱水速率及脱水目标的个体化调整,否则反而可能引起肾功能恶化。连续性血液净化技术能保证治疗过程中血流动力学稳定,并可减少对透析依赖。
小结:肾静脉高压导致AKI涉及多种病理生理机制,如压力感受器、神经体液因素、全身和局部激素因素,临床上多见于充血性心力衰竭、肝硬化门脉高压或者下腔静脉血栓及腹腔高压患者等。肾脏充血是全身内脏静脉血容量重新分布的结果,无论是采用药物还是超滤,均可改善心输出量和肾脏灌注,因此有理由认为减轻肾静脉高压是AKI的治疗靶点。
1 F Gnanaraj J,von Haehling S,Anker SD,et al.The relevance of congestion in the cardio-renal syndrome.Kidney Int,2013,83(3):384-391.
2 Legrand M,Dupuis C,Simon C,et al.Association between systemic hemodynamics and septic acute kidney injury in critically ill patients:a retrospective observational study.Crit Care,2013,17(6):R278.
3 Druml W.Renal dysfunction in heart failure and hypervolumenia:Importance of congestion and backward failure.Med Klin Intensivmed Notfmed,2014,109(4):252-256.
4 Ross EA.Congestive renal failure:the pathophysiology and treatment of renal venous hypertension.J Card Fail,2012,18(12):930-938.
5 Fiksen-Olsen MJ,Strick DM,Hawley H,et al.Renal effects of angiotensin II inhibition during increases in renal venous pressure.Hypertension,1992,19(2 Suppl):II137-141.
6 Braam B,Cupples WA,Joles JA,et al.Systemic arterial and venous determinants of renal hemodynamics in congestive heart failure.Heart Fail Rev,2012,17(2):161-175.
7 Hamza SM,Kaufman S.Splenorenal reflex modulates renal blood flow in the rat.J Physiol,2004,558(Pt 1):277-282.
8 Morsing P,Stenberg A,Casellas D,et al.Renal interstitial pressure and tubuloglomerular feedback control in rats during infusion of atrial natriuretic peptide(ANP).Acta Physiol Scand,1992,146(3):393-398.
9 Doty JM,Saggi BH,Sugerman HJ,et al.Effect of increased renal venous pressure on renal function.J Trauma,1999,47(6):1000-1003.
10 Damman K,Navis G,Smilde TD,et al.Decreased cardiac output,venous congestion and the association with renal impairment in patients with cardiac dysfunction.Eur J Heart Fail,2007,9(9):872-878.
11 Fallick C,Sobotka PA,Dunlap ME.Sympathetically mediated changes in capacitance:redistribution of the venous reservoir as a cause of decompensation.Circ Heart Fail,2011,4(5):669-675.
12 Kos T,Pacher R,Wimmer A,et al.Relationship between kidney function,hemodynamic variables and circulating big endothelin levels in patients with severe refractory heart failure.Wien Klin Wochenschr,1998,110(3):89-95.
13 Colombo PC,Banchs JE,Celaj S,et al.Endothelial cell activation in patients with decompensated heart failure.Circulation,2005,111(1):58-62.
14 Nohria A,Hasselblad V,Stebbins A,et al.Cardiorenal interactions:insights from the ESCAPE trial.J Am Coll Cardiol,2008,51(13):1268-1274.
15 Damman K,van Deursen VM,Navis G,et al.Increased central venous pressure is associated with impaired renal function and mortality in a broad spectrum of patients with cardiovascular disease.J Am Coll Cardiol,2009,53(7):582-588.
16 Damman K,Voors AA,Hillege HL,et al.Congestion in chronic systolic heart failure is related to renal dysfunction and increased mortality.Eur J Heart Fail,2010,12(9):974-982.
17 Boyd JH,Forbes J,Nakada TA,et al.Fluid resuscitation in septic shock:a positive fluid balance and elevated central venous pressure are associated with increased mortality.Crit Care Med,2011,39(2):259-265.
18 Mentz RJ,Kjeldsen K,Rossi GP,et al.Decongestion in acute heart failure.Eur J Heart Fail,2014,16(5):471-482.
19 Miller JL,Thomas AN,Johnson PN.Use of continuous-infusion loop diuretics in critically ill children.Pharmacotherapy,2014,34(8):858-867.
20 Marenzi G,Lauri G,Grazi M,et al.Circulatory response to fluid overload removalby extracorporealultrafiltration in refractory congestive heart failure.J Am Coll Cardiol,2001,38(4):963-968.
21 Costanzo MR,Guglin ME,Saltzberg MT,et al.Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure.J Am Coll Cardiol,2007,49(6):675-683.
