硼替佐米联合糖皮质激素治疗难治性狼疮性肾炎的近期疗效观察
2015-05-10章海涛刘正钊侯金花黄湘华胡伟新刘志红
章海涛 刘正钊 侯金花 宋 捷 黄 力 黄湘华 胡伟新 刘志红
狼疮性肾炎(LN)是一种反复发作的自身免疫性疾病,患者是否获得治疗缓解对远期预后有重要影响[1-2]。传统的环磷酰胺(CTX)诱导治疗缓解率为30.4%~63%,多靶点疗法或吗替麦考酚酯(MMF)诱导缓解率可高达 83.5% ~ 52.1%[3-5],但是仍有一部分患者对上述治疗无效或不能耐受,且12.9%~25%的患者在维持治疗期间出现肾脏复发[6-7]。长期以来,这些对传统治疗无效或者复发的LN患者一直是临床治疗上的难点,虽然有报道采用B淋巴细胞单克隆抗体、免疫吸附/血浆置换或干细胞移植治疗[8-9],但是目前对难治性LN的治疗尚无统一标准,并且观察例数较少,也缺乏有效的对照研究。
硼替佐米是一种蛋白酶体抑制剂,具有多种免疫调节功能,不仅用于多发性骨髓瘤和淋巴瘤的治疗[10-11],还可抑制浆细胞功能,减少自身抗体产生,清除长寿命浆细胞,抑制炎症反应。动物试验证实硼替佐米能降低狼疮小鼠ds-DNA抗体,减少蛋白尿,改善肾脏病变[12-14]。近期国外已有硼替佐米治疗难治性LN的报道[15]。本文首次在中国人群中观察硼替佐米联合糖皮质激素治疗难治性LN的临床疗效及安全性。
对象和方法
病例资料 2011年10月至2014年12月,在南京军区南京总医院国家肾脏疾病临床医学研究中心住院的患者中进行筛选,入选患者符合1997年美国风湿病学会(ARA)修订的系统性红斑狼疮(SLE)分类标准;经肾活检确诊为LN,病理分型参考2003年ISN/RPS分型标准;SLE疾病活动指数(SLE-DAI)>10分;既往曾接受过至少一种免疫抑制剂治疗>6个月未获得缓解,或者出现肾脏复发伴病理转型或免疫学指标持续阳性者。
本项研究获得南京军区南京总医院伦理委员会同意,所有参加研究的患者均签署书面知情同意书。
治疗方案
硼替佐米用法用量 硼替佐米(西安杨森制药有限公司)1.3 mg/(m2·次),21d为1个治疗周期,治疗4个周期。每个周期的第1、4、8和11天单次静脉注射(3~5s内经静脉推注)硼替佐米。可根据不良反应调整剂量或暂时停药。
糖皮质激素用法用量 甲泼尼龙静脉冲击,0.5 g/d静脉滴注3d,后续口服泼尼松0.6 mg/(kg·d)(最大剂量60 mg/d),早晨顿服,4周后减量,每2周减量5 mg至20 mg/d,再每2周减2.5 mg至10 mg/d维持。
治疗期间可合并使用降压药、利尿剂、促红细胞生成素等,禁止使用其他免疫抑制剂,未采用预防性抗感染治疗。如果狼疮病情加重需要挽救治疗,则退出观察。
硼替佐米治疗结束后,研究者可根据病情加用其他免疫抑制剂治疗,如他克莫司(FK506)或MMF。
观察指标 观察硼替佐米治疗前,每个治疗周期结束后、随访过程中的临床和实验室指标(尿检、血常规、血生化、免疫学检查等),评估临床疗效、记录不良事件及合并用药。24h尿蛋白定量采用双缩脲比色法,血清白蛋白采用溴甲酚绿检测法,血清肌酐(SCr)采用酶法检测。
相关定义 完全缓解(CR):尿蛋白≤0.4 g/24h,无活动性尿沉渣,血清白蛋白≥35 g/L、SCr正常;部分缓解(PR):尿蛋白定量下降超过基础值50%且尿蛋白<3.5 g/24h,血清白蛋白≥30 g/L,SCr正常或上升不超过25%;无效:未达到CR或PR定义[5]。
难治性LN的定义:至少接受一种免疫抑制剂治疗6个月以上未获得缓解;或者出现肾脏复发伴有病理转型或免疫学指标持续阳性[15-17]。
肾脏复发包括肾病性复发和肾炎性复发。肾病性复发是指CR的患者尿蛋白定量≥1.0 g/24h;PR的患者尿蛋白定量增加≥2.0 g/24h或蛋白尿>1.0 g/24h的患者尿蛋白倍增;肾炎性复发指尿沉渣红细胞或管型增加,伴或不伴蛋白尿,通常有肾功能减退[1,18]。
结 果
一般资料 从2011年10月至2014年12月,共纳入5例患者,女性4例,男性1例,年龄在21~43岁,SLE病程为1.5~22年,既往均接受过大剂量免疫抑制剂治疗,其中3例治疗无效,2例复发。5例患者临床资料见表1。
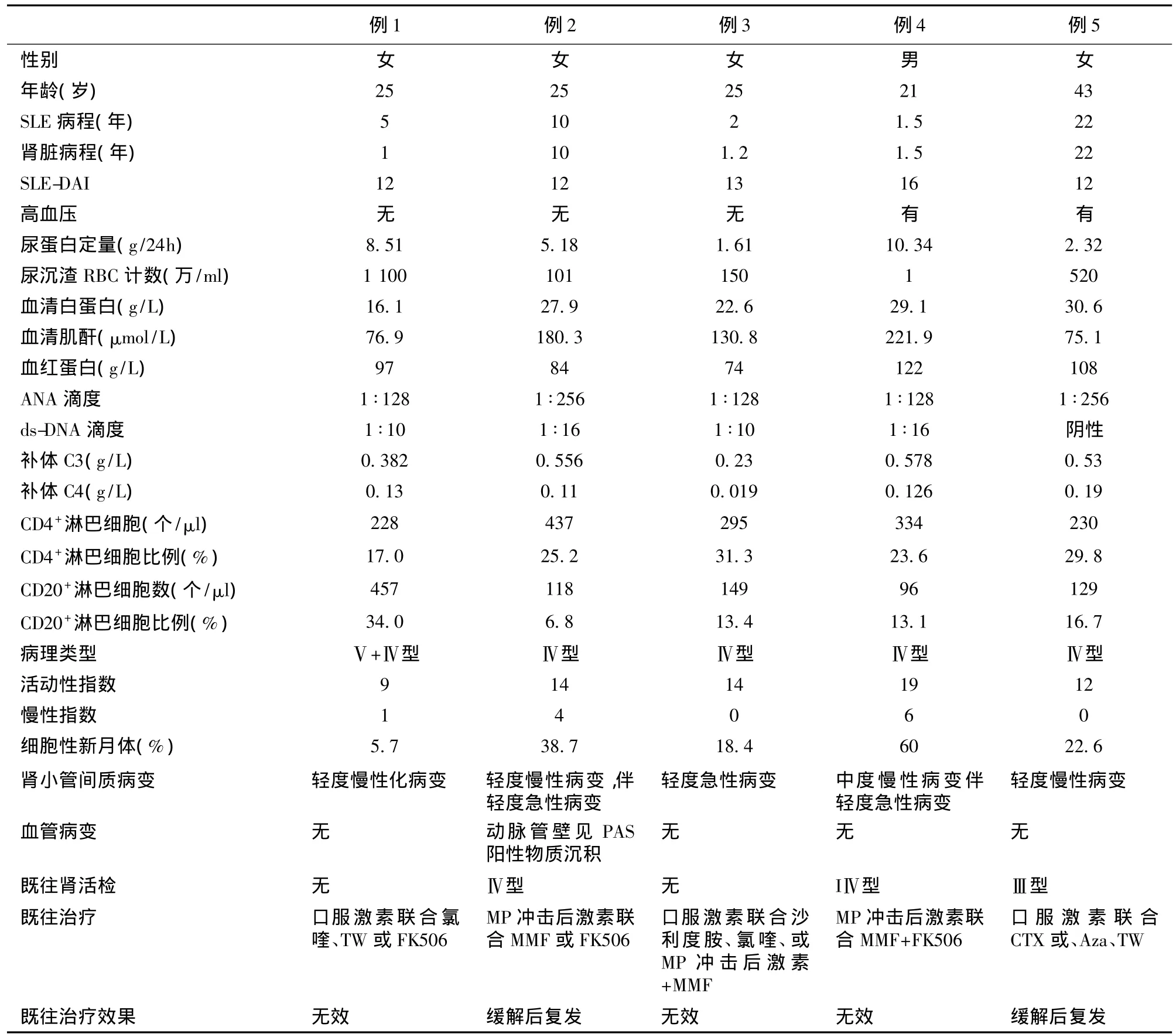
表1 患者的临床基础资料
硼替佐米用量 硼替佐米治疗周期为2~4个,每个周期每次硼替佐米治疗剂量为1.9~2.4 mg。其中例1、例2和例4完成了4个治疗周期;例3完成第1、2治疗周期,第3、4治疗周期因出现一过性发热,分别接受d1、d4、d8和 d1、d4治疗;例5完成3个治疗周期,第3治疗周期因合并带状疱疹仅接受d1治疗。
临床疗效 硼替佐米治疗后,4例患者达到部分缓解。SLE-DAI由治疗前12~16分下降至4~8分,尿蛋白定量分别降至1.98 g/24h、1.70 g/24h、0.62 g/24h、6.46 g/24h 和 0.87 g/24h,血清白蛋白上升至 34.4 g/L、40.5 g/L、39.0 g/L、33.8 g/L 和38.6 g/L,3例SCr异常患者,治疗后SCr降至122.0 μmol/L、69.8 μmol/L 和 171.5 μmol/L。例 1 肉眼血尿消失。3例患者镜下血尿明显减少。图1A~D为患者治疗过程中SLE-DAI、尿蛋白定量、血清白蛋白和SCr的变化。
硼替佐米治疗后,血清自身抗体也较治疗前改善。3例患者 ANA滴度下降,3例患者抗 ds-DNA转阴,1例抗 ds-DNA滴度下降。补体 C3、C4均较治疗前上升。治疗后 C3分别为0.70 g/L、0.70 g/L、0.41 g/L、1.01 g/L 和0.86 g/L(2 例患者达到正常范围),C4 分别为 0.15 g/L、0.13 g/L、0.04 g/L、0.14 g/L 和0.20 g/L。

图1 硼替佐米治疗过程中SLE-DAI、尿蛋白定量、血清白蛋白和肌酐的变化
患者外周血CD20+细胞数下降至195个/μl、65个/μl、97 个/μl、80 个/μl和 41 个/μl,同样,CD20+细胞比例也较治疗前下降,分别为9.4%、4.2%、11.2%、5.1%和2.4%(图2)。

图2 硼替佐米治疗过程中CD20+细胞数和比例的变化
不良事件 本研究中5例患者共发生23人次不良事件,42例次不良事件(平均每例8.4次),无严重不良事件发生。不良事件包括血小板减少、胃肠道症状(恶心、胃纳差、腹泻、便秘)、SCr升高、肉眼血尿、外周神经毒性和发热等(表2)。这些不良事件均属于1~2级,大多数为一过性,停药间期可自行缓解,以一过性血小板减少、一过性发热和胃肠道症状多见。外周神经毒性主要表现为肢端麻木,未见累积毒性。1例患者发生带状疱疹感染。

表2 硼替佐米治疗过程中的不良事件
随访观察 硼替佐米治疗结束后继续予免疫抑制剂治疗。例1和例3予FK506治疗(剂量4 mg/d,浓度分别为2.49~3.22 ng/ml和3.91~5.83 ng/ml),例2和例4接受MMF治疗(剂量0.75~1.0 g/d),例5单予泼尼松(10 mg/d)维持治疗。随访了6~24个月,例1、例3和例5获得CR,例2持续PR(少量蛋白尿,肾功能正常),例4大量蛋白尿持续存在,逐渐出现SCr升高,随防6个月达到SCr倍增,目前已行肾脏替代治疗。
讨 论
随着对LN发病机制的认识及新型免疫抑制剂的问世,人们也在不断探讨LN新疗法,以期获得更好的临床疗效[1]。传统的CTX疗法和近年来推出的MMF、FK506、多靶点疗法等治疗方案已经取得较高的诱导期缓解率,但是仍然有一部分对这些治疗无效或者在缓解后出现复发的难治性LN患者,可能与长寿命浆细胞持续产生抗体有关[19-21]。硼替佐米影响多种免疫细胞,涉及抗原递呈、信号传导和细胞调亡等过程[11-12,22]。动物试验证实硼替佐米治疗LN 的效果与激素联合MMF相似[12-13];对浆细胞的抑制作用强于CTX和地塞米松,而且起效快,持续时间长[12]。在肾移植受者中观察到硼替佐米治疗后,DSA自身抗体长时期处于低水平状态[23]。因此,有学者提出硼替佐米可能是LN一个新的治疗药物[22]。
硼替佐米治疗LN最初是在合并多发性骨髓瘤的SLE患者观察的,采用硼替佐米治疗,随着骨髓瘤的好转,SLE 的病情也得到明显改善[24-25]。2015年Alexander等[15]首次观察了硼替佐米联合地塞米松治疗(1~4个疗程)12例难治性LN患者发现,硼替佐米治疗后SLE-DAI明显下降,尿蛋白减少,血清dsDNA抗体水平下降,补体C3升高,同时外周血和骨髓中的浆细胞数量减少,硼替佐米对狼疮疾病活动的控制持续到6个月。本研究首次在中国人群中观察硼替佐米治疗LN的疗效,我们也选择了难治性LN患者(包括疗效不佳或复发患者),结果观察到硼替佐米治疗4个周期后,4例患者获得PR,SLE-DAI较治疗前下降,尿蛋白减少,血清白蛋白升高,SCr下降,免疫学指标也明显改善。
本研究和 Alexander等[15]的研究中,硼替佐米治疗的同时均联合使用糖皮质激素,因此短期疗效不能完全排除激素的作用,但是糖皮质激素是LN的基础治疗药物,无法避免使用[3-5]。Alexander等[15]采用的地塞米松用法与骨髓瘤治疗方案相同,每次注射硼替佐米时同时给予20 mg地塞米松,我们采用的是甲泼尼龙冲击治疗后口服泼尼松,并逐渐减量。硼替佐米治疗结束,后续随访过程中有3例达到CR,1例病情稳定。1例患者在随访中进入终末期肾病,可能与该患者肾脏病变较重有关(新月体比例高、慢性化程度高)。
本文观察到硼替佐米治疗中的不良事件主要为血小板减少、胃肠道症状、外周神经毒性、SCr升高及发热等,与文献报道相似[10-11,15]。虽然每例患者都有不良事件发生,但程度较低,属于1~2级,并且多为一过性,在治疗间期可自行恢复或改善,无一例发生严重不良事件。患者对硼替佐米治疗耐受性好,3例患者完成了4个疗程治疗。而Alexander等[15]的报道中33.3%发生严重不良事件,并且平均硼替佐米治疗为2个疗程。
本文属于探索性观察研究,缺乏对照,并且观察例数较少;其次硼替佐米治疗仅为12周,并在随访过程中加用了其他免疫抑制剂,无法评估硼替佐米单独治疗的长期疗效和安全性;第三,虽然观察了外周血CD20+细胞计数和比例的变化,但是未监测外周血和骨髓中浆细胞的变化。因此,硼替佐米治疗LN的适应征、用法剂量及疗程等,仍需深入研究。
小结:硼替佐米联合糖皮质激素可减少难治性LN患者蛋白尿、改善肾功能,降低自身抗体滴度。硼替佐米治疗耐受性好、不良事件程度轻,可能是LN诱导治疗的一种替代疗法,但其临床疗效和安全性尚需进一步深入研究。
1 Sprangers B,Monahan M,Appel GB.Diagnosis and treatment of lupus nephritis flares--an update.Nat Rev Nephrol,2012,8(12):709-717.
2 Chen YE,Korbet SM,Katz RS,et al.Value of a complete or partial remission in severe lupus nephritis.Clin J Am Soc Nephrol,2008,3(1):46-53.
3 Appel GB,Contreras G,Dooley MA,et al.Mycophenolate mofetil versus cyclophosphamide for induction treatment of lupus nephritis.J Am Soc Nephrol,2009,20(5):1103-1112.
4 Ginzler EM,Dooley MA,Aranow C,et al.Mycophenolate mofetil or intravenous cyclophosphamide for lupus nephritis.N Engl J Med,2005,353(21):2219-2228.
5 Liu Z,Zhang H,Liu Z,et al.Multitarget therapy for induction treatment of lupus nephritis:a randomized trial.Ann Intern Med,2015,162(1):18-26.
6 Houssiau FA,D 'Cruz D,Sangle S,et al.Azathioprine versus mycophenolate mofetil for long-term immunosuppression in lupus nephritis:results from the MAINTAIN Nephritis Trial.Ann Rheum Dis,2010,69(12):2083-2089.
7 Dooley MA,Jayne D,Ginzler EM,et al.Mycophenolate versus azathioprine as maintenance therapy for lupus nephritis.N Engl J Med,2011,365(20):1886-1895.
8 Catapano F,Chaudhry AN,Jones RB,et al.Long-term efficacy and safetyofrituximab in refractoryand relapsingsystemiclupus erythematosus.Nephrol Dial Transplant,2010,25(11):3586-3592.
9 黄湘华,王庆文,胡伟新,等.自体外周血造血干细胞移植治重症疗狼疮性肾炎的临床观察 .肾脏病透析与肾移植杂志,2014,23(6):501-506.
10 Jagannath S,Richardson PG,Barlogie B,et al.Bortezomib in combination with dexamethasone for the treatment of patients with relapsed and/or refractory multiple myeloma with less than optimal response to bortezomib alone.Haematologica,2006,91(7):929-934.
11 Richardson PG,Barlogie B,Berenson J,et al.A phase 2 study of bortezomib in relapsed,refractory myeloma.N Engl J Med,2003,348(26):2609-2617.
12 Neubert K,Meister S,Moser K,et al.The proteasome inhibitor bortezomib depletes plasma cells and protects mice with lupus-like disease from nephritis.Nat Med,2008,14(7):748-755.
13 Perry DK,Burns JM,Pollinger HS,et al.Proteasome inhibition causes apoptosis of normal human plasma cells preventing alloantibody production.Am J Transplant,2009,9(1):201-209.
14 Lee SW,Kim BS.Comparison of therapeutic efficacybetween bortezomib and combination treatment of prednisolone and mycophenolate mofetil on nephritis in NZB/WF1 mice.Clin Exp Rheumatol,2010,28(3):393-396.
15 Alexander T,Sarfert R2,Klotsche J3,et al.The proteasome inhibitior bortezomib depletes plasma cells and ameliorates clinical manifestations of refractory systemic lupus erythematosus.Ann Rheum Dis,2015,74(7):1474-1478.
16 Bonilla-Abadía F,Coronel Restrepo N2,Tobón GJ1,et al.Rituximab for remission induction and maintenance in refractory systemic lupus erythematosus.Autoimmune Dis,2014,2014:731806.
17 Smith KG,Jones RB,Burns SM,et al.Long-term comparison of rituximab treatment for refractory systemic lupus erythematosus and vasculitis:Remission,relapse,and re-treatment.Arthritis Rheum,2006,54(9):2970-2982.
18 Kidney Disease Improving Global Outcomes (KDIGO)Glomerulonephritis Work Group:KDIGO Clinical Practice Guideline for Glomerulonephritis.Kidney Int,2012(Suppl 2):221-232.
19 Gatto D,Martin SW,Bessa J,et al.Regulation of memory antibody levels:the role of persisting antigen versus plasma cell life span.J Immunol,2007,178(1):67-76.
20 Hoyer BF,Moser K,Hauser AE,et al.Short-lived plasmablasts and long-lived plasma cells contribute to chronic humoral autoimmunity in NZB/W mice.J Exp Med,2004,199(11):1577-1584.
21 侯金花,章海涛.长寿命浆细胞与系统性红斑狼疮.肾脏病透析与肾移植杂志,2013,22(6):549-553.
22 Moran E,Carbone F,Augusti V,et al.Proteasome inhibitors as immunosuppressants:biological rationale and clinical experience.Semin Hematol,2012,49(3):270-276.
23 Everly MJ,Terasaki PI,Trivedi HL.Durability of antibody removal following proteasome inhibitor-based therapy.Transplantation,2012,93(6):572-577.
24 Fröhlich K,Holle JU,Aries PM,et al.Successful use of bortezomib in a patient with systemic lupus erythematosus and multiple myeloma.Ann Rheum Dis,2011,70(7):1344-1345.
25 Curtis JR,Perez-Gutthann S,Suissa S,etal.Tocilizumab in rheumatoid arthritis:a case study of safety evaluations of a large postmarketing data set from multiple data sources.Semin Arthritis Rheum,2015,44(4):381-388.
