绿色氧化法制备HNS的催化体系
2015-05-10曹晓华陆婷婷
曹晓华, 陆婷婷, 陆 明
(南京理工大化工学院, 江苏 南京 210094 )
1 引 言
2,2′,4,4′,6,6′-六硝基二苯基乙烯(六硝基茋,HNS)是一种性能较优的耐热炸药,静电感度小,机械感度低,低温下也能稳定起爆(-193 ℃时的爆速比常温爆速仅降低5%)。用黑索今(RDX)制成的导爆索在149 ℃环境中几小时后就不能使用,而HNS制成的导爆索在227 ℃放置一周仍能可靠被起爆[1],所以HNS不但用于各种耐热爆破器材中,也常用于深井石油开采、航空航天等[2],细化后制成的超细HNS还是常规武器用冲击片雷管的优良始发药剂。另外,HNS还可与TNT形成络合物,可作为TNT类熔铸炸药的改良剂,以提高铸件机械强度,从而提高发射安全性[3]。
2,2′,4,4′,6,6′-六硝基联苄(HNBB)是制备HNS的重要中间体,国外已有诸多报道使用卤化剂、醌和其他化学试剂通过氧化HNBB脱氢制备HNS[4-5],但这些方法存在着使用致癌试剂(如对苯醌、苯)和污染环境试剂(如溴、卤代苯醌、吡啶)等问题。现在国内制备HNS的最主要方法是使用苯和吡啶作溶剂、溴氧化HNBB脱氢,其粗产品收率92%,纯化后80%左右[6],但溶剂苯是致癌的高毒物质,液溴有极强烈的毒害性与腐蚀性,常温时就能挥发出强刺激性的烟雾。氧气则是最理想的氧化剂,廉价易得且取之不尽,其氧化的副产物一般为对环境无污染的水,因此寻找一种合适的需氧催化剂显得尤为重要。长期以来就有人尝试用氧气作氧化剂氧化HNBB脱氢,但结果都不满意[7]。
自由基催化剂催化需氧氧化反应近几年来较为热门。作为常用的自由基催化剂,2,2,6,6-四甲基哌啶-N-氧自由基(TEMPO)、4-羟基-2,2,6,6-四甲基哌啶-N-氧自由基(4-OH-TEMPO)、N′,N″,N‴, -三羟基异腈酸(THICA)和N-羟基邻苯二甲酰亚胺(NHPI)是被多次报道催化需氧氧化脱氢反应的自由基催化剂[8-14],并常常与过渡金属催化剂如铁盐、钴盐等协同作用,Pt族金属如Pd、Pt和Ru等虽然催化氧化反应历史悠久,但这些金属价格昂贵且催化效果也只比普通过渡金属稍好[15],考虑到催化剂成本,一般采用普通过渡金属盐作催化剂。
本研究首次采用4-OH-TEMPO/ FeCl2催化、氧气氧化HNBB脱氢制备HNS,讨论了自由基催化剂和金属盐种类、溶剂、主副催化剂比例对反应的影响,提出了可能的机理。
2 实验部分
2.1 试剂与仪器
试剂: 二甲亚砜(DMSO)、丙酮: 分析纯,上海凌峰化学试剂有限公司; 氯化亚铁: 分析纯,上海润捷化学试剂有限公司; 4-OH-TEMPO: 分析纯,上海达瑞化学试剂有限公司; HNBB,试剂纯,按文献方法合成[10]。
仪器: Bruker DRX500(500 MHz)核磁共振光谱仪; 岛津IR Prestige-21型傅里叶变换红外分光光度计型红外光谱仪; SGWX-4熔点仪; 双泵型岛津液相色谱仪。
2.2 实验过程
向50 mL四口烧瓶中依次加入1.00 g (2.21 mmol)HNBB,0.02g (0.13 mmol)4-OH-TEMPO,0.04 g (0.20 mmol) FeCl2和10.0 mL DMSO中,磁力搅拌下升温至55 ℃,并以25 mL·h-1的速度通O2到液面以下。反应8 h后将反应液倒入100 mL水中析出沉淀,2 h后过滤固体,将粗产品用丙酮煮洗1 h,得到浅黄色的固体,收率81%。纯度97%(HPLC, CH3CN∶H2O=7∶3)。m.p: 313~315 ℃; IR (KBr,ν/cm-1): 3102, 2894, 1610(aromatic CC), 1600, 1534(NO2), 1477, 1341(NO2), 1268, 1176, 1075, 960(CH deformation in trans CC), 917(CH out-of off-plane deformation in the picryl group), 794, 722, 556, 514;1H NMR (DMSO-d6):γ, 7.140(s, 2H, CH),γ, 9.109(s, 4H, aryl H)。
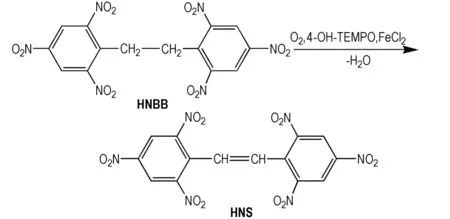
Scheme 1
3 结果与讨论
3.1 反应溶剂的选择
溶剂对HNS收率的影响见图1。由图1可知,HNBB几乎不溶于苯、乙酸乙酯和甲醇,所以用它们作反应溶剂时,没有产物生成。乙腈虽然常作4-OH-TEMPO催化醇氧化脱氢制备醛酮的溶剂,但它不适合HNBB的氧化脱氢反应(收率22%); 丙酮对HNBB和4-OH-TEMPO的溶解度较大,但其沸点太低,易在反应中蒸发,回流下收率也不高(15%)。使用二甲基甲酰胺(或环己胺)作溶剂时,会生成红色的粘性固体,HPLC检测显示,此产物中混有大量的未知副产物; DMSO作溶剂时,收率可达80%以上,原因可能是DMSO不但能完全溶解催化剂和底物,并且通过氧或硫原子与金属离子成键,从而增加了金属催化剂活性,加速反应发生。因此,确定DMSO作HNBB氧化脱氢的最佳溶剂。
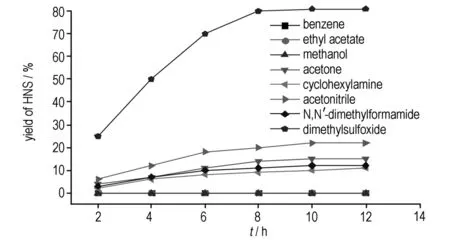
图1溶剂对HNS收率的影响
Fig.1Effect of solvent on yield of HNS
3.2 HNBB氧化脱氢催化剂种类的选择
自由基催化剂(2 , 2 , 6 , 6-四甲基哌啶-N-氧自由基(TEMPO)、4-羟基-2 , 2 , 6 , 6-四甲基哌啶-N-氧自由基(4-OH-TEMPO)、N′,N″,N‴ -三羟基异腈酸(THICA)和N-羟基邻苯二甲酰亚胺(NHPI))和过渡金属盐对HNS收率的影响见表1和表2。
表1自由基催化剂催化HNBB氧化脱氢反应的结果
Table1Effect of stable radicals on aerobic oxidation dehydrogenation of HNBB
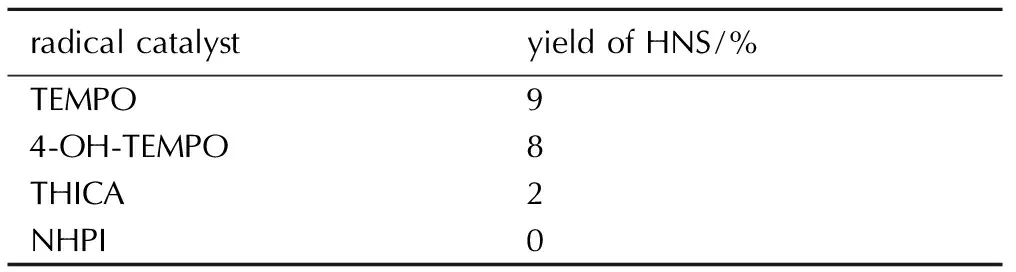
radicalcatalystyieldofHNS/%TEMPO94⁃OH⁃TEMPO8THICA2NHPI0
表2金属盐单一催化HNBB氧化脱氢的实验结果
Table2Effect of different metal salts on aerobic oxidation dehydrogenation of HNBB
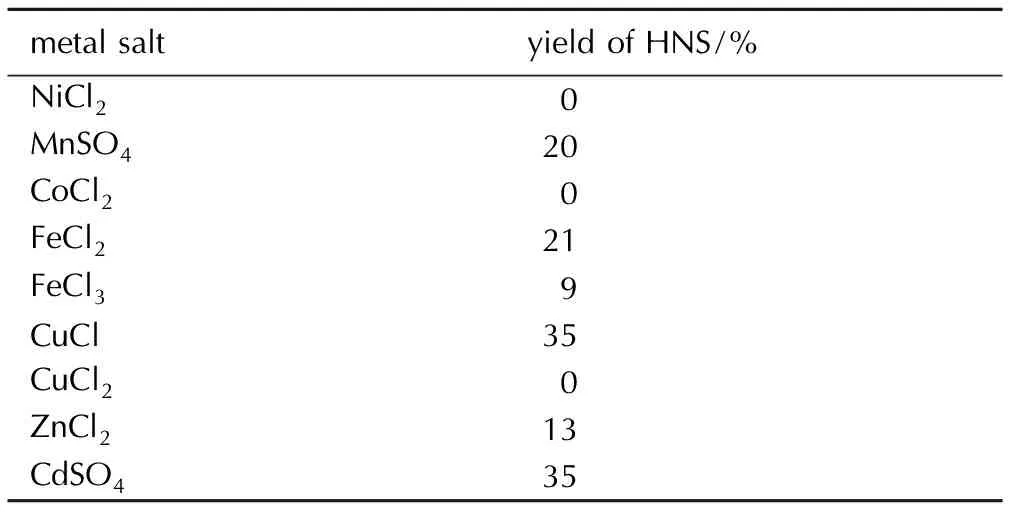
metalsaltyieldofHNS/%NiCl2 0MnSO4 20CoCl2 0FeCl2 21FeCl3 9CuCl 35CuCl2 0ZnCl2 13CdSO435
由表1可见,四种自由基催化剂单一催化效果都不理想,最高收率才9%,最低为0(NHPI)。从表2来看,金属盐单一催化HNBB氧化脱氢效果各不相同,同种金属使用高价态盐催化效果不如低价态盐,这可能与氧化脱氢反应机理有关(见3.4节); 其中催化效果最好的是CuCl和CdSO4,收率都为35%,其次是FeCl2(21%); NiCl2,CoCl2和CuCl2并无催化作用。显然,自由基催化剂和金属催化剂单一使用效果并不理想,将其进行组合,以协同催化HNBB氧化脱氢。不同催化剂组合对HNBB氧化脱氢的影响见图2。
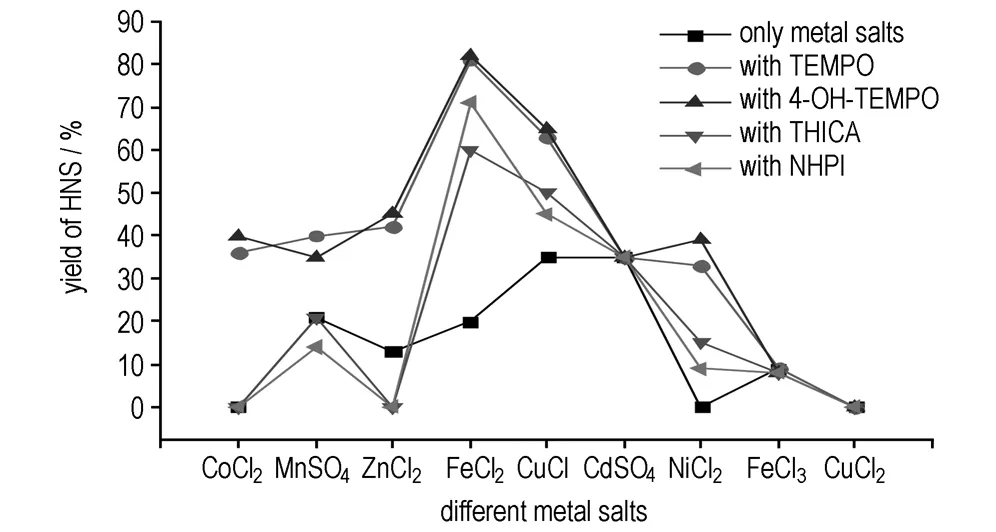
图2自由基催化剂与金属盐协同催化HNBB氧化脱氢反应的结果
Fig.2Results of aerobic oxidation dehydrogenation of HNBB catalyzed by radical and metal salts
由图2可知,虽然+2价铁盐单一催化HNBB氧化脱氢得HNS的收率并不是最高的,但是与自由基催化剂联合后,TEMPO/FeCl2和4-OH-TEMPO/FeCl2体系的催化效果最好,收率80%以上,其次是NHPI/ FeCl2,收率71%。自由基催化剂对金属盐单一催化收率较高的镉盐和+2价铜盐没有助催化作用,对+3价铁盐也没有,由于4-OH-TEMPO比TEMPO便宜,并且二者催化结果类似,出于对成本的考虑,确定此反应的最佳催化剂为4-OH-TEMPO/FeCl2体系。
3.3 催化剂比例的研究
在确定了催化体系(4-OH-TEMPO/FeCl2)后,还需要确定催化剂的最适比例,以使反应效果达到最佳,催化剂比例对HNBB氧化脱氢反应的影响见表3。由表3可知,HNS收率随着4-OH-TEMPO占总催化剂比例的升高而增加,并在4-OH-TEMPO比例升高到40%时达最大值,之后,收率随着4-OH-TEMPO的比例升高而降低,因此,n(FeCl2)∶n(4-OH-TEMPO) =6∶4时,催化体系的催化效果最优。
表3两种催化剂的摩尔比对HNS收率的影响
Table3Effect of the molar ratio of 4-OH-TEMPO and FeCl2on yield of HNS
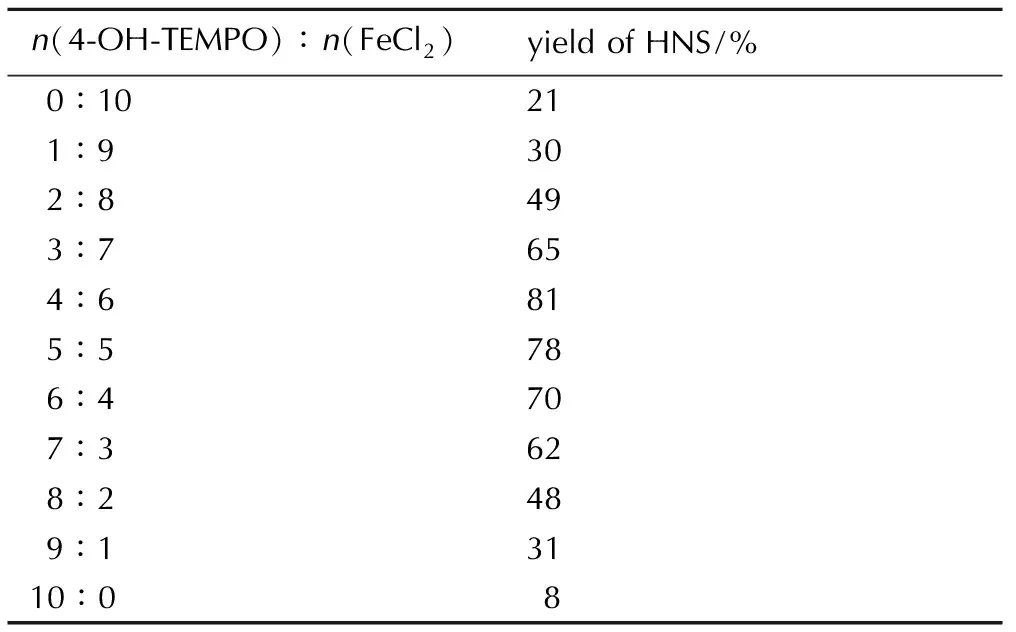
n(4⁃OH⁃TEMPO)∶n(FeCl2)yieldofHNS/%0∶10211∶9302∶8493∶7654∶6815∶5786∶4707∶3628∶2489∶13110∶08
3.4 催化机理探讨
在参考TEMPO催化醇氧化脱氢机理的基础上[17-22],本研究设计了以下实验来探讨Fe2+/4-OH-TEMPO体系的共同催化机理: 在氮气环境下,底物HNBB为2.21 mmol,以2.21 mmol 4-OH-TEMPO为氧化剂,再加入2.21 mmol FeCl2、0.14 mmol FeCl2和不加入FeCl2的三种情况下,55 ℃下反应,考察HNBB的氧化脱氢反应,结果见表4。
表44-OH-TEMPO/FeCl2催化氧化HNBB对HNS收率的影响
Table4Results of aerobic oxidation dehydrogenation of HNBB catalyzed by Fe2+/4-OH-TEMPO
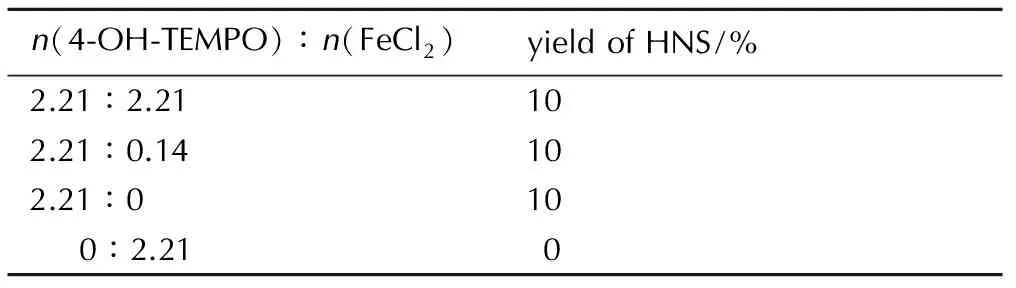
n(4⁃OH⁃TEMPO)∶n(FeCl2)yieldofHNS/%2.21∶2.21102.21∶0.14102.21∶010 0∶2.210
由表4可知,在氮气气氛下,用当量4-OH-TEMPO氧化HNBB脱氢,无论加或不加FeCl2,HNS的收率都只有10%,表明4-OH-TEMPO作氧化剂时对HNBB氧化脱氢的能力有限,同时,FeCl2对氮气氛围下4-OH-TEMPO氧化HNBB脱氢没有催化效果,使用当量FeCl2氮气氛围下对HNBB直接氧化脱氢,没有产物生成,这显然与在氧气氛围中(收率21%)反应的结果完全不同,证明FeCl2必须在氧气存在条件下才可以对HNBB氧化脱氢。根据上述实验结果,推测氧气氛围下结合氧气氧化HNBB脱氢的主催化剂应该是FeCl2,4-OH-TEMPO只起到一个促进循环加速氧化脱氢的助催化作用,推测Fe2+/4-OH-TEMPO催化HNBB氧化脱氢反应的机理如Scheme 2所示。
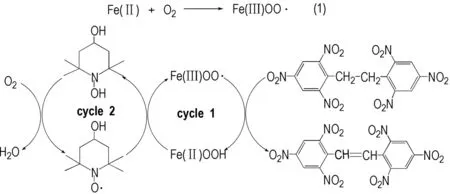
Scheme 2
Fe(Ⅱ)首先被氧气氧化成Fe(Ⅲ)OO·[23](式(1) ),接着Fe(Ⅲ)OO·对HNBB进行氧化脱氢制备HNS,同时,自己被还原为Fe(Ⅱ)OOH(环1),4-OH-TEMPO再将Fe(Ⅱ)OOH氧化成Fe(Ⅲ)OO·,自己被还原成4-OH-TEMPOH[24-27](环2),最后氧气分子重新将4-OH-TEMPOH氧化成4-OH-TEMPO。当然,Fe2+可以单独催化HNBB氧化脱氢,但需要氧气参与,且收率较低(只有21%)。
研究了其他单金属盐催化HNBB的氧化脱氢反应,结果发现,一些较为稳定的金属离子如K+, Cu2+和Fe3+,不易被氧气氧化到高价态形式,反应式(1)不能发生,也就是3.2节的高价态盐催化效果不如低价态盐。
4 结 论
(1)以HNBB为原料,4-OH-TEMPO/ FeCl2体系催化、氧气氧化其脱氢合成HNS,收率81%。
(2)优化了催化氧化脱氢的反应条件,最适宜溶剂为DMSO,最佳催化剂组合及其摩尔比为:n(FeCl2)∶n(4-OH-TEMPO)=6∶4。
(3)提出了可能的反应机理: 亚铁离子结合氧气直接氧化底物HNBB脱氢得到HNS,而 4-OH-TEMPO在这个过程中起到的是促进FeCl2循环加速氧化脱氢的助催化作用。
参考文献:
[1] 惠君明. 六硝基茋炸药及其应用[J]. 爆破器材,1994, 4(2): 9-12.
HUI Jun-ming. Hexanitrostilbene (HNS) and its application[J].ExplosiveMaterials, 1994, 4(2): 9-12.
[2] Rieckmann T, Volker S, Lichtblau L,et al. Investigation on the thermal stability of hexanitrostilbene by thermal analysis and multivariate regression[J].ChemEngSci, 2001, 56(4): 1327-1335.
[3] Cartwright M, Hill C J. Thermal investigation of the crystallisation nucleant formed between 2, 4, 6-trinitrotoluene (TNT) and 2, 2′, 4, 4′, 6, 6′-hexanitrostilbene (HNS) [J].JThermAnal, 1995, 44(5): 1021-1036.
[4] Kompolthy. Preparation of hexanitrostilene: US 3213132[P]. 1979.
[5] Gilbert E E. The preparation of hexanitrostilbene from hexanitrobibenzyl[J].Propellants,Explosives,Pyrotechnics, 1980, 5(6): 168-172.
[6] 陆明, 吕春绪, 惠君明. 提高六硝基茋得率的研究[J]. 含能材料,1998, 6(2): 96-99.
LU Ming, LV Chun-xu, HUI Jun-ming. A study on yield increase in hexanitro-stilbene (HNS) synthesis [J].ChineseJournalofEnergeticMaterials(HannengCailiao), 1998, 6(2): 96-99.
[7] Gilbert E E. Preparation of hexanitrostilbene: US 4221745[P]. 1980.
[8] 王心亮, 梁鑫淼. 温和条件下Fe(NO3)3/4-OH-TEMPO催化需氧氧化醇制备羰基化合物[J]. 催化学报,2008, 29(9): 935-939.
WANG Xin-lang, LIANG Xin-miao.Aerobic oxidation of alcohols to carbonyl compounds catalyzed by Fe(NO3)3/ 4-OH-TEMPO under mild conditions [J].ChineseJournalofCatalysis, 2008, 29(9): 935-939.
[9] 尚洁,赵文军,王华,等. 室温条件下4-OH-TEMPO体系高效选择催化氧化苄醇为醛的研究[J]. 应用化工, 2010,39(7): 997-1000.
SHANG Jie, ZHAO Wen-jun, WANG Hua, et al. Moderate and selective aerobic oxidization of benzyl alcohols to corresponding aldehydes catalyzed by 4-OH-TEMPO system [J].AppliedChemicalIndustry, 2010,39(7): 997-1000.
[10] Jiang N, Ragauskas A J.TEMPO-catalyzed oxidation of benzylic alcohols to aldehydes with the H2O2/HBr/ionic liquid [bmim]PF6system[J].TetrahedronLett, 2005, 46(19): 3323-3326.
[11] Wang N, Liu R, Chen J, et al. NaNO2-activated, iron-TEMPO catalyst system for aerobic alcohol oxidation under mild conditions[J].ChemCommun, 2005(42): 5322-5324.
[12] Hirai N, Sawatari N, Nakamura N, et al. Oxidation of substituted toluenes with molecular oxygen in the presence ofN,N′, N″-trihydroxyisocyanuric acid as a key catalyst[J].JOrgChem, 2003, 68(17): 6587-6590.
[13] Weissenböck K, Alsters P L.Low temperature, high conversion, liquid-phase benzylic oxidation with dioxygen by metal/NHPI-catalyzed Co-oxidation with benzaldehyde[J].EurJOrgChem, 2003, 2003(3): 578-586.
[14] Ishii Y. Anovel catalysis ofN-hydroxyphthalimide in the oxidation of organic substrates by molecular oxygen[J].JOrgChem, 1995, 60(13): 3934-3935.
[15] Cao Q, Dornan L M, Rogan L, et al. Aerobic oxidation catalysis with stable radicals[J].ChemComn, 2014, 50(35): 4524-4543
[16] 黄靖伦,程碧波,马卿,等.六硝基联苄的制备工艺及性能 [J]. 含能材料,2011,19(2): 240.
HUANG Jing-lun, CHENG Bi-bo, MA Qin, et al.The study of synthesis technology and performance of HNBB [J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2011,19(2): 240.
[17] Singh B, Long J R, Gatteschi D,et al. Synthesis, reactivity, and catalytic behavior of iron/zinc-containing species involved in oxidation of hydrocarbons under gif-type conditions [J].JAmChemSoc, 1997, 119(30): 7030-7047.
[18] Herrerías C I, Zhang T Y, Li C. Catalytic oxidations of alcohols to carbonyl compounds by oxygen under solvent-free and transition-metal-free conditions[J].TetrahedronLett, 2006, 17(1): 13-17.
[19] Liu R, Liang X, Dong C,et al. Transition-metal-free: a highly efficient catalytic aerobic alcohol oxidation pocess[J].JAmChemSoc, 2004, 126(13): 4112-4113.
[20] Michel C, Belanzoni P, Gamez P,et al. Activation of the C—H bond by electrophilic attack: theoretical study of the reaction mechanism of the aerobic oxidation of alcohols to aldehydes by the Cu(bipy)2+/2, 2, 6, 6-tetramethylpiperidinyl-1-oxy Co-catalyst system[J].InorgChem, 2009, 48(24): 11909-11920.
[21] Bowry V W, Ingold K U. Kinetics of nitroxide radical trapping. 2. structural effects[J].JAmChemSoc, 1992, 114(13): 4992-4996.
[22] Yakura T, Ozono A. Novel 2, 2, 6, 6-tetramethylpiperidine 1-oxyl-iodobenzene hybrid catalyst for oxidation of primary alcohols to carboxylic acids[J].AdvSynthCatal, 2011, 353(6): 855-859.
[23] Punniyamurthy T, Velusamy S, Iqbal J. Recentadvances in transition metal catalyzed oxidation of organic substrates with molecular oxygen [J].ChemRev, 2005, 105(6): 2329-2363.
[24] Otsuka T, Motozaki W, Nishikawa K,et al. Intermolecular H-bond of solvent molecule with nitroxide radical using ab initio MO calculations[J].JMolStruct, 2002, 615(1): 147-151.
[25] Laugier J, Latour J M, Caneschi A,et al. Structural and redox hoperties of the tempo adducts of copper(II) halides[J].InorgChem, 1991, 30(23): 4474-4411.
[26] Dijksman A, Arends I W C E, Sheldon R A. Cu(II)-nitroxyl radicals as catalytic galactose oxidase mimics[J].OrgBiomolChem, 2003, 1(18): 3232-3237.
[27] Chen Y X, Qian L F, Zhang W,et al. Efficient aerobic oxidative synthesis of 2-substituted benzoxazoles, benzothiazoles, and benzimidazoles catalyzed by 4-methoxy-TEMPO[J].AngewChem, 2008, 120(48): 9470-9473.
