4, 4′-偶氮-1H-1, 2, 4-三唑-5-酮铵盐AZTO·H2O的制备及热化学性质
2015-05-10肖建雄杜小利乔丽燕徐抗震
肖建雄, 杜小利, 乔丽燕, 闫 东, 徐抗震, 黄 洁
(西北大学化工学院, 陕西省物理无机化学重点实验室, 陕西 西安 710069)
1 引 言
含能材料是武器系统的能源,对国防科技的建设有着非常重要的作用。高氮含能化合物[1]是一类含碳和氮的杂环为主要骨架且氮含量较高的化合物,其能量主要来源于环结构中含有更多高能N—N、C—N、NN、CN键和更大的环张力。高氮含能化合物结构中不含有或含有少量硝基基团,且分子中大多存在共轭结构,因此环张力比纯C或少N五元杂环化合物要小,分子的稳定性要高,而感度要低。从热化学性质来看,这类化合物具有热分解点高,正生成焓高等特点;同时,结构中高氮、低碳氢使其在反应过程中更容易达到氧平衡,燃烧产物多为环境友好的N2,具有作为新型含能材料的潜力,是近年来国内外研究较多的一类含能材料[2-5]。
4-氨基-1, 2, 4-三唑-5-酮 (ATO)是一种三唑酮类化合物,白色粉末固体,熔点为187~188 ℃,具有含碳氢量低、含氮量高、较高密度、结构稳定等优点。ATO是一种多齿配体,分子中N,O原子上孤对电子可以使ATO以分子状态与金属盐或金属离子形成性能优异稳定的金属配合物,可以用来合成高氮含能化合物或作为合成高氮含能化合物的中间体[6]。20世纪60年代,利用碳酰肼和原甲酸三乙酯反应合成ATO的方法被Kroeger C F等[7]首先成功提出,并对ATO的部分性能进行了研究。美国科学家Odenthal[8],Dusseldorf[9]等利用不同的腈化物与碳酰肼反应合成出有不同取代基团的三唑酮类化合物。本研究以ATO为原料[10]制备出了一种新型高能有机偶氮铵盐AZTO·H2O,并分析了其热力学和动力学行为。
2 实验部分
2.1 合成路线

Scheme1Synthetic route of AZTO·H2O
2.2 试剂与仪器
实验药品: 甲醇,北京化工厂; ATO,自制; 无水乙醇,天津市河东区红岩试剂厂; 氯化铵,株洲江海环保实业有限公司;N,N-二甲基酰胺(DMF),天津市科密欧化学试剂有限公司; 浓盐酸,西陇化工股份有限公司; 高锰酸钾,西陇化工股份有限公司; 氢氧化钾,天津市风船化学试剂科技有限公司。以上药品均为分析纯。
实验仪器: 电子天平(JPT-10C)上海精科天平厂; 电热鼓风干燥箱(101-AB)北京科伟永兴仪器有限公司; 加热磁力搅拌器(RET control-vise)德国IKA; 元素分析仪(VarioELⅢ)德国艾乐曼公司; 同步热分析仪(SDT Q600)美国TA公司。
2.3 实验过程
2.3.1 ZTO的合成
将140 mmol (14 g)ATO和230 mL浓盐酸依次加入到500 mL三口烧瓶中,搅拌直至其全部溶解,冰盐水浴冷却使上述混合溶液的温度降至5 ℃,再开始滴加由98 mmol(15.5 g)KMnO4形成的饱和水溶液,控制滴加速度使反应液的温度不超过15 ℃,滴加完毕后,将反应溶液升温至60 ℃,保温搅拌反应5 h后,将反应得到的产物冷却,抽滤,水洗,烘干,用DMF重结晶,在50 ℃下真空干燥24 h后,得到41 mmol(8.08 g)白色粉末状固体(ZTO),产率为60%。IR (KBr,ν/cm-1): 3213.99(N—H), 3159.99(C—H), 1724.48(CO),1681.43(NN) , 1544.87(CN), 1259.27(C—N)。元素分析(%): C4N8O2H4: 实测值: C 24.48, H 2.58, N 57.15; 理论值: C 24.50, H 2.06, N 57.13。
2.3.2 K(ZTO)的合成
将51 mmol(1 g)ZTO和5 mL水依次加入50 mL三口烧瓶中,搅拌升温至50 ℃,缓慢滴加由20 mmol(1.12 g)KOH配制的2 mL水溶液,滴加完毕后,反应溶液变成黄色透明溶液。保温搅拌反应1.5 h后,搅拌冷却至室温,加入适量的甲醇有大量黄色沉淀析出,将得到的反应产物抽滤,甲醇洗涤,50 ℃下真空干燥24 h后,得到9 mmol(1.27 g)黄色粉末状固体(K(ZTO)),产率为98%,IR (KBr,ν/cm-1): 3247.59(N—H), 3120.31(C—H), 1639.22(NN), 1504.23(CN), 1330.66(C—N). MS (70eV)m/z(%): 235.0090(K+, 39), 219.0352(Na+, 39) .元素分析(%): K(ZTO)·H2O; 实测值: C 19.05, H 2.00, N 44.45; 理论值: C 19.38, H 3.19, N 44.67。
2.3.3 AZTO·H2O的合成
将33 mmol(0.5 g)K(ZTO)·H2O和10 mL浓氨水依次加入到100 mL三口烧瓶中,搅拌升温到30~35 ℃下至固体完全溶解,缓慢滴加由10 mmol(0.52 g)氯化铵(NH4Cl)配制的5 mL水溶液,滴加完毕后,保温搅拌反应30 min。反应完全后搅拌冷却至室温,有大量黄色沉淀析出,将反应产物抽滤,乙醇洗涤3~4遍,50 ℃下真空干燥24 h后,得到2 mmol(0.24 g)黄色晶粉末状固体。产率58.5%。1H NMR (UNITYINOVA 500 MHz, DMSO-d6): 8.55(N—CHN,s), 3.61 (NH4, d), 2.95为H2O峰,2.51为DMSO的溶剂峰(图1)。IR (KBr,ν/cm-1): 3224.45(N—H), 3120.31(C—H),1727.94(CO), 1639.22(NN), 1542.80 (CN), 1334.52(C—N). 元素分析(%): C4N10O3H14; 实测值: C 19.45, H 3.49, N 56.86; 理论值: C 19.36, H 4.84, N 56.45。
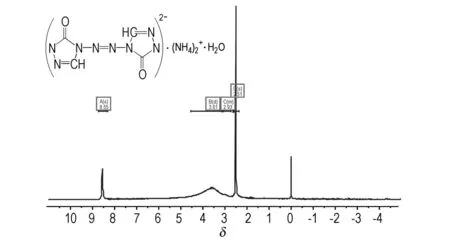
图1AZTO·H2O的核磁共振光谱
Fig.11H NMR spectrum of AZTO·H2O
3 结果与讨论
3.1 AZTO·H2O的热分解
AZTO·H2O在不同升温速率下的DSC曲线如图2所示。

图2AZTO·H2O在不同升温速率下的DSC曲线
Fig.2DSC curves of AZTO·H2O at different heating rates
由图2可以看出,化合物AZTO·H2O的热分解过程可分为两个阶段: 第一个阶段是脱水吸热过程,在5 ℃·min-1的升温速率下,热分解过程变化温度为136.6~158.9 ℃。此外推温度(Te),峰温(Tp)和脱水热分别为140.8 ℃,149.6 ℃,-97.8 J·g-1,由此可知配位水分子的作用力很强,比较难以失去。第二阶段为剧烈放热分解过程(升温速率5 ℃·min-1),热分解过程变化温度为219.4~256.4 ℃。此外推温度(Te)、峰温(Tp)和分解热分别为239.5 ℃、245.2 ℃、913.6 J·g-1。由于起始分解温度较高,可以看出AZTO·H2O有较好的热稳定性。
3.2 AZTO·H2O的热分解动力学
主要采用Ozawa法[11]和Kissinger法[12]计算热分解反应动力学参数:
Ozawa方程:
(1)
Kissinger方程:
(2)
通过不同的升温速率下的DSC曲线,得对应的Tp,Ozawa方程(1)可以看出lgβ与1/T呈一次线性关系,从斜率可求出Ozawa法的Eo值。
由图2可计算出第二段热分解反应过程的T0、Te、Tp、ΔHd、T00、Te0和Tp0参数值,结果列于表1。表2列出了Ozawa法与Kissinger法计算得到相应的A值、E值和r值。
计算结果显示,Ozawa法与Kissinger法计算结果一致,且r值都大于0.98。
利用方程(3)算得β→0时的外推起始温度值(Te0)为230.5 ℃:
tei=t00+bβi+cβi,i=1~4
(3)
式中,b和c为相关系数。
利用方程(4)计算得AZTO·H2O的热爆炸临界温度Tb为233.1 ℃:
(4)
式中,EO是用Ozawa法计算出的表观活化能。
图3是不同β下温度随反应进度(αi)的变化曲线,图4是在Ozawa方程中分别代入不同加热速率(β)下相对应的Ti和αi(i=1,2,3……),计算得到活化能(EO)随反应进度(αi)的变化曲线,从图4中可以看出,Ea值在α为0.10~0.78之间分布比较稳定,且均匀分布于176.50 kJ·mol-1和185.20 kJ·mol-1之间,基本和Ozawa法、Kissinger法在峰顶温度处的计算结果保持一致。最终通过计算得到AZTO·H2O的热分解反应的动力学方程为:

图3AZTO·H2O在不同β下的T-α曲线
Fig.3T-αcurves of AZTO·H2O at different heating rates
表1由不同升温速率下的DSC曲线得到的热力学参数
Table1Thermodynamic parameters determined by DSC curves at various heating rates (β)

β/℃·min-1T0/℃Te/℃Tp/℃ΔHd/kJ·mol-1T00/℃Te0/℃Tp0/℃5.0219.44239.47245.2410.0226.19246.76253.03247.46208.62230.47235.9915.0237.82252.13258.3020.0242.40255.86262.46
表2由不同升温速率下的DSC曲线计算出的动力学参数
Table2Kinetic parameters obtained by DSC curves at various heating rates
Note: a Subscript K is data obtained by Kissinger′s method, Subscript O is data obtained by Ozawa′s method.
exp(-1.774×105/RT)

图4AZTO·H2O在不同β下的Ea-α曲线
Fig.4Ea-αcurve of AZTO·H2O at different heating rates
3.3 AZTO·H2O的比热容的测定
采用Micro-DSC Ⅲ微热量仪连续比热容测定模式下对化合物进行比热容的测定,计算方程见式(5)[13]:
(5)
利用式(5)和运用仪器所带软件可以直接拟合出比热容随温度连续变化的方程式(6):
式中,Ab为空白实时热流,mW;As为样品实时热流,mW;β为升温速率,K·s-1;ms为样品质量,g;cp为比热容,J·g-1·K-1。
图5是AZTO·H2O比热容的测定结果,在所测温度范围内,比热容方程为:
cp= -98.3217+9.8315×10-1T-3.2378×10-3T2+
3.5528×10-6T3
式中,283.15 K≤T≤353.15 K。在常温298.15 K时,AZTO·H2O的摩尔热容为271.45 J·mol-1·K-1。
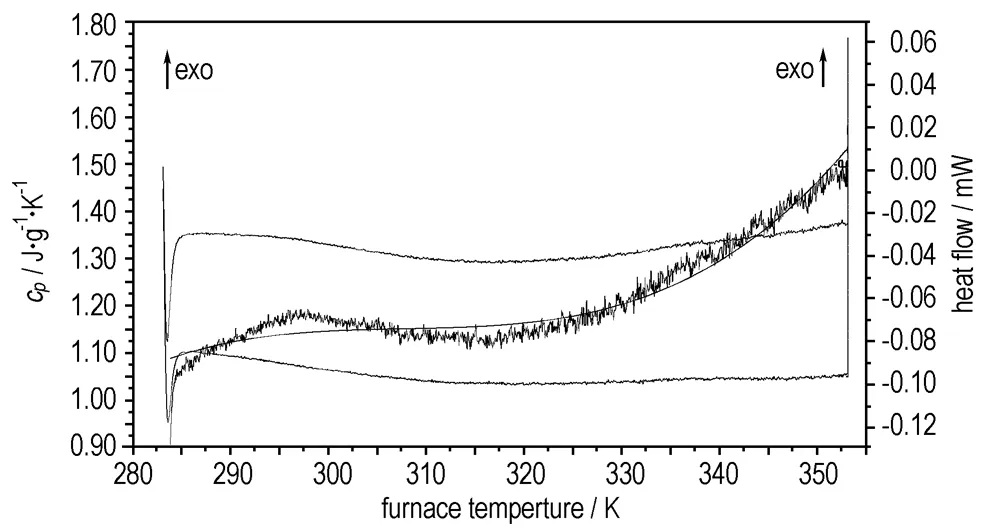
图5AZTO·H2O的连续比热容测定结果
Fig.5Determination results of the continuouscpof AZTO·H2O
3.4 AZTO·H2O的绝热至爆时间
在绝热条件下,由含能材料开始分解到爆炸需要的时间称为绝热至爆时间(t),也采用目标化合物的热分解过程中的临界加热速率(dT/dt)Tb来评价,计算公式如下[14-15]:
(8)
(9)
cp=a+bT+cT2+……
(10)
式中,T为绝对温度,K;t为绝热至爆时间,s;Q为热分解反应的放热量,J·g-1;A为指前因子,s-1;E为活化能,J·mol-1;f(α)为最概然机理函数、R为气体常数,8.314 J·mol-1·K-1。
整理式(8)~(10)得到绝热至爆时间的表达式为:
(11)
式中,积分的上、下限分别为热爆炸临界温度Tb和T00。
一般认为含能材料的最概然机理函数f(α)对绝热至爆时间估算产生的影响非常小。所以通常假设最概然机理函数f(α)为式(12):
f(α)=(1-α)n
(12)
式中,n为反应级数,含能材料的热分解反应级数n在0~2之间,取n=0,1,2。
结合前面的实验数据和式(8)~式(10)可以估算得到化合物AZTO·H2O的绝热至爆时间为72.8~74.7 s。
4 结 论
制备得到了4,4′-偶氮-1H-1,2,4-三唑-5-酮铵盐,通过DSC分析得到临界爆炸温度为233.1 ℃,比热容方程为:cp(283.15 K≤T≤353.15 K)=-98.3217+9.8315×10-1T-3.2378 ×10-3T2+3.5528×10-6T3,常温下的摩尔热容值为271.45 J·mol-1·K-1,绝热爆炸时间为72.8~74.7 s。描述AZTO·H2O放热分解反应的动力学方程为:
参考文献:
[1] 阳世清, 徐松林, 黄亨建, 等. 高氮化合物及其含能材料[J]. 化学进展, 2008,20(4) : 526-537.
YANG Shi-qing, XU Song-lin, HUANG Heng-jian, et al. High nitrogen compounds and their energy materials[J].ProgressinChemistry, 2008, 20(4): 526-537.
[2] 徐松林. 高能含能化合物的合成放大及其火炸药性能研究[D]. 长沙: 国防科技大学, 2005: 1-19.
XU Song-lin. Synthesis, scale-up of high nitrogen energetic compounds and study on the performance of high nitrogen-based[D]. Changsha: National University of Defense Technology, 2005: 1-19.
[3] 欧育湘, 刘进全. 高能量密度化合物[M]. 北京: 国防工业出版社, 2007, 26(6): 762-7.
OU Yu-xiang, LIU Jin-quan. High energetic density compounds[M]. Beijing: National Defense Tndustrial Press, 2007, 26(6): 762-7.
[4] 王文俊. 含能材料的进展与展望[J]. 固体火箭技术, 2003, 26(3): 42-48.
WANG Wen-jun. Advances and prospects of energetic material technologles[J].ChineseJournalofSolidRockerTechnology, 2003, 26(3): 42-48.
[5] 张建国, 张同来, 张志刚, 等. 唑类杂环化合物及其配合物的研究概述, 含能材料, 2001, 9(2): 90-93.
ZHANG Jian-guo, ZHANG Tong-lai, ZHANG Zhi-gang, et al. A review on azotic heterocyclic compounds and their coordination compounds[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2001, 9(2): 90-93.
[6] 张建国, 张同来. {[Ag(ATO)2]ClO4}n的合成、结构表征和热分解机理, 物理化学学报, 2000, 16(12): 1110-1114.
ZHANG Jian-guo, ZHANG Tong-lai. Synthesis, structural characterization and thermal decomposition mechanism of {[Ag(ATO)2]ClO4}n[J].ActaPhysico-ChimicaSinica, 2000, 16(12): 1110-1114.
[7] Kroeger C F, Hummel L, Mutscher M, et al. Syntheses and reaction of 4-amino-1, 2, 4-triazol-5-ones[J].BerichtederDeutschenChemischeGcsellschaft, 1965, 98(9): 3025-3031.
[8] Odenthal K K, Dusseldorf K M, Wuppertal L R. Preparation of 4-amino-1, 2, 4-triazol-5-ones: USP 5034 538[P], 1991.
[9] Dusseldorf K M, Odenthal K K, Dormagen P H. Preparation of 4-amino-1, 2, 4-triazol-5-ones: USP 4952 701[P], 1990.
[10] 张建国, 张同来. 4-氨基-1,2,4-三唑-5-酮的制备和快速分解过程研究[J]. 火炸药学报, 2001, 24(2): 19-21
ZHANG Jian-guo, ZHANG Tong-lai. Preparation and the flash pyrolysis of 4-amino-1,2,4-triazol-5-ones (ATO)[J].ChineseJournalofExplosivesandPropellants, 2001, 24(2): 19-21.
[11] Ozawa T B. A new method of analyzing thermogravimatric data[J].ChemSocJpn, 1965, 38: 1881-1886.
[12] Kissinger H E. Reaction kinetics in differential thermal analysis[J].AnalChem,1957, 29: 1702-1706.
[13] 徐抗震, 宋纪蓉, 赵凤起, 等. 1,1-二氨基-2,2-二硝基乙烯的比热容、热力学性质及绝热至爆时间研究[J].化学学报, 2007, 65(24): 2827-2831.
XU Kang-zhen, SONG Ji-rong, ZHAO Feng-qi, et al. Special heat capacity, thermodynamic properties and adiabatic time-to-explosion of 1,1-diamino-2,2-dinitroethylene[J].ActaChimicaSinica, 2007, 65 (24): 2827-2831.
[14] 胡荣祖, 张海, 夏志明, 等. 含能材料放热分解反应体系热爆炸的临界温升速率估算式[J]. 含能材料, 2003, 11(3): 130-133, 137.
HU Rong-zu, ZHANG Hai, XIA Zhi-ming, et al. Properties of smokeless cross-linked modified double base propellant[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2003,11(3): 130-133, 137.
[15] Smith L C. An approximate solution of the adiabatic explosion problem[J].ThermochimicaActa, 1975, 13(1): 1-6.
