1,1′-二羟基-5,5′-联四唑二羟胺盐及碱金属盐的合成、溶解度测定及关联
2015-05-10毕福强葛忠学
许 诚,毕福强,张 敏,葛忠学,朱 勇,刘 庆
(西安近代化学研究所,陕西 西安 710065)
1 引 言
1,1′-二羟基-5,5′-联四唑二羟胺盐(HATO)的晶体密度为1.877 g·cm-3,生成焓为446.6 kJ·mol-1,爆压大于HMX,稍低于CL-20,爆速大于CL-20,理论比冲高于RDX、HMX和CL-20,具有较高的能量水平[1]。HATO同时具有热稳定性好、机械感度低等优点,是一种综合性能优良的高能不敏感含能材料,目前受到含能材料领域的广泛关注[2]。通常,1,1′-二羟基-5,5′-联四唑的碱金属盐是利用复分解反应制备HATO的原料,同时1,1′-二羟基-5,5′-联四唑的碱金属盐也可用于气体发生剂,其中1,1′-二羟基-5,5′-联四唑二钾盐也是一种潜在的消焰剂。作为一类新型含能材料,不同1,1′-二羟基-5,5′-联四唑的碱金属盐与HATO溶解度及溶解热力学参数是应用研究的基础热力学数据。因此,1,1′-二羟基-5,5′-联四唑的碱金属盐与HATO的溶解度及溶解热力学对其应用研究具有重要的意义。
本研究合成了1,1′-二羟基-5,5′-联四唑的四种盐,并利用激光监测技术、采用动态法测定了不同温度下,HATO、1,1′-二羟基-5,5′-联四唑二锂盐(Li2DHBT)、1,1′-二羟基-5,5′-联四唑二钠盐(Na2DHBT)、1,1′-二羟基-5,5′-联四唑二钾盐(K2DHBT)在水中的溶解度(s),利用理想溶液模型[3]、Apelblat方程[4-6]对实验数据进行了关联,并对结果进行了分析。
2 实验部分
2.1 试剂与仪器
试剂:实验所用1,1′-二羟基-5,5′-联四唑(H2DHBT)为实验室根据文献[1,7]方法制得; LiOH、NaOH、KOH、盐酸羟胺、乙醇为分析纯; 实验用水为去离子二次蒸馏水。
仪器:德国Elementar公司Vario EL Ⅲ型元素分析仪; 美国Nicolet公司FTIR型红外光谱仪; 瑞士Bruker公司AV500型(500 MHz)超导核磁共振仪; 优莱博公司F12型恒温器; 西安赛朴林激光技术研究所TLX-B型激光仪、JD-1激光二极管组件参数测量仪。
2.2 合成实验
2.2.1 Li2DHBT的合成
合成路线见Scheme 1。

Scheme 1
向圆底烧瓶中加入206 mg H2DHBT和5 mL水,室温条件下搅拌,分批加入88 mg氢氧化锂,搅拌反应2 h后,经浓缩、过滤、乙醇洗涤、干燥得230 mg白色晶体,产率90.6%。13C NMR (125 MHz,DMSO-d6,δ):134.69; IR (KBr,ν/cm-1):3538,3311,1670,1434,1368,1243,1181,1064,1009,748,705,617,509,470; 元素分析 C2H8Li2N8O6(%):理论值:C 9.46,H 3.17,N 44.11; 实测值:C 9.13,H 3.13,N 44.27。
2.2.2 Na2DHBT的合成
合成路线见Scheme 2。
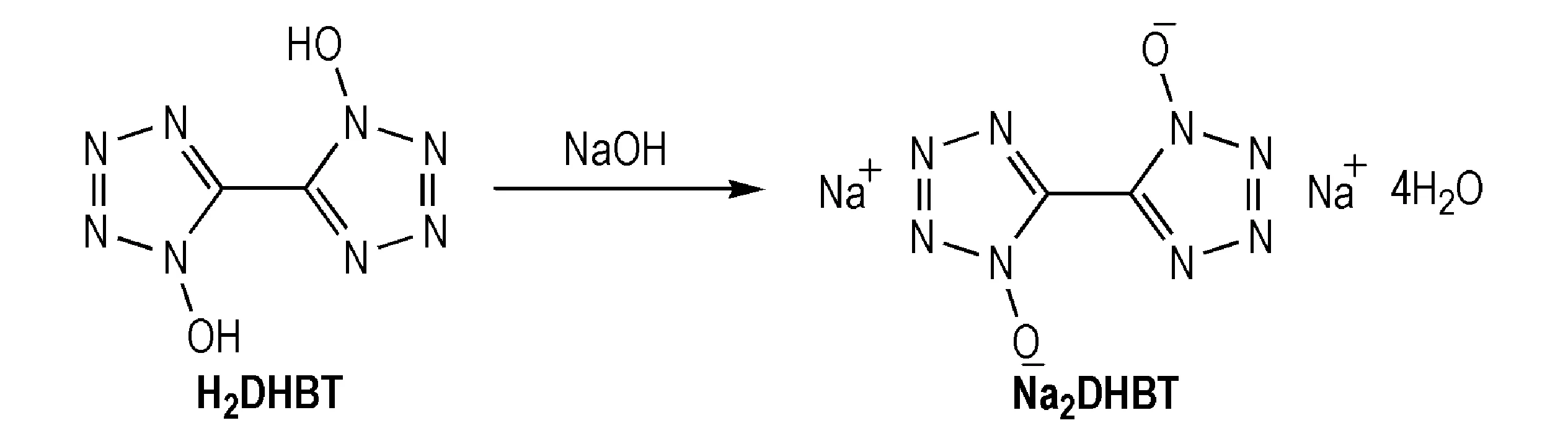
Scheme 2
向圆底烧瓶中加入206 mg H2DHBT和5 mL水,室温条件下搅拌,分批加入84 mg氢氧化钠,搅拌反应2 h后,经浓缩、过滤、乙醇洗涤、干燥得263 mg白色晶体,产率91.9%。13C NMR (125 MHz,DMSO-d6,δ):134.19; IR (KBr,ν/cm-1):3496,3404,3311,1673,1424,1359,1240,1178,1149,1067,1007,755,718,687,658,623,544,502。元素分析 C2H8Na2N8O6(%):理论值:C 8.40,H 2.82,N 39.16; 实测值:C 8.38,H 2.79,N 39.24。
2.2.3 K2DHBT的合成
合成路线见Scheme 3。

Scheme 3
向圆底烧瓶中加入206 mg H2DHBT和5 mL水,室温条件下搅拌,分批加入132 mg氢氧化钾,搅拌反应2 h后,经浓缩、过滤、乙醇洗涤、干燥得222 mg白色晶体,产率90.2%。13C NMR (125 MHz,DMSO-d6,δ):135.36; IR (KBr,ν/cm-1):1638,1510,1408,1356,1286,1233,1164,1058,998,805,732,715,502; 元素分析 C2K2N8O2(%):理论值:C 9.75,N 45.50; 实测值:C 9.71,N 46.10。
2.2.4 HATO的合成
合成路线见Scheme 4。

Scheme 4
向圆底烧瓶中加入206 mg H2DHBT和5 mL水,升至70 ℃,分批加入88 mg氢氧化锂,搅拌反应30 min,滴加含139 mg盐酸羟胺的水溶液5 mL,经浓缩、洗涤、过滤、干燥得223 mg白色晶体,产率94.1%。1H NMR(DMSO-d6,500 MHz):10.18(brs,8H);13C NMR (DMSO-d6,125 MHz):134.98; IR (KBr,ν/cm-1):3221,3084,2913,2682,2504,1578,1526,1427,1413,1351,1236,1172,1045,1011,997,814,716,674,499。元素分析 C2H8N10O4(%),计算值:C 10.17,H 3.41,N 59.31; 实测值:C 10.05,H 3.39,N 59.56。
2.3 溶解度测定
采用动态法对HATO、Li2DHBT、Na2DHBT、K2DHBT的溶解度进行测定,利用激光监测技术代替人眼观察固体的溶解情况,提高了测量的精度。具体实验装置及过程参照文献[8-9]方法进行。
为保证实验数据的准确,同样操作重复3次,取平均值。溶质在某温度下纯溶剂中的摩尔溶解度(x)可表示为:
(1)
式中,mA、mB分别表示溶质和溶剂的质量,g;MA、MB分别表示溶质和溶剂的分子量。
2.4 关联模型
为了更好地描述HATO、Li2DHBT、Na2DHBT、K2DHBT溶解度的变化规律,选用理想溶液模型[3]和Apelblat方程[4-6]对实验数据进行了关联。
(1)理想溶液模型
对于固液平衡体系,依据热力学原理[10],溶解度方程可表示为:
(2)
式中,γ为溶液中溶质的活度系数;R表示气体常数,8.3145 J·mol-1·K-1; ΔHtp为三相点时的熔化焓,J·mol-1;Ttp为三相点温度,K;Cp为定压摩尔热熔,J·mol-1·K-1; ΔV为体积差,m-3;p为体系的压力,Pa;ptp为三相点压力,Pa。
忽略影响较小的压力相和热容差相,并用熔点代替三相点温度,可得简化方程为:
(3)
式中,ΔHm为熔化焓,J·mol-1;Tm为熔点,K。
在远离临界区域的有限温度范围内真实溶液中组分的活度因子γ对温度的依赖程度较小,即γ对温度不敏感,近似为1。因此方程可以写为以下形式:
lnx=a+b/T
(4)
(2)Apelblat方程
(5)
式中,A,B和C为3个无因次参数。
其中,相对误差σ为:
(6)
平均相对误差ε为:
(7)
式中,n为实验点数。
(3)溶解热力学数据的计算方法[11]
根据Van′t Hoff方程[12]可知溶解度的对数值与温度呈线型关系:
(8)
式中,ΔHm为熔融焓,kJ·mol-1; ΔSm为熔融熵,kJ·mol-1·K-1;T表示绝对温度,K;R表示气体常数。
在实际应用中,常用混合热力学数据代替熔融热力学数据。用ΔHd代替ΔHm,用ΔSd代替ΔSm,所以方程可写为
(9)
此方程形式与理想溶液模型相同,因此可以利用理想溶液模型的拟合结果求得ΔHd和ΔSd。
3 结果与讨论
3.1 溶解度实验数据的测定结果
HATO、Li2DHBT、Na2DHBT、K2DHBT在水中的溶解度如表1所示。
表1 四种1,1′-二羟基-5,5′-联四唑盐的溶解度
Table 1 Solubilities of four kinds salts of 5,5′-bistetrazole-1,1′-diolate

HATOT/℃s/gLi2DHBTT/℃s/gNa2DHBTT/℃s/gK2DHBTT/℃s/g250.267251.222250.606201.226300.327301.418300.724301.668400.498402.144401.090452.152500.666503.026501.596502.379600.867603.791602.236603.142
由表1数据可知,HATO、Li2DHBT、Na2DHBT、K2DHBT在水中的溶解度均随着温度的升高而增加。在25~60 ℃范围内,HATO、Li2DHBT、Na2DHBT、K2DHBT的溶解度对温度的依赖程度不相同,Li2DHBT的溶解度对温度依赖性较高,即随温度变化,其溶解度变化最大,HATO的溶解度随温度的变化最小。
3.2 实验数据拟合结果
将HATO、Li2DHBT、Na2DHBT、K2DHBT理想溶液模型和Apelblat方程拟合参数及平均相对误差(ε)列于表2和表3中。
表2 理想溶液模型拟合结果
Table 2 Parameters of the ideal solution model for four kinds of salts of 5,5′-bistetrazole-1,1′-diolate
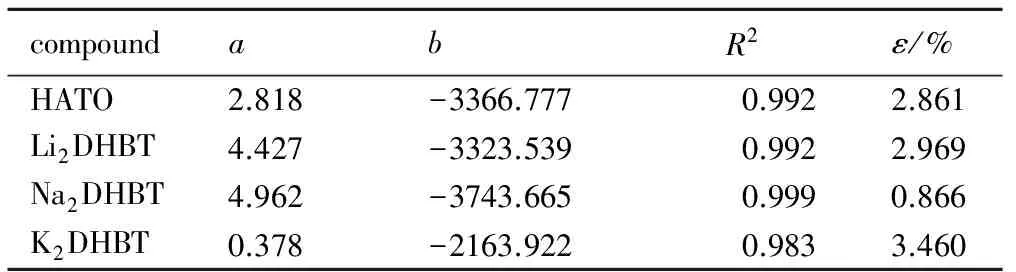
compoundabR2ε/%HATO2.818-3366.7770.9922.861Li2DHBT4.427-3323.5390.9922.969Na2DHBT4.962-3743.6650.9990.866K2DHBT0.378-2163.9220.9833.460
表3 Apelblat方程拟合结果
Table 3 Parameters of the Apelblat equation for four kinds of salts of 5,5′-bistetrazole-1,1′-diolate

compoundABCR2ε/%HATO266.499-15664.249-39.0440.9971.468Li2DHBT248.893-14719.184-36.2030.9942.108Na2DHBT-17.044-2717.8963.2590.9990.846K2DHBT-83.1851699.80912.3920.9763.234
从表2和表3的数据可知,选用理想溶液模型和Apelblat方程均能得到较好的拟合数据,相关系数均在0.97以上,平均相对误差在3.5%以内。但Apelblat方程的拟合精度要优于理想溶液模型,可用作处理及回归。根据Apelblat方程的拟合结果得到的溶解度曲线如图1所示。图1中曲线为Apelblat方程的拟合曲线,点为实验数据。

图1 四种1,1′-二羟基-5,5′-联四唑盐的溶解度曲线
Fig.1 Solubility curves of four kinds salts of 5,5′-bistetrazole-1,1′-diolate
由图1可以看出,Apelblat方程的拟合结果与实验数据具有较好的一致性。从溶解度曲线可以看出,当温度为33.2 ℃时,K2DHBT和Li2DHBT的溶解度相等。当温度小于33.2 ℃时,溶解度大小顺序为:K2DHBT>Li2DHBT>Na2DHBT>HATO; 当温度大于33.2 ℃时,溶解度大小顺序为:Li2DHBT>K2DHBT>Na2DHBT>HATO。
当温度为70 ℃时,由溶解度曲线可计算得到这三种碱金属溶液的摩尔溶解度分别为:xLi2DHBT=4.7×10-3,xNa2DHBT=2.6×10-3,xK2DHBT=2.8×10-3,Li2DHBT的摩尔溶解度最大。因此,当利用1,1′-二羟基-5,5′-联四唑的碱金属盐来制备HATO时,1,1′-二羟基-5,5′-联四唑二锂盐是最佳反应原料。
3.3 溶解热力学计算结果
溶解焓及溶解熵是化合物基本溶解热力学数据,本文根据理想方程拟合结果对HATO、Li2DHBT、Na2DHBT、K2DHBT的溶解焓与溶解熵进行了计算,计算结果如表4所示。
从表4中数据可以看出,HATO、Li2DHBT、Na2DHBT、K2DHBT在溶解过程中ΔHd均为正值,表明这四类盐的溶解过程需要消耗能量,为吸热过程,ΔSd为正值,表明这四类盐的溶解过程为不可逆过程。
表4 溶解热力学计算结果
Table 4 Thermodynamic parameters for dissolution of four kinds of salts of 5,5′-bistetrazole-1,1′-diolate

compoundΔHd/kJ·mol-1ΔSd/J·mol-1·K-1HATO27.99123.431Li2DHBT27.63236.807Na2DHBT31.12541.251K2DHBT17.9913.139
4 结 论
(1) 以H2DHBT为原料,分别与氢氧化锂、氢氧化钠、氢氧化钾反应得到Li2DHBT、Na2DHBT、K2DHBT,收率均大于90%。以Li2DHBT为原料,通过与盐酸羟胺的复分解反应制备得到1,1′-二羟基-5,5′-联四唑二羟胺盐(HATO),收率为94.1%。
(2) 采用动态法激光监测技术分别测定了HATO、Li2DHBT、Na2DHBT、K2DHBT的在不同温度下的溶解度。实验结果表明,这四种盐的溶解度均随温度的升高而增加。
(3) 理想溶液模型和Apelblat方程均能较好的关联实验数据,其拟合值与实验值的平均相对误差在3.5%以内,但Apelblat方程的溶解度数据的关联结果优于理想溶液模型。
(4) 通过van′t Hoff方程求得实验的溶解焓和溶解熵均为正值,表明HATO、Li2DHBT、Na2DHBT、K2DHBT在水中的溶解过程均为不可逆吸热过程。
参考文献:
[1] 毕福强,肖川,许诚,等.1,1′-二羟基-5,5′-联四唑羟胺盐的合成及性能[J].含能材料,2014,22(2):272-273.
Bi Fu-qiang,XIAO Chuan,XU Cheng,et al.Synthesis and properties of dihydroxylammonium 5,5′-bistetrazole-1,1′-diolate[J].ChineseJournalofEnergeticMaterials(HannengCailiao),2014,22(2):272-273.
[2] Niko Fischer,Dennis Fischer,Thomas M.Klapötke,et al.Pushing the limits of energetic materials - the synthesis and characterization of dihydroxylammonium 5,5′-bistetrazole-1,1′-diolate[J].JMaterChem,2012,22:20418-20422.
[3] 韩佳宾,王静康.咖啡因在水和乙醇中的溶解度及其关联[J].化工学报,2004,55(1):125-128.
HAN Jia-bin,WANG Jing-kang.Measurement and correlation of the solubility of caffeine in water and ethanol[J].Journalofchemicalindustryandengineering,2004,55(1):125-128.
[4] Apelblat A,Manzurola E.Solubilities of o-acetylsalicylic,4-aminosalicylic,3,5-dinitrosalicylic and,p-toluic acid,and magnesium-dl-aspartate in water fromT=(278 to 348)K[J].JChemTherm,1999,31(1):85-91.
[5] Apelblat A,Manzurola E.Solubilities of L-aspartic,dl-aspartic,dl-hydroxybenzoic,o-anisic,p-anisicm,and itaconic acids in water fromT=278K toT=345K[J].JChemTherm,1997,29(12):1527-1533.
[6] Manzurola E,Apelblat A.Solubilities of l-gluatamic acid,3-nitrobenzoic acid,p-toluic acid,calcium-l-lactate,calcium gluconate,magnesium-dl-aspartate,and magnesium-l-lactate in water[J].JChemTherm,2002,34(7):1127-1136.
[7] 毕福强,樊学忠,许诚,等.1,1′-二羟基-5,5′-联四唑的合成及理论研究[J].火炸药学报,2013,36(4):22-25.
BI Fu-qiang,FAN Xue-zhong,XU Cheng,et al.Synthesis and theoretical study of 1,1′-diolate-5,5′-bistetrazole[J].ChineseJournalofExplosives&Propellants,2013,36(4):22-25.
[8] 李群生,冯召东,赵宇,等.激光动态法测定DL-酒石酸有机溶剂中的溶解度[J].北京化工大学学报(自然科学版),2012,39(5):6-10.
LI Qun-sheng,FENG Zhao-dong,ZHAO Yu,et al.Measurement and correlation of the solubility of DL-tartaric acid in selected solvents using a laser monitoring technique[J].JournalofBeijingUniversityofChemicalTechnology(NaturalScience),2012,39(5):6-10.
[9] 朱勇,葛忠学,王伯周,等.RDX溶液固液平衡数据测定及模型研究[J].含能材料,2010,18(4):393-396.
ZHU Yong,GE Zhong-xue,WANG Bo-zhou,et al.Measurement of solid-Liquid equilibrium and its model for RDX solution[J].ChineseJournalofEnergeticMaterials(HannengCailiao) ,2010,18(4):393-396.
[10] Walas S M.化工相平衡[M].(韩世钧)译.北京:中国石化出版社,1991.
Walas S M.Phase Equilibrium in Chemical Engineering[M].Translated by HAN Shi- jun.Beijing:Chinese Petrochemical Press,1991.
[11] 李群生,赵宇,秦小勇,等.乌洛托品在有机溶剂中溶解度的测定与关联[J].北京化工大学学报(自然科学版),2012,39(3):24-28.
LI Qun-sheng,ZHAO Yu,QIN Xiao-yong,et al.Measurement and correlation of the solubility of hexamethylenetetramine in organic solvents[J].JournalofBeijingUniversityofChemicalTechnology(NaturalScience),2012,39(3):24-28.
[12] Bennema P,van Eupen J,Van der Wolf B M ,et al.Solubility of molecular crystals:Polymorphism in the light of solubility theory[J].InternationalJournalofPharmaceutics,2008,351(1/2):74-91.
