FeⅡ(EDTA)2-溶液吸收NO气体的传质-反应过程
2015-05-10刘有智袁志国祁贵生焦纬洲
王 菲,刘有智,袁志国,祁贵生,焦纬洲
(中北大学山西省超重力化工工程技术研究中心,山西 太原030051)
1 引 言
火炸药生产过程中排放的氮氧化物废气,具有氧化度高(NO2/NOx大)、排放浓度高的特点,目前主要采用湿法吸收技术对其进行治理[1-3]。但是,由于NOx吸收过程中产生的低浓度NO气体难以快速氧化,工业上需采用多级吸收塔串联的方式才能达到排放标准。由NO的氧化速率方程rNO2=kC[NO]2可知,其氧化速率与NO浓度密切相关,当NO浓度较低时,氧化速率很慢,而当NO浓度低于0.1% 时,氧化速率实际上已接近于0[4]。于是,国内外学者对NO的氧化吸收过程展开研究,主要集中在两个方向:(1)改变反应平衡,如增加系统压力[5-6];(2)提高反应速率常数k,即加入催化剂[7-9]或氧化剂如NaClO2[10]、H2O2[11]、KMnO4[12]等。然而,这些方法由于受到操作条件和吸收剂成本等问题的限制,在实际应用中存在一定的困难。
因此,有部分学者则从另一角度出发,采用过渡金属络合物吸收NO气体,NO可与过渡金属络合物发生配位反应而被直接吸收去除[13-15]。研究发现,在常温常压下,亚铁类络合物FeⅡ(EDTA)2-(Ethylene Diamine Tetraacetic Acid,EDTA)对NO的络合吸收,具有反应速率快,吸收容量大,且Fe2+对环境友好、不会造成二次污染等特点,被认为是具有工业化应用前景的NO吸收剂之一[16]。但是,目前NO络合反应的研究主要是对其本征动力学[17]、热力学[18]及反应产物[19]等方面进行探索,鲜见其在化学反应工程范畴的基础研究。基于此,本研究以FeⅡ(EDTA)2-为吸收剂,研究了其在鼓泡塔中吸收NO气体的传质-反应的过程,并且建立了该吸收过程的传质-反应模型,以期为工业化放大提供指导依据。
2 理论基础
2.1 反应原理
FeⅡ(EDTA)2-络合吸收NO的过程,主要是亚铁离子提供空轨道,EDTA配体提供孤对电子,NO和配体一起与亚铁离子形成混配配合物。由于NO具有孤对电子和反键π轨道,一方面,NO将N原子上的孤对电子给予中心原子的空轨道形成σ键; 另一方面,NO的反键π轨道与中心金属离子的d轨道重叠形成π键。这两方面的电子授受作用互相配合、互相促进,从而使NO可以和亚铁离子形成稳定的配合物[20]。反应如下:

2.2 NO吸收模型的建立
前人的研究结果表明[21],上述反应是正反应为二级(对NO和FeⅡ(EDTA)2-均为一级),逆反应为一级的快速可逆反应。由文献公开的FeⅡ(EDTA)2-吸收NO动力学数据可知,在本实验操作条件下,反应平衡常数k均为105~106[22],可近似认为该络合反应为不可逆反应。
根据动力学理论[23],上述反应的速率方程可以表示为:
(1)
已知,m、n分别为NO(A)和FeⅡ(EDTA)2-(B)的分反应级数,m=1,n=1。则(1)式简化为:
γA=k1CACB
(2)
式中,γA为NO(A)的反应速率,mol·L-1·s-1;k1为二级反应速率常数,L·mol-1·s-1;CA、CB分别为NO(A)、FeⅡ(EDTA)2-(B)的浓度,mol·L-1。
由于在实验过程中CB≫CA,因此在较短时间内,CB可以近似看作常数。吸收反应按拟一级反应处理,(2)式可进一步简化为:
γA=k2CA
(3)
式中,k2为NO(A)吸收过程的拟一级反应速率常数,s-1,k2=k1CB。
已知吸收液FeⅡ(EDTA)2-(B)对气体NO(A)的吸收是气-液两相间的传质过程,根据双膜理论[24],作液膜厚度为dx的微元液膜体积内A的物料平衡计算,建立传质-反应微分方程。
由物料平衡原理,得:
(4)
式中,DA,L为NO在FeⅡ(EDTA)2-溶液中的扩散系数,m2·s-1; dx为微元液膜厚度,m。
经简化,得:
(5)
(6)
已知NO的吸收为快速反应过程,NO在进入液相主体前已在液膜内被完全反应掉,则液相主体中NO的浓度CA,L为0。此时,有如下边界条件成立:
x=0,CA=CA,i;x=xL,CA=CA,L=0
根据此边界条件,对(4)式求解可得NO在液膜内的浓度分布曲线,并由Fick定律[25],得到NO的吸收速率方程:
(7)
(8)
式中,NA为NO的吸收速率,mol·m-2·s-1;kA,L为NO在FeⅡ(EDTA)2-中的液相传质系数,m·s-1;CA,i为NO的界面浓度,mol·L-1,可由(9)式计算得到:
(9)
式中,HA,L为NO在FeⅡ(EDTA)2-溶液中的溶解度系数,mol·Pa-1·L-1;pA,G为NO的气相分压,Pa;kA,G为NO的气相传质系数,mol·m-2·Pa-1·s-1。
联立(8)和(9),可得NO的吸收速率方程为:
(10)
3 实验部分
3.1 实验装置及流程
实验装置如图1所示。NO的吸收反应主要在鼓泡反应器中进行,反应器高320 mm,内径45 mm,底部装有气体分布器。在实验过程中,首先用N2吹扫反应装置及管路; 然后将配置好的吸收液置入鼓泡反应器中,采用恒温夹套加热至反应所需温度并维持恒定。从气体钢瓶出来的NO和N2,通过气体流量计控制气体流量,配成不同浓度的NO气体。混合气体通过缓冲瓶,经充分混合后,进入鼓泡反应器与吸收液发生反应,最后经出气口排出。反应器进出口NO浓度采用气体分析仪进行测定,测量后的气体经吸收净化后排入大气。
互动教学的模式是我国高中生物教学中比较有效的一种教学模式,包括了师生互动模式和生生互动模式,通过有效的沟通和交流,有利于课堂教学的开展,使学生在学习生物的过程中能够充分理解吸收课堂上老师讲解的新知识,发挥其学习的积极主动性与创造性。学生对于生物知识的认识更加深刻了,学生的学习劲头也上来了,对于生物的学习兴趣浓厚了,教学质量自然也就提高了。
3.2 吸收液的配置
实验过程所需的吸收液主要是FeⅡ(EDTA)2-,浓度为0.01~0.05 mol·L-1。FeⅡ(EDTA)2-溶液主要采用分析纯的硫酸亚铁(FeSO4·7H2O)和乙二胺四乙酸二钠(Na2EDTA)以1∶1的摩尔比配置。为了防止FeⅡ的氧化,吸收液在N2保护下采用脱气水配置到所需浓度。通过添加NaOH改变溶液的pH值,实验所用吸收液的pH值在7.0左右。

图1 实验流程图
1—NO钢瓶,2—N2钢瓶,3,4—气体流量计,5—气体缓冲罐,6—鼓泡反应器,7—恒温夹套,8—尾气吸收瓶,9—NO气体检测仪
Fig.1 Flow diagram of experimental set-up
1—NO gas cylinder,2—N2gas cylinder,3,4—gas meter,5—gas buffer tank,6—bubbling reactor,7—temperature jacket,8—tail gas absorption bottle,9—NO gas detector
3.3 分析方法
实验采用凯恩综合烟气分析仪(KM9106)测定进出口NO的浓度。该分析仪是基于化学手段对气体组分进行测定的,其原理是利用化学反应引起的离子量和电流变化,来对被测量气体成分进行分析。
NO的吸收效率η与吸收速率NA分别按式(11)与式(12)计算。
(11)
(12)
式中,η为吸收率,%;Cin、Cout分别为进出口NO浓度,mg·m-3;Q为气体流量,mL·min-1;MA为NO的相对分子质量;a为相界比表面积,m-1;V为吸收液体积,mL。
3.4 物性参数与传质参数测定
研究FeⅡ(EDTA)2-溶液吸收NO气体的气液传质及化学反应问题,需确定NO的物性参数及鼓泡反应器的传质系数。NO在溶液中的溶解度系数HA,L、液相扩散系数DA,L、气相扩散系数DA,G可由文献[26]或化工数据手册查得。NO的液相传质系数kA,L,气相传质系数kA,G以及气液比相界面积a,可用已知动力学参数的经典化学法结合Danckwerts[27]标绘理论进行测定。
4 结果与讨论
4.1 反应级数
4.1.1 FeⅡ(EDTA)2-溶液浓度对NO吸收速率的影响
实验温度为20℃,NO的初始浓度为268,562,725 mg·m-3时,考察FeⅡ(EDTA)2-溶液浓度(CB为0.01~0.05 mol·L-1)对吸收速率(NA)的影响,结果如图2所示。

图2 FeⅡ(EDTA)2-溶液浓度对吸收速率的影响
Fig.2 Effect of FeⅡ(EDTA)2-solution concentration on the absorption rate
从图2可以看出,NO吸收速率随FeⅡ(EDTA)2-溶液浓度的增大而增大。这是因为,当液相中FeⅡ(EDTA)2-浓度增大,则会使NO的吸收容量增大,并提高了吸收过程的传质推动力,从而使吸收速率加快。另外,从NO吸收速率方程(10)可知,NO吸收速率与拟一级反应速率常数k2有关,k2为二级反应速率常数k1与吸收液浓度CB的乘积,由Arrhenius定律可知,当反应温度确定时,k1为定值,k2随CB的增大而增大,NO吸收率随k2的增大而增大。
4.1.2 NO气体浓度对NO吸收速率的影响
实验温度为20℃,FeⅡ(EDTA)2-溶液的初始浓度为0.01,0.02,0.04 mol·L-1时,考察气体中NO浓度(CA为200~1400 mg·m-3)的改变对吸收速率(NA)的影响,结果如图4所示。
从图4可以看出,NO吸收速率随NO气相浓度的增大而增大。这是因为当NO浓度增大时,气相中NO的分压增大,化学吸收过程的传质推动力增大,NO的吸收速率加快。从NO吸收速率方程(10)亦可知,气相中NO的分压与NO吸收速率呈正相关,增大NO气相分压可以使吸收速率加快。

图3 NO吸收速率对吸收液浓度的对数图
Fig.3 A logarithmic diagram of NO absorption rate vs.absorption liquid concentration

图4 NO气体浓度对吸收速率的影响
Fig.4 Effect of NO concentration on the absorption rate
为了进一步确定NO浓度对吸收反应的影响,在不同的FeⅡ(EDTA)2-浓度下,分别对NO吸收速率与NO气液界面浓度取对数并作图,结果如图5所示。从图5中可以看出,在不同吸收液浓度条件下,lnNA
与lnCA,i近似为直线,线性相关系数均在0.99以上,且直线斜率均接近1。以上结果表明,NO吸收过程对于NO的界面浓度CA,i表现为拟一级反应。这与前述NO吸收速率方程(10)推导过程中,NO的吸收为拟一级反应的预测结果一致。
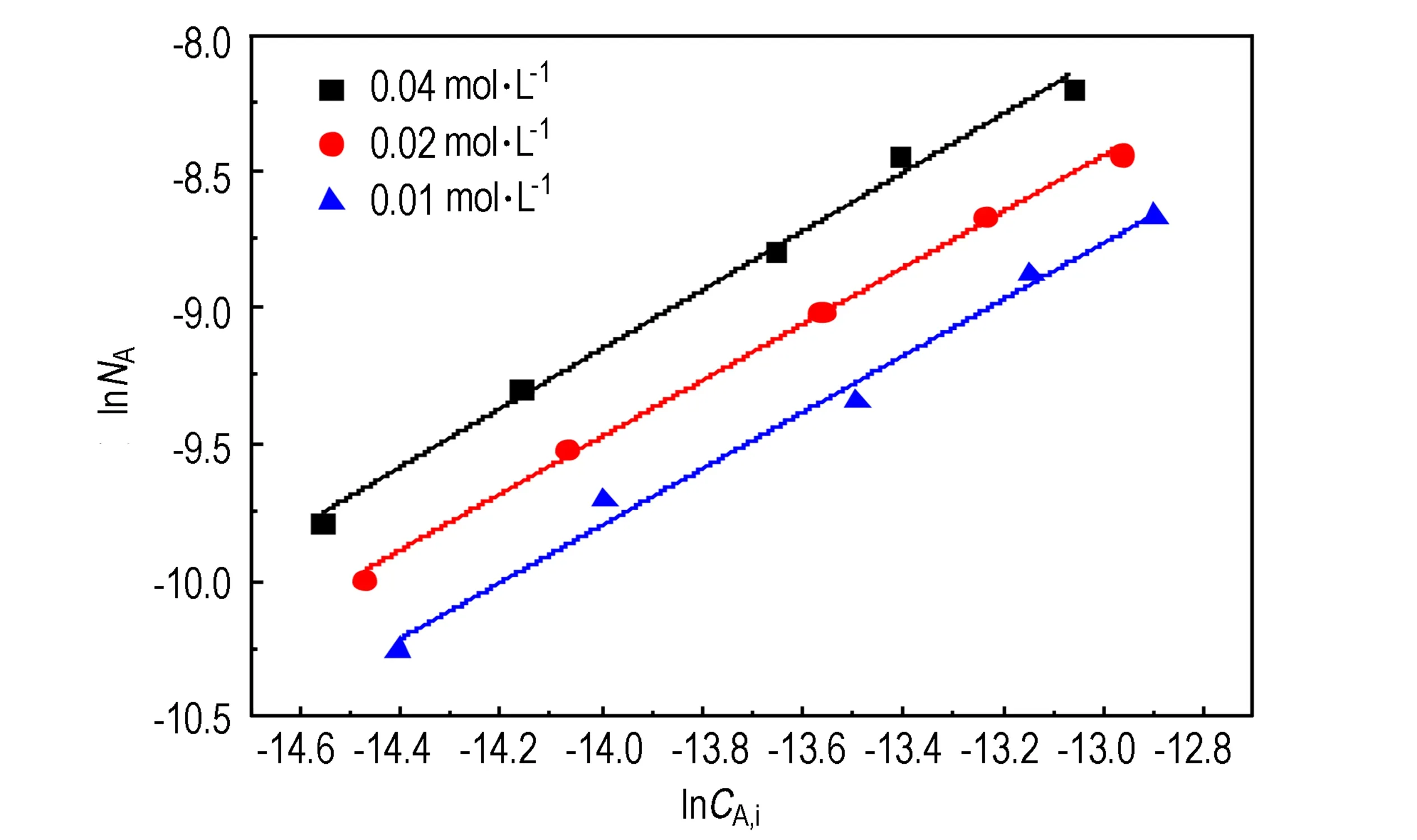
图5 NO吸收速率对NO界面浓度的对数图
Fig.5 A logarithmic diagram of NO absorption rate vs.NO interfacial concentration
4.2 反应动力学区域
在化学吸收过程中,常用八田数Ha(Hatt number)来衡量化学反应速率与传质速率的相对大小,通过Ha值可以判断反应所属的动力学区域。当Ha>3时,气体吸收属于快速反应。对于不同级数的反应,Ha的表达式不同。前述已验证了NO的吸收过程为拟一级反应,则Ha可由式(13)计算。
(13)
式中,k2为NO吸收过程的拟一级反应速率常数,s-1;DA,L为NO在FeⅡ(EDTA)2-溶液中的扩散系数,m2·s-1;kA,L为NO在FeⅡ(EDTA)2-中的液相传质系数,m·s-1。
确定实验操作条件为气体流量Q=2 L·min-1,吸收液体积V=200 mL,温度T=293 K。吸收体系的相关参数见表1。
在实验考察范围内,不同FeⅡ(EDTA)2-浓度和NO气相浓度条件下对应的Ha值,结果如图6所示。
表1 NO的物性参数及传质参数
Table 1 Physical parameters and mass transfer parameters of NO
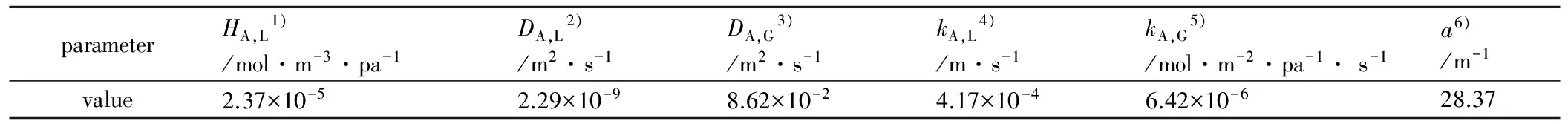
parameterHA,L1)/mol·m-3·pa-1DA,L2)/m2·s-1DA,G3)/m2·s-1kA,L4)/m·s-1kA,G5)/mol·m-2·pa-1·s-1a6)/m-1value2.37×10-52.29×10-98.62×10-24.17×10-46.42×10-628.37
Note:1) solubility coefficient; 2) liquid diffusion coefficient; 3) gas diffusion coefficient; 4) liquid phase mass transfer coefficient; 5) gas phase mass transfer coefficient; 6) gas-liquid contact area.

图6 不同条件下的Ha值
Fig.6Havalue under different conditions
由图6可知,在不同的FeⅡ(EDTA)2-浓度和不同NO气相浓度条件下,均有Ha≫3。结果表明,FeⅡ(EDTA)2-与NO的络合吸收属于快速反应。对于一个拟一级快速反应过程,化学反应速率远大于传质速率,气液扩散传质是络合吸收NO过程中的控制步骤,吸收速率主要受气液相传质系数、传质比表面积等影响。由吸收速率方程(11)可知,NO吸收速率与气相传质系数kA,G呈正相关,增大气相传质系数可以提高NO的吸收速率。另外,推导的方程为单位气液接触面的吸收速率,所以增大气液相界面积也可以提高NO的总吸收速率。因此,在后续NO络合吸收技术的研究中,采用气相传质系数大、气液接触面积大的反应设备更有利于低浓度NO的吸收。
4.3 吸收速率方程的验证
根据前述推导的NO吸收速率方程(10)可知,NO的吸收速率与NO气相浓度(分压)为线性关系。图7为NO吸收速率实验值与计算值随不同NO浓度的变化关系。
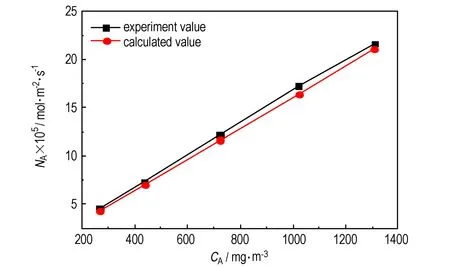
图7 NO吸收速率的实验值与计算值对比
Fig.7 Comparison of the experimental values and calculated values of NO absorption rate
从图7可看出,当NO浓度变化时,NO吸收速率的计算值均较实验值小,这可能是因为计算中采用的拟一级反应速率常数k2较实际值小,但两者均呈线性变化,且误差在5%以内。因此,NO吸收速率方程(10)可以用来描述NO吸收的传质-反应过程,并指导NO络合吸收反应器的选型与设计。
5 结 论
在本实验考察范围内,FeⅡ(EDTA)2-络合吸收NO的过程是一个拟一级快速反应过程。建立的吸收速率方程理论值与实验值一致,可以作为NO络合吸收反应器选型与设计的依据。
参考文献:
[1] 李鹏,刘有智,李裕,等.旋转填料床-氢氧化钠法治理火炸药行业的氮氧化物尾气的研究[J].含能材料,2007,15(3):277-280.
LI Peng,LIU You-zhi,LI Yu,et al.Research on treatment of nitrogen oxides in explosive industry by rotating packed bed with NaOH solution[J].ChineseJournalofEnergeticMaterials(HannengCailiao),2007,15(3):277-280.
[2] 顾永祥,谭天恩.氢氧化钠水溶液吸收氮化物传质-反应过程[J].高校化学工程学报,1990,4(2):157-166.
GU Yong-xiang,TAN Tian-en.Absorption by NaOH aqueous solution[J].JournalofChemicalEngineeringofChineseUniversities,1990,4(2):157-166.
[3] 于景阳,韩莉果,张卫江,等.规整填料塔吸收NOx过程的模拟和实验[J].天津大学学报,2005,38(9):780-785.
YU Jing-yang,HAN Li-guo,ZHANG Wei-jiang,et al.Simulation and experiment of NOxabsorption in structured packing columns[J].JournalofTianjinUniversity,2005,38(9):780-785.
[4] Hupen B,Kenig E Y.Rigorous modeling of NOxabsorption in tray and packed columns[J].ChemicalEngineeringScience,2005,60(22):6462-6471.
[5] 陈曦,李玉平,韩婕,等.加压条件下氮氧化物的水吸收研究[J].火炸药学报,2009,32(4):84-86.
CHEN Xi,LI Yu-ping,HAN Jie,et al.Study of pressurized absorption of nitrogen oxides in water[J].ChineseJournalofExplosivesandPropellant,2009,32(4):84-86.
[6] 景香顺,郑楠,迟正平,等.加压条件下稀硝酸吸收氮氧化物的实验研究[J].火炸药学报,2011,34(6):34-37.
JING Xiang-shun,ZHENG Nan,CHI Zheng-ping,et al.Experimental study on pressurized absorption of nitrogen oxides by dilute nitric acid[J].ChineseJournalofExplosivesandPropellant,2011,34(6):34-37.
[7] Jang B W L,Spivey J J,Kung M C,et al.Low-temperature NOxremoval for flue gas clean up[J].Energy&Fuels,1997,11(2):299-306.
[8] Adapa S,Gaur V,Verma N.Catalytic oxidation of NO by activated carbon fiber(ACF)[J].ChemicalEngineeringJournal,2006,116(1):25-37.
[9] Qi G S,Gatt J E,Yang R T,et al.Selective catalytic oxidation(SCO) of ammonia to nitrogen over Fe-exehanged zeolites Prepared by sublimation of FeCl3[J].JournalofCatalysis,2004,226(1):120-128.
[10] Chien T W,Chu H.Removal of SO2and NO from flue gas by wet scrubbing using an aqueous NaClO2solution[J].JournalofHazardousMaterials.2000,B80:43-57.
[11] LIU Yang-xian,ZHANG Jun.Photochemical oxidation removal of NO and SO2from simulated flue gas of coal-fired power plants by wet scrubbing using UV/H2O2advanced oxidation process[J].Industrial&EngineeringChemistryResearch,2011,50:3836-3841.
[12] Chu B Y,Chien T W,Li S Y.Simultaneous absorption of SO2and NO from flue gas with KMnO4/NaOH solution[J].ScienceoftheTotalEnvironment,2001,275:127-135.
[13] Weisweiler W,Blumhofer R,Estermann W T.Absorption of nitrogen monoxide in aqueous solutions containing sulfite and transition-metal chelates such as Fe(Ⅱ)-EDTA,Fe(Ⅱ)-NTA,Co(Ⅱ)-Trien and Co(Ⅱ)-Treten[J].ChemicalEngineeringandProcessing,1986,20:155-166.
[14] Chien T W,Hsueh H T,Chu B Y,et al.Absorption kinetics of NO from simulated flue gas using Fe(Ⅱ)EDTA solutions[J].ProcessSafetyandEnvironmentalProtection,2009,87:300-306.
[15] Sada E,Kumazawa H,Hikosaka H.A Kinetic study of absorption of nitrogen oxide(NO) into aqueous solutions of sodium sulfite with added iron(Ⅱ)-EDTA chelate[J].Industrial&EngineeringChemistryResearch,1986,25(3):386-390.
[16] ZHANG Liang-liang,WANG Jie-xin,SUN Qian,et al.Removal of nitric oxide in rotating packed bed by ferrous chelate solution[J].ChemicalEngineeringJournal,2012,181:624-629.
[17] Pham E K,Chang S G.Removal of NO from flue gases by absorption to an Iron(Ⅱ) thiochelate complex and subsequent reduction to ammonia[J].Nature,1994,369:139-141.
[18] Littlejohn D,Chang S G .Kinetics study of ferrous nitrosyl complexes[J].JournalofPhysicalChemistry,1982,86:537-540.
[19] Shi Y,Littlejohn D,Chang S G.Kinetics of NO absorption in aqueous iron(Ⅱ)bis(2,3-dimer-capto-1-propanesulfonate) solution using a stirred reactor.IndustrialandEngineeringChemistryResearch,1996,35(5):1668-1672.
[20] 王莉,赵伟荣,吴忠标.金属络合吸收剂在湿法脱硝中的应用[J].环境工程学报2007,1(2):88-93.
WANG Li,ZHAO Wei-rong,WU Zhong-biao.Application of metal complexes absorption in wet NOx absorption system[J].JournalofEnvironmentalEngineering,2007,1(2):88-93.
[21] Hishinuma Y,Kaji R.Reversible binding of NO to Fe(Ⅱ) EDTA[J].BulletinofChemicalSocietyJapan.1979,52(10):2863-2865.
[22] Demmink J F,Beenackers A A C M.Absorption of nitric oxide into aqueous solutions of ferrous chelates accompanied by instantaneous reaction[J].Industrial&EngineeringChemistryResearch.1997,36:4914-4927.
[23] 许越.化学反应动力学[M].北京:化学工业出版社,2005.
XU Yue.Chemical reaction kinetics[M].Beijing:Chemical Industry Press,2005.
[24] 叶庆国.分离工程[M].北京:化学工业出版社,2009:134-139.
YE Qing-guo.Separation Engineering[M].Beijing:Chemical Industry Press,2009:134-139.
[25] 钟秦,陈迁乔,王娟,等.化工原理[M].北京:国防工业出版社,2009:267-280.
ZHONG Qin,CHEN Qian-qiao,WANG Juan,et al.The principle of Chemical Engineering[M].Beijing:National Defence Industry Press,2009:267-280.
[26] Gambardella F,Alberts M S,Winkelman J G.Emperimental and modeling studies on the absorption of NO in aqueous ferrous EDTA solutions[J].Industrial&EngineeringChemistryResearch,2005,44:4234-4242.
[27] YE Qun-feng.Gasous mercury absorption from simulated flue gas[D].Hangzhou:Zhejiang University,2006:42-58.
