大丽轮枝菌(Verticillium dahliae)微菌核缺陷突变体的筛选及其侧端序列分析
2015-05-10李洪连谷素静马宗斌
汪 敏,赵 静,李洪连,谷素静,马宗斌,焦 睿
(1.河南农业大学植物保护学院,河南郑州450002;2.河南农业大学农学院,河南郑州450002;3.河南农业大学生命科学学院,河南郑州450002)
棉花黄萎病(Verticillium wilt of cotton)是一种土传性的维管束真菌病害。该病害不仅造成棉花严重减产,而且影响纤维长度和强度,是制约棉花优质高产的关键因素[1,2]。中国引起棉花黄萎病的病原菌主要为大丽轮枝菌(Verticillium dahliae)[3-5],该病菌寄主范围极为广泛,可侵染 200 多种植物,而且具有传播途径多、防治难度大的特点,常常造成严重的经济损失[5]。微菌核是大丽轮枝菌的主要存活结构和初侵染源,其形成数量与存活情况直接影响棉花黄萎病的发生程度[6,7]。微菌核是由大丽轮枝菌单根或多根菌丝经分隔膨大、细胞壁增厚和多向芽殖形成的多细胞结构,内外层细胞的细胞壁均较厚,积累有大量的黑色素,能抵抗不良环境条件,在土壤中可存活10~15 a。在适宜条件下,微菌核受寄主根系分泌物的刺激萌发后,从植株根部侵入,并在根内定殖和扩展[7]。有研究表明,大丽轮枝菌的VDH1和VMK1基因与微菌核的形成密切相关[8-10]。但目前有关其微菌核形成相关基因的研究报道不多,微菌核形的分子机理尚不清楚。本研究利用农杆菌介导转化(Agrobacterium tumefaciens-mediated transformation,ATMT)获得大丽轮枝菌T-DNA插入突变体,从中筛选TDNA插入微菌核形成能力丧失(或减弱)的突变体,并利用高效 TAIL-PCR方法扩增其侧端序列,以期为大丽轮枝菌微菌核形成的相关基因克隆与分子机理研究等奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及棉花品种 用于农杆菌介导转化的大丽轮枝菌菌株为落叶型强致病力菌株FGH2,由河南农业大学植物病理实验室分离并保存[11]。大肠杆菌DH5α、农杆菌介导转化载体pATMT1(由pCAMBIA 1300改造而成)、农杆菌菌株 AGL-1均由河南农业大学植物病理实验室保存。大丽轮枝菌致病力测定所用的棉花品种为感黃萎病品种银山1号。
1.1.2 主要试剂和仪器 Ex Taq酶、dNTP和限制性内切酶、pMD19-T Vector、DNA Marker购自宝生物工程(大连)有限公司,乙酰丁香酮、卡那霉素(Kan)购自美国Sigma公司,潮霉素B购自德国Roche公司。
1.2 方法
1.2.1 大丽轮枝菌T-DNA插入突变体库的构建利用农杆菌介导转化构建大丽轮枝菌T-DNA插入突变体库,参照 MULLINS等[12]的方法,并略有改进[11,13]。采用冻融法将构建的载体 pATMT1转化到农杆菌AGL-1中,将诱导的农杆菌菌液与大丽轮枝菌分生孢子悬浮液涂在滤膜上共培养,5~7 d后挑取阳性转化子转接至含有潮霉素的PDA平板上,进行2次筛选,对阳性转化子单孢分离并保存,获得大丽轮枝菌T-DNA插入突变体库。
1.2.2 大丽轮枝菌微菌核形成缺陷的T-DNA突变体筛选 将待测的T-DNA插入突变体和野生菌FGH2分别接种于PDA培养基平板上,暗培养10 d后,用直径0.7 cm的打孔器在菌落的边缘处选取菌饼,置于PDA平板中心,每皿1块,暗培养15 d后对其进行菌落形态的观察和分类。
根据突变体的菌落形态和黑色微菌核的有无将其分为菌核型、菌丝型和中间型3种类型[14]。分类标准如下:菌落表面为白色气生菌丝团、基质内布满黑色微菌核的为菌核型;菌落上气生菌丝少、产生少量黑色微菌核的为中间型;菌落上气生菌丝发达、白色、绒毛状,培养15 d后仍未产生黑色微菌核的为菌丝型。
1.2.3 大丽轮枝菌T-DNA插入突变体的致病力测定 大丽轮枝菌T-DNA插入突变体的致病力测定采用分生孢子浸根移栽法[11]。将供试的银山1号棉种脱绒催芽,在温室中进行育苗。收集待测的大丽轮枝菌T-DNA插入突变体和大丽轮枝菌FGH2分生孢子悬浮液,调节其体积分数为1.0×107个·mL-1。待棉苗长至 2片真叶时,挑选根系生长良好的植株进行浸根接种后,移栽至装有无菌土的纸杯中,25℃下生长。每个菌株接种15棵棉苗,3次重复。30 d左右时接种30 d后,按照石磊岩等棉花苗期分级标准进行病情调查[15]。
1.2.4 大丽轮枝菌微菌核形成缺陷的T-DNA插入突变体侧端序列扩增 挑选大丽轮枝菌T-DNA插入菌丝型突变体和大丽轮枝菌FGH2于Czapek液体培养基中,150 r·min-1培养 6 d,收集菌丝用于DNA提取。采用CTAB法提取菌株的基因组DNA。采用TAIL-PCR法扩增突变体T-DNA插入位点侧端序列,试验参照 LIU等[16]的方法进行。所用随机引物序列和特异性引物序列见表1。将初始PCR产物稀释20倍作为第2轮PCR的模板,第2轮PCR产物稀释10倍作为第3轮PCR的模板。
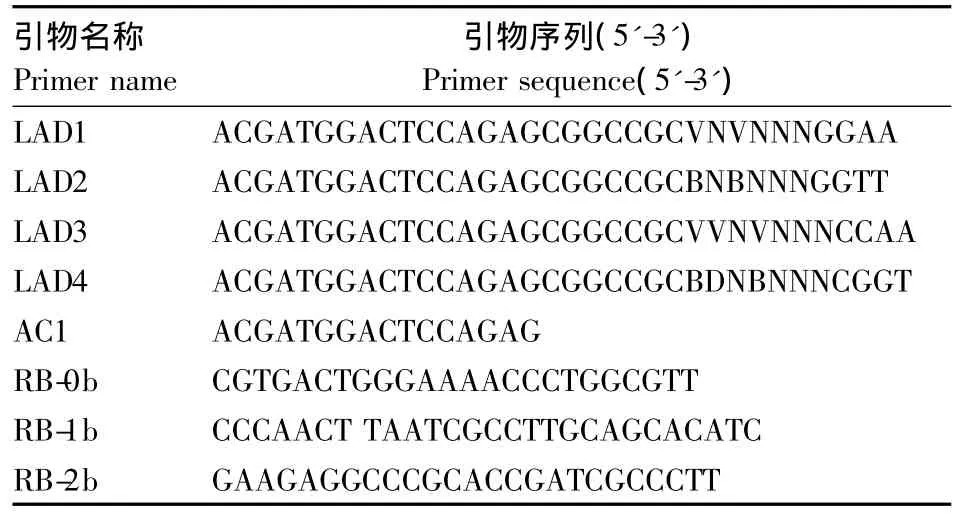
表1 hiTAIL-PCR扩增引物Table 1 Primers list used for hiTAIL-PCR
1.2.5 PCR产物连接、测序和序列分析 将第3轮PCR产物胶回收后与pMD19-T载体连接,转化到大肠杆菌DH5α感受态中,挑选阳性克隆进行测序。获得的突变体T-DNA插入位点右侧序列与美国 BROAD 研 究 网 址 (http://www.broad.mit.edu/)公布的大丽轮枝菌VDLs.17和黑白轮枝菌(V.albo-atrum)VaMs.102的基因组序列进行比对分析。
2 结果与分析
2.1 农杆菌介导大丽轮枝菌的遗传转化
利用农杆菌介导构建大丽轮枝菌T-DNA插入突变体库。将诱导的农杆菌菌液与大丽轮枝菌分生孢子悬浮液涂在滤膜上共培养48 h,将滤膜置于含50 mg·L-1潮霉素抗性的PDA培养基生长上。将选择培养基上长出的阳性转化子再转接到含70 mg·L-1潮霉素PDA培养基上进行2次筛选。对阳性转化子进行单孢分离和保存,共获得了270个大丽轮枝菌T-DNA插入转化子。
2.2 大丽轮枝菌微菌核形成能力丧失或减弱的T-DNA插入突变体的筛选
将获得的270个T-DNA插入突变体和野生型大丽轮枝菌FGH2活化后,接于PDA培养基中,25℃下生长15 d,测量菌落直径并观察微菌核形成情况。野生型大丽轮枝菌FGH2在PDA培养基上25℃恒温培养时产生大量微菌核,气生菌丝较为发达。突变体11-2、26-2、229-2-1、971-1 均为菌丝型,菌落气生菌丝浓密,且不产生微菌核(图1)。

图1 野生型FGH2和突变体在PDA平板上培养15d后菌落形态(正、反面)Fig.1 The colony morphology of FGH2and mutants grown on PDA plate for 15 days(the front and the back)
2.3 大丽轮枝菌T-DNA插入突变体的致病力测定
对270个大丽轮枝菌T-DNA插入突变体和野生型菌株进行孢子悬浮液浸根接种,测定突变体与野生型的致病性差异。结果表明,大丽轮枝菌FGH2接种感病品种银山1号14 d左右叶片开始发病,30 d左右棉苗表现为落叶、死亡,维管束变褐,病情指数达95.21。大多数大丽轮枝菌T-DNA插入突变体的致病力与野生型无显著性差异(图2)。

图2 大丽轮枝菌突变体接种棉花银山1号30 d后发病情况Fig.2 Pathogenicity assays of V.dahliae FGH2 and four microsclerotia defective mutants on cotton Yinshan 1 post inoculation 30 days
2.4 大丽轮枝菌微菌核形成能力丧失T-DNA插入突变体侧端序列分析
采用高效TAIL-PCR方法对大丽轮枝菌4个菌丝型T-DNA插入突变体的插入位点侧端序列进行扩增,将第二轮和第三轮的扩增的PCR产物进行凝胶电泳图谱分析,对第二、三轮的条带大小做比较,理论上第三轮的条带比第二轮小约70 bp,为本研究所需要的特异性条带,将这4个突变体的第三轮全部产物进行凝胶电泳,进行切胶回收,得到突变体 11-2(A)、26-2(B)、229-2-1(C)和 971-1(D)含量较高的4条特异性条带(图3),获得目标片段片段大小分别约为 600、350、300、500 bp。
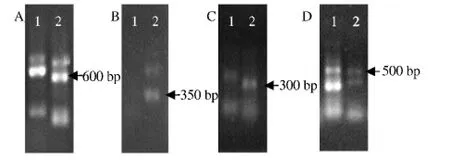
图3 大丽轮枝菌突变体T-DNA侧翼序列hiTAILPCR第二步和第三步产物琼脂糖凝胶电泳Fig.3 Agarose gel electrophoresis patterns of V.dahliae mutants T-DNA flanking sequence secondary and tertiary hiTAIL-PCR products.
对目标片段回收后与pMD19-T载体连接,转入大肠杆菌克隆,挑选阳性转化子送生物公司进行DNA测序。将获得的大丽轮枝菌突变体T-DNA侧端序列与已在网上公布的大丽轮枝菌VDLs.17和黑白轮枝菌VaMs.102进行比对,获得突变体T-DNA在大丽轮枝菌基因组插入位点的信息(表2)。突变体229-2-1 T-DNA插入位点位于基因VDAG_08333.1编码区,突变体11-2T-DNA插入位点位于基因VDAG_07013.1启动子区969 bp,26-2 T-DNA插入位点位于基因VDAG_02793.1启动子区716 bp,而突变体971-1 T-DNA插入位点位于 2个基因 VDAG_05438.1和 VDAG_05439.1 之间。
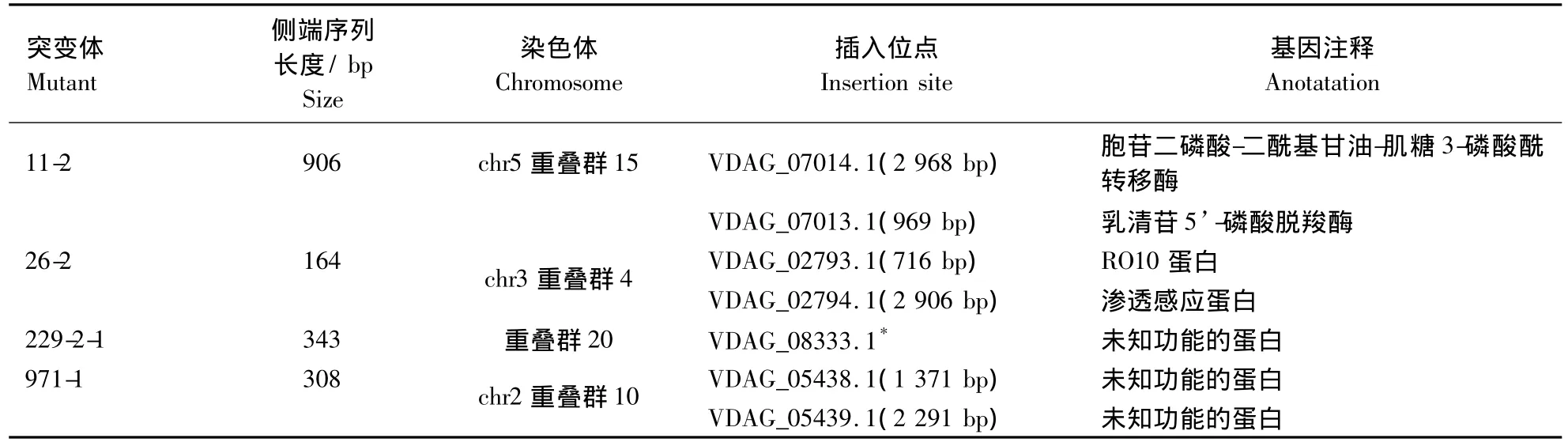
表2 T-DNA侧翼序列与 VdLs.17基因组序列比对结果Table 2 BLAST results of T-DNAflanking sequences hit to VdLs.17 genome
3 结论与讨论
随着多种植物病原真菌全基因序列的完成,利用农杆菌介导转化技术构建覆盖全基因组的T-DNA插入突变体库,从全基因组水平研究植物病原真菌重要功能基因,进而鉴定关键的致病基因,已成为重要研究方向和研究方法[17-20]。本研究利用ATMT技术构建大丽轮枝菌T-DNA插入突变体库,获得了270个突变体,通过菌落形态观察,筛选出4个菌丝型突变体,气生菌丝发达、白色绒毛状,在长期培养和多代转接后,仍不产生黑色微菌核,并得到了其侧端序列。其中突变体229-2-1 T-DNA插入位点位于基因VDAG_08333.1编码区,突变体11-2,26-2 T-DNA插入位点分别位于基因VDAG_07013.1和VDAG_02793.1的启动子区,而突变体971-1 T-DNA插入位点位于VDAG_05438.1和VDAG_05439.1 2个基因之间。推测这4个菌丝型突变体的表型变异可能由于T-DNA插入突变引起,为进一步研究这些微菌核形成相关基因奠定了基础。
大丽轮枝菌产生由黑色素和菌丝细胞构成的微菌核,在遇到不利环境时黑色素颗粒可使微菌核进入休眠状态,以抵抗不同的环境压力条件,有利于微菌核的长期存活。已有研究表明,黑色素为稻瘟病菌(Magnaporthe grisea)致病所必需的,稻瘟病菌黑色素形成丧失的突变体不能形成有功能的附着胞,从而丧失对水稻的致病性[21]。目前尚无研究表明,黑色素与大丽轮枝菌微菌核的形成与致病性的关系。本研究获得的4个大丽轮枝菌菌丝型突变体,黑色素形成丧失且不产生微菌核,但这4个菌丝型突变体的致病力与大丽轮枝菌FGH2并无显著性差异。由于本研究获得返微菌核缺失突变体偏少,有必要进一步利用已建立的突变体库,大量筛选微菌核形成能力减弱和丧失的突变体,在获得其侧端序列后,采用目标基因敲除和互补等手段,大规模鉴定微菌核形成相关基因。在此基础上,深入研究大丽轮枝菌微菌核形成的分子机理,探讨菌微菌核形成、黑色素与致病性的关系等。
[1] ERDOGAN O,SEZENER V,OZBEK N,et al.The effects ofVerticillium wilt(Verticillium dahliae Kleb.)on cotton yield and fiber quality[J].Asian Journal of Plant Sciences,2006,5(5):867 -870.
[2] FRADIN E F,THOMMA B H.Physiology and molecular aspects of Verticillium wilt diseases caused by V.dahliae and V.alboatrum[J].Molecular Plant Pathology,2006,7(2):71 -86.
[3] 汪 敏,焦 睿,邢小萍,等.棉花黄萎病菌致病的分子机理[J].棉花学报,2011,23(3):272 -278.
[4] 朱荷琴,冯自力,李志芳,等.分离自棉花的轮枝菌“种”的鉴定[J].中国农业科学,2013,46(10):2032-2040.
[5] 朱荷琴,冯自力,尹志新,等.我国棉花黄萎病菌致病力分化及ISSR指纹分析[J].植物病理学报,2012,42(3):225-235.
[6] WILHELM S.Longevity of Verticillium wilt fungus in the laboratory and field[J].Phytopathology,1955,45:180-181.
[7] 李雪铃,张天宇,王立新.棉黄萎病菌微菌核研究进展[J].植物保护,1997,23(5)35 -37.
[8] RAUYAREE P,OSPINA-GIRALDO M D,KANG S,et al.Mutations in VMK1,a mitogen-activated protein kinase gene,affect microsclerotia formation and pathogenicity in Verticillium dahliae[J].Current genetics,2005,48(2):109 -116.
[9] KLIMES A,DOBINSON K F.A hydrophobin gene,VDH1,is involved in microsclerotial development and spore viability in the plant pathogen Verticillium dahliae[J].Fungal Genetics and Biology,2006,43:283-294.
[10] KLIMES A,AMYOAE S,GRANT S,et al.Microsclerotia development in Verticillium dahliae:regulation and differential expression of the hydrophobin gene VDH1[J].Fungal Genetics Biology,2008,45:1525 -1532.
[11]谷素静,汪 敏,桑 茜,等.棉花黄萎病菌T-DNA插入突变体库的构建及致病缺陷突变体筛选[J].河南农业科学,2014,43(1):69 -73,83.
[12] MULLINS E D,CHEN X,ROMAINE P,et al.Agrobacterium tumefaciens-mediated transformation of Fusarium oxyporum:an efficient tool for insertional mutagenesis and genetransfer[J].Phytopathology,2001,91:173-180.
[13]桑 茜,袁虹霞,王振跃,等.河南省不同地区棉花黄萎病菌分离物致病性及其毒素致萎活性测定[J].棉花学报,2010,22(4):333 -338.
[14]宋晓轩,朱荷琴,郭金城.棉花黄萎病菌(Verticillium dahliae Kleb.)安阳菌系致病力分化研究[J].中国农业科学,1997,30(1):13 -18.
[15]石磊岩,王 波,文 学.我国棉花黄萎病菌类型分化及培养特性研究[J].植物保护学报,1993,20(3):247-252.
[16] LIU Y G,CHEN Y L.High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J].BioTechniques,2007,43(5):649 - 656.
[17] BETTS M F,TUCKER S L,GALADIMA N,et al.Development of a high throughput transformation system for insertional mutagenesis in Magnaporthe oryzae[J].Fungal Genetics and Biology,2007,44(10):1035 -1049.
[18] JEON J,PARK S Y,CHI M H,et al.Genome-wide functional analysis of pathogenicity genes in the rice blast fungus[J].Nature Genetics,2007,39(4):561 -565.
[19]徐荣旗,汪佳妮,陈捷胤,等.棉花黄萎病菌T-DNA插入突变体表型特征和侧翼序列分析[J].中国农业科学,2010,43(3):489 -496.
[20]高峰,彭 姗,彭晓玲,等.棉花黄萎病菌插入突变体库的构建及致病相关基因DVK1的克隆与鉴定[J].棉花学报,2011,23(1):64 -68.
[21] HOWARD R J,VALENT B.Breaking and entering:host penetration by the fungal rice blast pathogen Magnaporthe grisea[J].Annual Review of Microbiology,1996,50:491-512.
