慢病毒介导ACTHR过表达对人肾上腺皮质癌H295R细胞的增殖影响
2015-05-10胡东亮刘同族王行环
胡东亮,刘同族,倪 栋,王行环
(武汉大学中南医院泌尿外科,武汉 430071)
·基础研究·
慢病毒介导ACTHR过表达对人肾上腺皮质癌H295R细胞的增殖影响
胡东亮,刘同族,倪 栋,王行环
(武汉大学中南医院泌尿外科,武汉 430071)
目的 研究ACTHR高表达对人肾上腺皮质癌H295R细胞的影响,并探讨ACTHR在肾上腺肿瘤发病中的作用。方法 用慢病毒包装的ACTHR高表达载体感染H295R细胞作为实验组,同时设立对照组。用WST-1法及细胞计数法检测感染后细胞的增殖情况,感染48 h后TUNEL法检测细胞的凋亡情况。结果 WST-1增殖检测发现实验组细胞增殖活性呈双重变化趋势,在前3天内增殖活性高于对照组细胞,尤其是第2天达到顶峰,但第4天后增殖活性低于对照组细胞;细胞计数法显示在增殖活性最高时,实验组和对照组细胞分别为(5.3±0.21) ×103和 (3.8±0.24) ×103个,两组细胞计数结果对比具有统计学意义(P<0.05);而TUNEL结果显示荧光镜下两组细胞的凋亡情况无明显差异(P>0.05)。结论 ACTHR对肾上腺肿瘤的影响具有时间依赖性,但可能主要以促进细胞增殖为主,而对凋亡影响不明显。
人促肾上腺皮质激素受体;H295R细胞;肾上腺肿瘤;增殖;凋亡
人促肾上腺皮质激素受体(adrenocorti cotrophic hormone receptor, ACTHR)主要分布于肾上腺皮质,肾上腺髓质中鲜有报道。以往对ACTHR的认识主要集中在其对皮质醇激素的调节上,而关于ACTHR在肾上腺肿瘤中的研究较少。近年来相关文献显示ACTH对肾上腺的生长发育和状态维持发挥重要作用[1],甚至是促进肾上腺皮质细胞增殖的诱导剂,而这一效应依赖于其受体ACTHR。目前为止,关于ACTHR与肾上腺肿瘤发病机制的报道比较少见,仅有的报道集中在组织水平的检测上,缺乏细胞水平研究。为此,我们应用人肾上腺皮质癌H295R细胞,研究ACTHR高表达对其增殖影响,进而探讨ACTHR在肾上腺肿瘤成瘤机制中的作用。
1 材料与方法
1.1 材料 H295R细胞购自美国ATCC;DMEM/F12培养基购自美国Invitrogen公司;Nu serum血清购自美国BD公司;ITS+1购自美国Sigma公司;ACTHR高表达通过慢病毒载体感染细胞实现(深圳Biowit公司);WST-1细胞增殖检测试剂盒和TUNEL凋亡检测试剂盒均购自江苏碧云天公司。cDNA合成试剂盒及荧光定量PCR SYBR Green I试剂盒(Fermentas公司);AxyPrep总RNA小量制备试剂盒(Axygen公司),兔抗人ACTHR抗体及羊抗兔二抗(Abcam公司);ECL显色试剂盒购自Thermo公司。
1.2 方法
1.2.1 细胞培养 采用DMEM/F12培养基+2.5%Nu serum+1%ITS+1培养H295R细胞,置37℃、饱和湿度、5% CO2培养箱中培养,细胞传代采用0.25%胰蛋白酶,取对数生长期细胞进行实验,实验时尽量使细胞汇合度达到80%~90%。
1.2.2 慢病毒载体包装ACTHR高表达 依据慢病毒包装试剂盒说明书,按感染复数multiplicity of infection(MOI)= 20加入ACTHR高表达载体:慢病毒pLVX-mCMV-ACTHR-ZsGreen,同时加入终浓度为8 μg/mL聚凝胺,空白对照孔不加病毒,阴性对照组加无ACTHR的空病毒,轻轻混匀,置于37 ℃、 5% CO2培养箱内培养,感染24 h后用完全培养基换液。
1.2.3 荧光定量PCR 取感染48 h后的各组细胞,按RNA提取试剂盒及cDNA合成试剂盒说明书操作,分别提取RNA并合成cDNA,按荧光定量PCR SYBR Green I试剂盒说明书操作性实时定量PCR。反应体系为25 μL, ACTHR引物参考文献[2],上游引物:5′ CTCATTCATTTTGCCCAGAAAGTT 3′, 下游引物:5′GGATCTTTTCTTCCTTGTAGCACTTG 3′;GAPDH上游引物:5′- GTGAAGGTCGGAGTCAACG -3′,下游引物:5′- TGAGGTCAATGAAGGGGTC -3′。反应条件:95℃预变性10 min;95 ℃变性15 s, 60℃退火60 s,共40个循环。循环结束后计算CT值,CT值代表荧光信号由本底进入指数增长阶段达到阈值所对应的PCR循环次数。各组ACTHR的基因表达水平按国际常用的△△CT法[3]进行分析,进而对比其基因高表达效果。
1.2.4 Western blot 将感染后48 h的各组细胞裂解提取蛋白,BCA方法测蛋白浓度,以10%浓度的SDS-PAGE电泳,转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,5%脱脂奶封闭,加入兔抗人ACTHR抗体及内参β-actin一抗,4℃孵育过夜,TBST缓冲液冲洗 PVDF膜3次,每次10 min。羊抗兔IgG二抗在37℃孵育1 h,TBST洗膜3次,每次10 min。洗膜后用ECL化学发光法显色,图像经Quantity One软件分析后以吸光值作为半定量指标,对比各组ACTHR蛋白表达水平进而计算ACTHR的蛋白表达情况。
1.2.5 WST-1法检测细胞增殖率 取对数生长期细胞,胰酶消化后按2 000个(100 μL)/孔的密度接种于96孔板。实验分3组,分别是pLVX-mCMV-ACTHR -ZsGreen组、阴性对照组和空白对照组。实验步骤按试剂盒说明书操作:取10 μL WST-1溶液加入到96孔板细胞中,培养1 h后在摇床上摇动1 min,混匀后在酶标仪上测A450-A630值,每天记录1次,共5 d;将每组细胞的吸光值,绘制细胞增殖曲线。另外,在细胞增殖活性最高时段,对各组细胞进行计数,与实验开始时的2 000个细胞进行对比,进而判断ACTHR高表达对细胞增殖的影响作用。
1.2.6 TUNEL法检测细胞凋亡 将适量对数生长期的各组细胞接种24孔板,感染后48 h行细胞凋亡检测。按照试剂说明书操作,简要步骤如下:经4% 多聚甲醛固定后,PBS洗涤,室温下3%双氧水浸泡10 min。在4℃环境中,用细胞通透液作用2 min(或者在冰上)。PBS洗涤后滴加50 μL TUNEL反应混合液。在密闭的暗湿盒中于37℃反应1 h,在荧光显微镜下观察并拍照。
2 结 果
2.1 Western blot 和Real-time PCR检测ACTHR在各组细胞中的表达 与对照组相比,ACTHR mRNA水平和蛋白表达水平在慢病毒组细胞中明显增加,其蛋白水平约增加2.4倍,mRNA表达水平增加18倍(图1);差异均具有统计学意义(P<0.05,图2)。这表明慢病毒组细胞有效地促进了ACTHR的高表达。
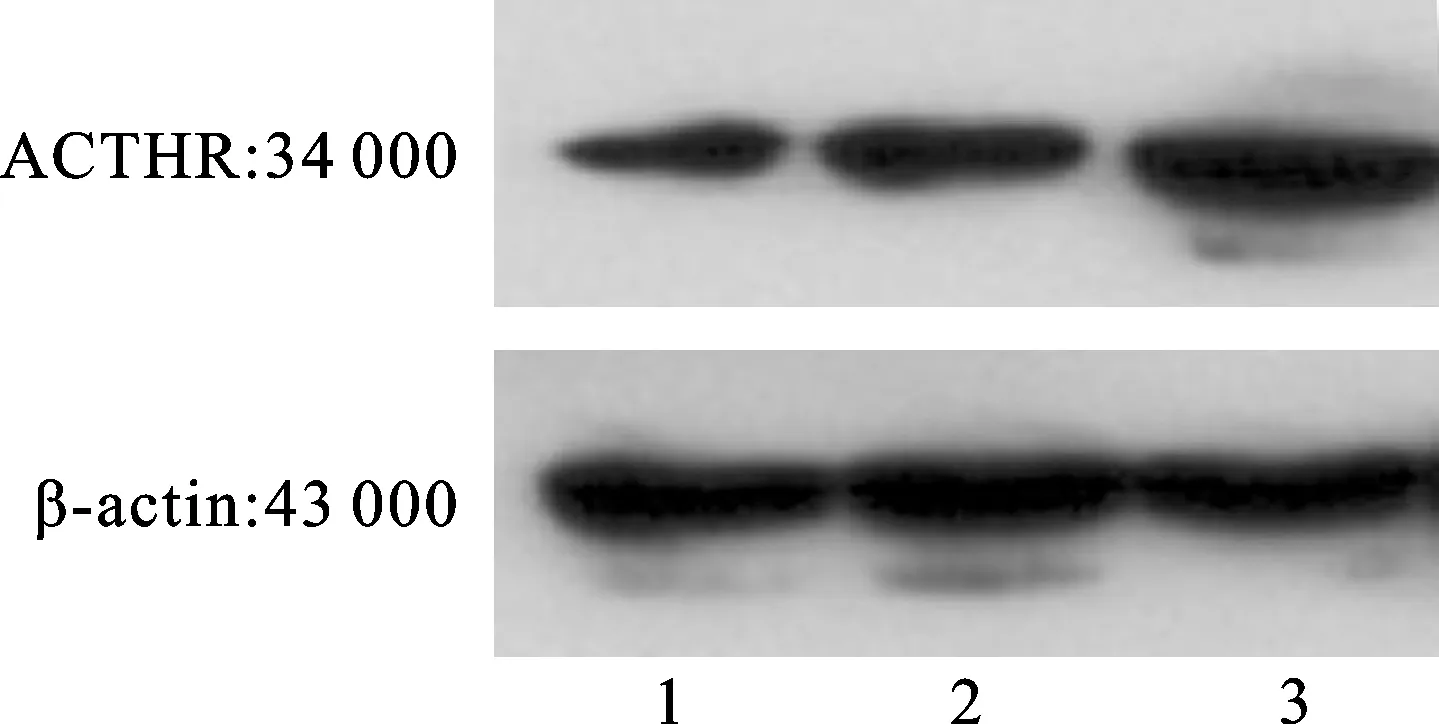
图1 Western blot 检测慢病毒感染H295R细胞后ACTHR蛋白表达水平

图2 各组细胞ACTHR mRNA表达水平
2.2 WST-1测定ACTHR高表达对H295R细胞增殖的影响 通过连续5 d的检测,可以看出随着时间的推移,实验组细胞和阴性对照组细胞增殖水平呈不同变化趋势。实验组细胞增殖活性呈双重变化趋势,即呈先促进后抑制,在前3 d内增殖活性高于对照组细胞,尤其是在第2天达到顶峰,但第4天后增殖活性低于对照组细胞,而且随着时间的延长这种趋势更加明显(P<0.05,图3)。但对照组细胞增殖活性一直呈平稳上升趋势。
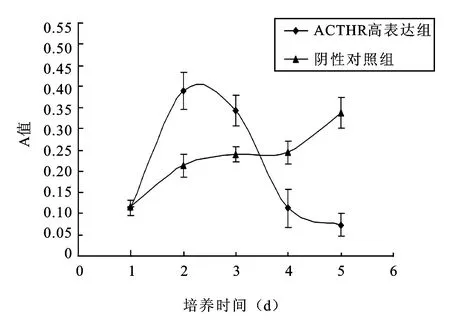
图3 WST-1法测量两组细胞的增殖情况
2.3 细胞计数结果 通过增殖曲线变化趋势,发现ACTHR高表达组H295R细胞在第2天增殖活性最高,因此,选择这一高峰时刻记录细胞总数变化情况,结果发现实验组和对照组细胞由最初的2 000个/孔分别达到(5.3±0.21) ×103和 (3.8±0.24) ×103个(图4),两组细胞计数结果对比具有统计学意义(P<0.05)。
2.4 ACTHR过表达对H295R细胞凋亡的影响 与阴性对照组相比,荧光显微镜下观察ACTHR高表达组凋亡细胞情况未见有明显差异(P>0.05,图5),这说明ACTHR可能对H295R细胞凋亡无显著作用或影响不明显。

图4 增殖活性最高时各组细胞计数结果

图5 ACTHR过表达对H295R细胞凋亡的影响(×200)
3 讨 论
从胚胎期到出生后,肾上腺的组织形态及细胞成分都在发生分化。这种变化与细胞增殖及凋亡密切相关的,二者维持动态平衡,一旦平衡被打破便会向着占优势的一方发展并引起相应疾病[4]。与其他肿瘤不同,肾上腺肿瘤除种类繁多外,肿瘤细胞还分泌不同的激素。不同的肾上腺皮质条带,其细胞特性和生理功能不同,如HORNSBY等[5]认为人出生后肾上腺发育过程中细胞增殖主要发生在球状带和束状带细胞,而细胞凋亡则主要发生在网状带细胞。就ACTHR而言,多数学者是通过ACTH刺激而间接了解其作用的。PAYET等[6]通过向肾上腺皮质中注射ACTH发现球状带细胞增生,而束状带细胞萎缩;MAZZUCO等[7]发现球状带细胞刺激久了就会向束状带细胞分化:由此可见,肾上腺细胞自身的不同特征决定了对外界刺激的差异性。
就肾上腺皮质细胞而言,目前已经建立的细胞系不多,除H295R细胞外,研究和应用较多的是人肾上腺皮质癌细胞(SW-13 cell)及小鼠肾上腺皮质细胞(Y1 cell)。与其他组织或细胞不同,肾上腺皮质细胞具有较强的种属及细胞特异性[8],Y1细胞来源于小鼠,SW-13细胞是从小细胞来源的无功能肾上腺皮质癌中培养起来的细胞系[9],不能表达重要的类固醇激素和必要的生长因子,因而上述两种细胞的应用均受到一定限制。H295R细胞是目前国际上研究肾上腺皮质功能公认的理想细胞,具有稳定表达类固醇激素的特点,在激素分泌和细胞特征上与原代培养的人肾上腺皮质细胞最接近,被广泛应用于肾上腺皮质的激素分泌、分子调控、基因多态性、肿瘤发病、药物实验等各项研究中。
为进一步了解ACTHR的可能作用机理,我们应用H295R细胞进行了后续研究。研究发现ACTHR高表达对H295R细胞增殖活性呈双重影响效应,即先促进后抑制,实验组细胞在前3天内增殖活性高于对照组细胞,尤其是在2天后达到顶峰,但第4天后增殖活性低于对照组细胞,而且随着时间的延长这种趋势更加明显。这与既往人们对ACTH的双重刺激认识相符合,许多学者研究显示ACTH对肾上腺皮质激素及细胞生长的作用主要体现在刺激后早期阶段,从24~72 h不等[10]。这说明ACTHR对H295R细胞有促增殖或生长作用,但具有一定的时间依赖性,在细胞凋亡检测中未发现两组细胞有差异性。肿瘤的发生往往是增殖及凋亡一方或双方失衡引起,我们推测ACTHR对H295R细胞的影响可能以促增殖为主,对凋亡无影响或不明显。
肿瘤的发生具有多因素参与、多环节促成的特点,本文初步探讨了ACTHR在常见肾上腺肿瘤中的表达及其可能对肾上腺肿瘤的发生起促进的作用。由于肾上腺肿瘤多数具有内分泌功能,因而进一步的研究必须考虑机体内环境及相互影响等因素。对ACTHR的深入研究有望成为了解肾上腺肿瘤成瘤机制及激素分泌的新突破口。
[1] CHAN LF, METHERELL LA, CLARK AJ. Effects of melanocortins on adrenal gland physiology [J]. Eur J Pharmacol, 2011, 660(1):171-180.
[2] MORRIS DG, KOLA B, BORBOLI N, et al. Identification of adrenocorticotropin receptor messenger ribonucleic acid in the human pituitary and its loss of expression in pituitary adenomas [J]. J Clin Endocrinol Metab, 2003, 88(12): 6080-6087.
[3] NOGUEIRA EF, VARGAS CA, OTIS M,et al. Angiotensin-Ⅱ acute regulation of rapid response genes in human, bovine, and rat adrenocortical cells [J]. J Molecul Endocrinol, 2007, 39(6): 365-374.
[4] VINSON GP. Glomerulosa function and aldosterone synthesis in the rat[J]. J Molecul Endocrinol, 2004, 217(1-2): 59-65.
[5] HORNSBY PJ. Aging of the human adrenal cortex[J]. Ageing research reviews, 2002,1(2):229-242.
[6] PAYET N, LEHOUX JG, ISLER H. Effect of ACTH on the proliferative and secretory activities of the adrenal glomerulosa [J]. Acta endocrinologica (Copenh), 1980, 93(3):365-374.
[7] MAZZUCO TL, GRUNENWALD S, LAMPRON A, et al. Aberrant hormone receptors in primary aldosteronism [J]. Hormone & Metabol Res, 2010, 42(6):416-423.
[8] ULLERAS E, OHLSSON A, OSKARSSON A. Secretion of cortisol and aldosterone as a vulnerable target for adrenal endocrine disruption - screening of 30 selected chemicals in the human H295R cell model [J]. J Appl Toxicol, 2008, 28(8): 1045-1053.
[9] DELHANTY PG, KOETSVELD PM, GAUNA C, et al. Ghrelin and its unacylated isoform stimulate the growth of adrenocortical tumor cells via an anti-apoptotic pathway [J]. Am J Physiol Endocrinol Metab, 2007, 293(1): 302-309.
[10] XING Y, PARKER CR, EDWARDS M, RAINEY WE. ACTH is a potent regulator of gene expression in human adrenal cells[J]. J Molecul Endocrinol, 2010, 45(1):59-68.
(编辑 王 玮)
Lentivirus-mediated over-expression of ACTHR on the proliferation of human adrenocortical H295R cells
HU Dong-liang, LIU Tong-zu,NI Dong, WANG Xing-huan
(Department of Urology, Zhongnan Hospital of Wuhan University, Wuhan 430071, China)
Objective To explore the effect of adrenocorti cotrophic hormone receptor (ACTHR) over-expression on the proliferation of human adrenocortical H295R cells, and to investigate its role in the pathogenesis of adrenal tumors. Methods H295R cells transfected by lentivirus-mediated ACTHR served as the experimental group. H295R cells without virus infection served as control group. The cell proliferation at different ACTHR levels was evaluated with WST-1 and cell count. Cell apoptosis after 48 hours was measured with TUNEL. Results Higher proliferation activity was observed in the experimental cells than in the control cells in the first three days, which peaked on the second day. But this trend reversed on the fourth day. The number of experimental and control cells were (5.3±0.21) ×103and (3.8±0.24) ×103at peak stage, (P<0.05). By contrast, there was no significant difference between the two groups in cell apoptosis. Conclusion ACTHR affects H295R cells in a time-dependent manner. It has stronger effect on the proliferation than on the apoptosis of H295R cells.
adrenocorti cotrophic hormone receptor; H295R cell; adrenal tumor;proliferation;apoptosis
2015-02-11
2015-04-27
国家自然科学基金(No.81200579)
胡东亮(1982-),男(汉族),医学博士,主治医师.研究方向:肾上腺疾病基础研究.E-mail: hdlhdl2008@163.com
R691.9
A
10.3969/j.issn.1009-8291.2015.09.014
