原发及转移前列腺腺癌组织TMSG-1蛋白表达及意义
2015-05-09李敬敬于文娟张丽项锋钢
李敬敬,于文娟,张丽,项锋钢,
(青岛大学医学院,山东 青岛 266021 1 病理学教研室; 2 附属医院病理科)
原发及转移前列腺腺癌组织TMSG-1蛋白表达及意义
李敬敬1,于文娟2,张丽1,项锋钢1,2
(青岛大学医学院,山东 青岛 266021 1 病理学教研室; 2 附属医院病理科)
目的 检测肿瘤转移抑制基因1(TMSG-1)蛋白在前列腺增生、原发性前列腺腺癌及转移性前列腺腺癌组织的表达,探讨其在肿瘤浸润转移中的作用及其与前列腺癌病人预后的关系。方法 采用免疫组织化学技术检测TMSG-1蛋白在22例前列腺增生、38例原发性前列腺腺癌及18例转移性前列腺腺癌组织中的表达。结果TMSG-1蛋白在前列腺增生(20/22)、原发性前列腺腺癌(34/38)及转移性前列腺腺癌(10/18)组织中均有表达,原发性前列腺腺癌组织中TMSG-1阳性表达率明显高于转移性前列腺腺癌组织(χ2=6.707,P<0.05);前列腺增生组织中TMSG-1阳性表达率高于转移性前列腺腺癌组织(χ2=4.848,P<0.05);前列腺增生组织中TMSG-1阳性表达率与原发性前列腺腺癌组织无差异(χ2=0.003,P>0.05)。原发性前列腺腺癌组织TMSG-1蛋白的表达与神经侵犯有关(P=0.034 7),而与Gleason评分、邻近组织侵犯及病人年龄均无关(P=0.306 8、0.051 2、0.123 8)。Kaplan-Meier生存分析结果表明,TMSG-1蛋白阳性组的生存时间和生存率明显高于TMSG-1蛋白阴性组(χ2=5.153,P<0.05)。结论 TMSG-1蛋白在原发性前列腺腺癌组织的表达明显高于转移性前列腺腺癌,TMSG-1蛋白可能与原发性前列腺腺癌的转移过程有关,其表达水平的高低可能作为一个预测前列腺腺癌转移潜能大小的检测指标。
前列腺腺癌;TMSG-1;肿瘤转移;抑制基因;预后
前列腺腺癌是男性生殖系最常见的恶性肿瘤。在我国其发病率居男性恶性肿瘤第3位。由于缺乏有效的早期诊断的手段,我国大多数前列腺腺癌病人确诊时已属中晚期,特别是前列腺腺癌转移严重威胁男性病人的健康和生命。因此,预测前列腺腺癌是否发生转移,并采用相应的治疗手段显得尤为重要。肿瘤转移抑制基因1(TMSG-1)是近年来新发现的肿瘤转移抑制基因,已被证实在乳癌[1]、结直肠癌[2]、宫颈癌[3]及肝癌[4]组织中表达,与肿瘤浸润、转移相关。本研究采用免疫组织化学方法,检测TMSG-1蛋白在原发性及转移性前列腺腺癌组织表达,旨在探讨TMSG-1表达是否可作为预测前列腺腺癌转移的参考指标之一。
1 材料与方法
1.1 材料来源
收集青岛大学附属医院病理科2009年1月—2014年1月存档蜡块,其中经手术切除的原发性前列腺腺癌38例,年龄52~82岁,中位年龄73岁。前列腺腺癌骨转移18例,年龄39~83岁,中位年龄65岁。以上病例均经苏木精-伊红(HE)染色予以确诊。另选取前列腺增生组织22例作为对照,病人年龄36~67岁,中位年龄48岁。对原发性及转移性前列腺腺癌病人自明确诊断后至2014年1月全部进行随访,其中原发性前列腺腺癌病人存活26例,死亡4例,失访8例;转移性前列腺腺癌病人存活5例,死亡3例,失访10例。
1.2 主要试剂及方法
蜡块经3 μm厚连续切片后行免疫组织化学方法染色(PV-9000二步法)。组织切片经脱蜡、水化后,柠檬酸盐缓冲液进行抗原修复15 min,体积分数0.03的H2O2灭活内源性过氧化物酶10 min。加入Ⅰ抗(鼠抗人TMSG-1单克隆抗体,美国Sigma公司产品,工作浓度1∶500),置37 ℃水浴箱孵育1 h。加入通用型二抗(羊抗兔-鼠),置37 ℃温箱孵育20 min。DAB显色、苏木精复染、5 g/L盐酸乙醇分化及10 g/L氨水返蓝。常规脱水、透明、封片,光镜下观察。每批实验用已知阳性的乳癌组织作阳性对照,PBS代替Ⅰ抗作为阴性对照。
1.3 结果判定标准
TMSG-1阳性主要是前列腺腺癌细胞的细胞质内出现棕褐色颗粒,极少数病例可出现细胞核着色。根据徐晓艳等[5]报道的判断标准进行评分,分别在高倍镜下随机选择5个视野计数,结合阳性细胞染色强弱及阳性细胞百分比两个方面计算TMSG-1的免疫组织化学染色评分。染色强度评分标准:棕褐色3分,棕黄色2分,淡黄色1分,无着色0分。每张切片随机选择5个高倍视野,每个视野计数100个细胞,计算阳性细胞百分比(阳性细胞数/总细胞数)×100%。阳性细胞所占比例评分标准:阳性细胞数>75%为4分;51%~75%为3分;11%~50%为2分;1%~10%为1分;阴性位0分。将上述两种得分相乘得到综合得分:0~2分为阴性表达(-),3分为(+),4分为(),5分以上为()。(+~)均为阳性表达。
1.4 统计学方法
采用SPSS 17.0软件进行统计处理,计数资料比较用χ2检验及Fisher确切概率法,生存分析用Kaplan-Meier方法。以P<0.05为差异有显著性。
2 结 果
2.1 TMSG-1蛋白在前列腺增生、原发性及转移性前列腺腺癌组织中的表达
TMSG-1蛋白在前列腺增生、原发性及转移性前列腺腺癌组织中均有表达,主要表达于细胞质,部分原发性前列腺腺癌组织中也可见少数细胞核着染(图1)。原发性前列腺腺癌组织中TMSG-1阳性表达率(34/38)明显高于转移性前列腺腺癌组织(10/18)(χ2=6.707,P<0.05),前列腺增生组织中TMSG-1阳性表达率(20/22)高于转移性前列腺腺癌组织(10/18)(χ2=4.848,P<0.05),前列腺增生组织中TMSG-1阳性表达率与原发性前列腺腺癌组织无差异(χ2=0.003,P>0.05)。见表1。
2.2 TMSG-1蛋白表达与临床病理特征的关系
TMSG-1蛋白在原发性前列腺腺癌组织中的表达与神经侵犯有关(P=0.034 7),而与Gleason评分、邻近组织侵犯及病人的年龄均无关(P=0.306 8、0.051 2、0.123 8)。见表2。
2.3 TMSG-1蛋白表达与病人术后生存期的关系
Kaplan-Meier生存分析结果表明,原发性和转移性前列腺腺癌组织中,TMSG-1蛋白阳性组生存时间和生存率明显高于TMSG-1蛋白阴性组(χ2=5.153,P<0.05)。见图2。
3 讨 论
前列腺腺癌是威胁老年男性的主要恶性肿瘤。在我国,随着人均寿命延长、膳食结构改变和诊断技术提高,前列腺腺癌发病率跃居第3位,病人死亡率也随着不断升高,且大部分病人因发生肿瘤转移而死亡[6-7]。由于缺乏有效的早期诊断手段,前列腺腺癌病人确诊时已属中晚期。因此,预测前列腺癌是否发生转移,并采用相应的治疗手段显得尤为重要。
TMSG-1蛋白是一种抑癌基因,目前有许多研究探讨了其在采用体外培养细胞及人体组织中的表达和临床病理意义。TMSG-1蛋白在前列腺腺癌低转移细胞亚系中的表达明显高于高转移细胞亚系[5],TMSG-1蛋白可以抑制乳癌、肺癌、肝癌等多种肿瘤细胞系的侵袭及转移能力,与肿瘤细胞侵袭浸润密切相关[8-10]。在结直肠癌中TMSG-1蛋白表达明显低于正常结直肠组织,其表达与肿瘤浸润程度、分化程度、淋巴结转移及远处转移呈明显负相关[2];在胃癌组织中TMSG-1蛋白的表达较胃良性组织明显下降,TMSG-1蛋白的表达与肿瘤的增殖浸润明显相关[11]。由此可见,TMSG-1蛋白与肿瘤的浸润转移密切相关。然而,TMSG-1蛋白是否与前列腺腺癌转移有关尚未见相关报道。
我们的实验结果显示,TMSG-1蛋白主要表达于细胞质中,其阳性表达率在原发性前列腺腺癌组织及前列腺增生组织中明显高于转移性前列腺腺癌组织。结果提示TMSG-1蛋白表达减少有利于肿瘤转移,TMSG-1蛋白可能起到抑制肿瘤转移的作用。另外,TMSG-1蛋白在原发性前列腺腺癌组织的表达与神经侵犯密切相关,尽管与邻近组织侵犯无统计学差异,但接近统计值,提示TMSG-1蛋白可能具有抑制肿瘤发生侵袭的作用。此外,Kaplan-Meier生存分析结果表明,TMSG-1蛋白阳性组生存时间和生存率明显高于TMSG-1蛋白阴性组,提示TMSG-1可能与肿瘤的预后有关。本研究结果提示,TMSG-1蛋白的低表达可能是一个预测前列腺腺癌转移的客观参考指标。
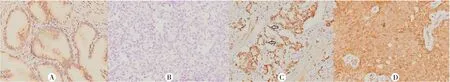
A:在前列腺增生组织中呈阳性表达;B:在转移性前列腺腺癌组织中呈阴性表达;C:在原发性前列腺腺癌细胞核中呈阳性表达,箭头示细胞核表达;D:在原发性前列腺腺癌组织中呈阳性表达。PV-9000染色,200倍。
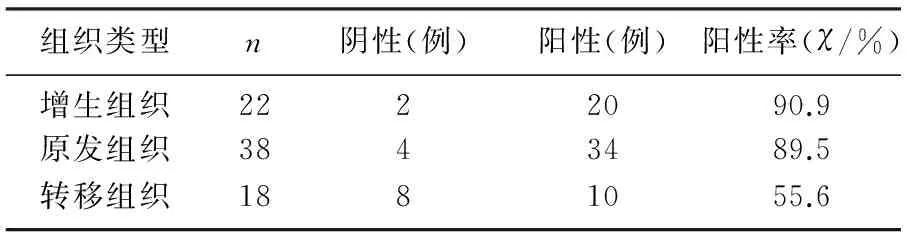
表1 TMSG-1蛋白在不同前列腺病变组织中的表达
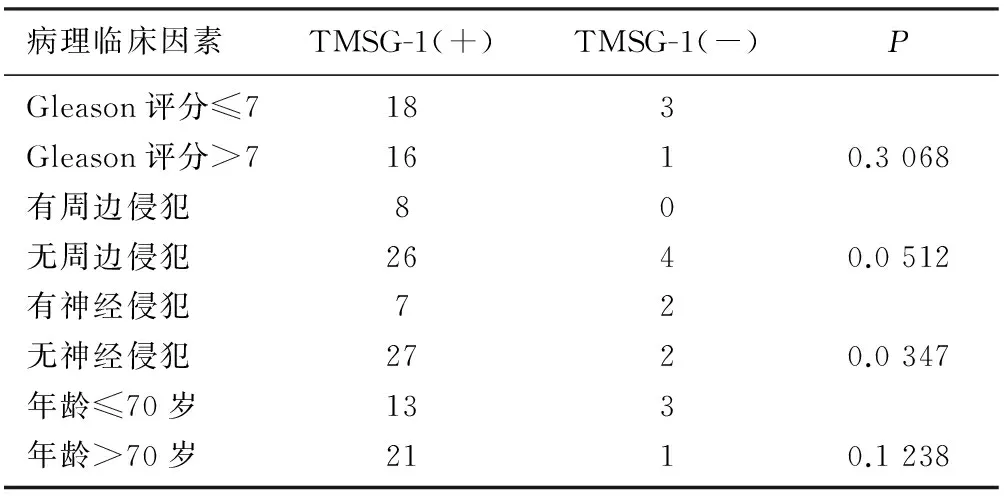
表2 TMSG-1表达与原发性前列腺腺癌病人临床病理特征关系(例)
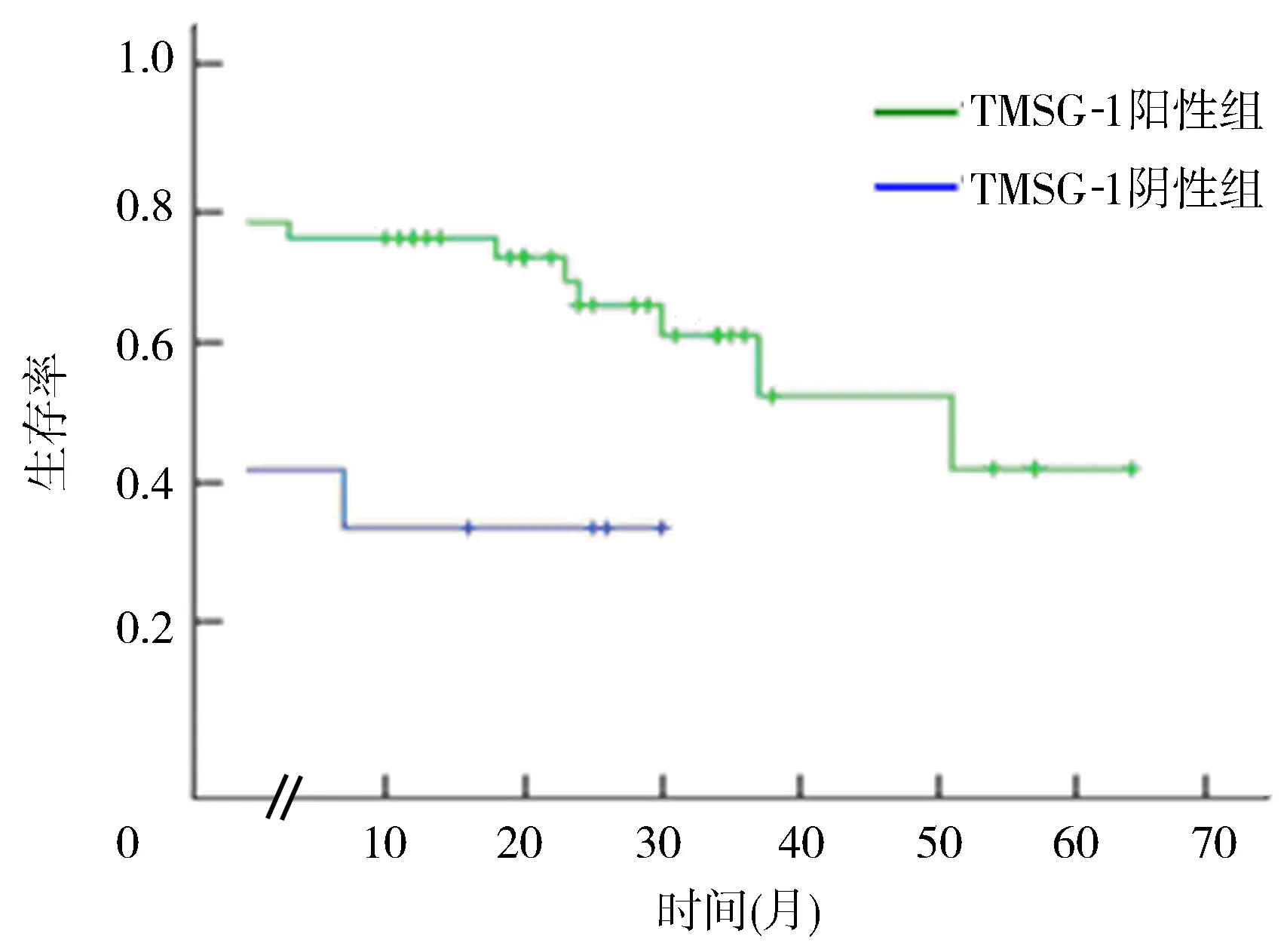
图2 TMSG-1蛋白的表达与前列腺腺癌病人的生存分析
另外,本研究结果还显示,少数细胞核TMSG-1蛋白呈阳性表达,尤其见于原发性前列腺腺癌组织中,这与徐晓艳等[12]的研究结果一致,即与前列腺腺癌细胞系中可见少量TMSG-1核表达相一致。此种现象可能与TMSG-1的homeodomain结构域有关。有关研究的结果显示,含有homeodomain结构域的基因属于调节基因家族,失衡时可致肿瘤发生异常或造血系统发生异常,其调控细胞生长的作用可能与肿瘤的转移有关[13-14]。另有研究表明,含有homeodomain结构域的TMSG-1截断体能够进入细胞核发挥转录因子的作用,推测与其肿瘤转移抑制作用有关[15]。
徐晓艳等[5]研究结果表明,TMSG-1在前列腺腺癌组织中的表达明显低于前列腺增生组织。本研究结果显示,前列腺增生与原发性前列腺腺癌组织的TMSG-1蛋白阳性表达率无明显差异,产生的主要原因可能与选择病例的数量差异等有关,有待今后积累病例进行大样本实验验证。本实验结果还表明,TMSG-1蛋白在前列腺腺癌组织中的表达与Gleason评分及病人年龄无确切相关性,刘琳等[1]在对乳癌研究中也得出TMSG-1蛋白的表达与肿瘤病理分级和病人年龄无明显相关性的结论。关于TMSG-1蛋白与肿瘤分化的确切关系,目前尚无定论,有待进一步深入研究。
总之,本研究结果表明,TMSG-1蛋白表达的高低与前列腺腺癌浸润转移有关,其表达水平的高低可能作为预测前列腺腺癌转移潜能的一个参考指标。进一步的研究需探讨TMSG-1能否作为前列腺腺癌的治疗靶点。
[1] 刘琳,赵坡,张忠梅,等. 乳腺癌TMSG-1蛋白的表达及临床病理意义[J]. 中国现代医学杂志, 2013,23(13):59-61.
[2] 余泽炎,钟武,陈利生. TMSG-1蛋白在结直肠癌中的表达及意义[J]. 结直肠肛门外科, 2012,18(1):7-10.
[3] SU J, YOU J F, WANG J L, et al. Overexpression of tumor metastasis suppressor gene 1 suppresses proliferation and invasion, but enhances apoptosis of human breast cancer cells MDA-MB-231 cells[J]. Zhonghua Bing Li Xue Za Zhi, 2007,36(10):672-676.
[4] MESICEK J, LEE H, FELDMAN T, et al. Ceramide synthases 2,5, and 6 confer distinct roles in radiation-induced apoptosis in HeLa cells[J]. Cell Signal, 2010,22(9):1300-1307.
[5] 徐晓艳,张燕,杨京平,等. TMSG-1在人前列腺腺癌细胞株与前列腺腺癌组织中的表达及临床意义[J]. 中华实验外科杂志, 2011,28(6):868-870.
[6] 孙颖浩. 我国前列腺癌的研究现状[J]. 中华泌尿外科杂志, 2004,25(2):77-80.
[7] 徐晓龙,陈长宜,王友宝,等. MIF与常见前列腺疾病相关性的研究进展[J]. 青岛大学医学院学报, 2015,51(2):244-246.
[8] 苏静,由江峰,王洁良,等. 人肿瘤转移抑制基因1转染对人乳腺癌细胞MDA-MB-231体外生物学行为的影响[J]. 中华病理学杂志, 2007,36(10):672-676.
[9] 边巴,马春树,由江峰,等. TMSG-1基因转染对肿瘤转移表型的影响[J]. 北京大学学报:医学版, 2003,35(1):18-22.
[10]唐宁,游海燕,金洁,等. 靶向LASS2基因的小干扰RNA对人肝癌细胞侵袭能力的影响[J]. 肿瘤, 2009,29(5):399-403.
[11]汪波. TMSG1 在胃癌中的表达及其临床意义[J]. 中国实用医药, 2013,8(23):1-2.
[12]徐晓艳,由江峰,裴斐. 前列腺腺癌细胞系中TMSG-1的表达及其意义[J]. 临床与实验病理学杂志, 2011,27(1):40-43.
[13]CILLO C, FAIELLA A, CANTILE M, et al. Homeobox genes and cancer[J]. Exp Cell Res, 1999,248(1):1-9.
[14]TUPLER R, PERINI G, GREEN M R. Expressing the human genome[J]. Nature, 2001,409(6822):832-833.
[15]夏岩,王曰伟,于文娟,等. TMSG-1蛋白不同功能域重组质粒构建及亚细胞定位[J]. 齐鲁医学杂志, 2014,29(5):381-384.
(本文编辑 牛兆山 于国艺)
THE EXPRESSION AND SIGNIFICANCE OF TMSG-1 IN PRIMARY AND METASTATIC PROSTATE ADENOCARCINOMA TISSUES
LIJingjing,YUWenjuan,ZHANGLi,XIANGFenggang
(Department of Pathology, Qingdao University Medical College, Qingdao 266021 China)
ObjectiveTo investigate the expression of tumor metastasis suppressor gene 1 (TMSG-1) in benign prostatic hyperplasia (BPH), primary prostate adenocarcinoma (PPAC) and metastatic prostate adenocarcinoma (MPAC) and explore its effect on tumor infiltration and metastasis, as well as its association with the patient’s prognosis.MethodsThe expression of TMSG-1 was detected immunohistochemically in 22 cases of BPH,38 of PPAC, and 18 of MPAC.ResultsTMSG-1 expression was observed in BPH (20/22), PPAC (34/38) and MPAC (10/18), the expression of TMSG-1 was higher in PPAC versus the MPAC (χ2=6.707,P<0.05), and that in BPH was higher than that in MPAC (χ2=4.848,P<0.05); but no difference between BPH and PPAC (χ2=0.003,P>0.05). TMSG-l expression in PPAC was correlated with nerval invasion (P=0.034 7), but not with Gleason grade, adjacent tissue invasion and patient’s age (P=0.306 8, 0.051 2, 0.123 8). Kaplan-Meier survival analysis showed that the survival time of patients in TMSG-1-positive group was longer than those in TMSG-1-negative group (χ2=5.153,P<0.05).ConclusionThe expression of TMSG-1 in primary prostate adenocarcinoma is much higher than that in metastatic one. TMSG-1 protein may be associated with the metastasis of primary prostate adenocarcinoma. The level of TMSG-1 expression may be used as a helpful marker for predicting the potentiality of metastasis of this malignancy.
prostate adenocarcinoma; TMSG-1; metastasis; suppressor gene; prognosis.
2015-04-21;
2015-06-03
国家自然科学基金资助项目(81201654)
李敬敬(1988-),女,硕士研究生。
项锋钢(1964-),男,硕士,教授,硕士生导师。E-mail:xiangfenggang@163.com
R730.2
A
1008-0341(2015)04-0395-04
