普鲁兰多糖发酵液中色素及蛋白的脱除
2015-05-08贺晓晗王海增郝华伟高学理
贺晓晗,王海增,郝华伟,高学理
(中国海洋大学化学化工学院 海洋化学工程与技术教育部重点实验室,山东青岛 266100)
普鲁兰多糖发酵液中色素及蛋白的脱除
贺晓晗,王海增*,郝华伟,高学理
(中国海洋大学化学化工学院 海洋化学工程与技术教育部重点实验室,山东青岛 266100)
为解决普鲁兰多糖发酵液色素和蛋白脱除过程中多糖易降解、有机试剂用量大、重复次数多等问题,本论文采用D4020树脂、硅藻土、凹凸棒土等三种吸附剂,同时脱除发酵液中的色素和蛋白。通过考察时间、温度、pH、用量等因素对色素脱除率、蛋白脱除率和多糖保留率的影响,比较三种吸附剂的吸附条件和吸附效果,得出三种吸附剂对色素和蛋白均有较好的去除效果,其中硅藻土的去除效果最好。在单因素实验的基础上对硅藻土进行了正交实验,得到硅藻土的最优吸附条件为:时间60min,温度35℃,发酵液pH3.2,吸附剂用量1.6%,在该条件下脱色率为80.17%,脱蛋白率为76.28%,多糖保留率为89.82%。
吸附,脱色,脱蛋白,普鲁兰多糖,发酵液
普鲁兰多糖是一种细胞外水溶性大分子中性多糖,具有极佳的成膜性、成纤维性、阻氧性及易自然降解等独特的理化和生物学特性,对人体无副作用,是一种极具开发价值和应用前景的新型生物制品[1]。普鲁兰多糖通过微生物发酵法获得,发酵液中含有色素和蛋白,去除这些杂质是多糖纯化过程中的重要步骤。目前,发酵液脱色和脱蛋白分两步单独进行,脱色法主要有吸附法[2]、双氧水氧化法[3]等,脱蛋白法主要有有机试剂法[4]、酶法[5]等。双氧水法通过氧化实现脱色,易造成多糖降解[6];有机试剂法存在试剂用量大、重复次数多等问题[7];酶法灭活温度高,易破坏多糖结构,且成本较高[8]。与之相比,吸附法具有脱除效果好、操作简单、处理量大、不易破坏多糖结构等优点,常用于普鲁兰多糖发酵液的脱色过程[9-10],但吸附脱除该发酵液中蛋白的研究鲜有报道[10]。大孔树脂具有吸附容量大、脱色范围广、可重复利用等特点,广泛应用于天然产物的提取、分离纯化过程[11];硅藻土具有比表面积大、吸附能力强、化学稳定性高等优点,常用作助滤剂[12];凹凸棒土作为性能优良的吸附剂,已在化工、环保、催化剂等领域广泛应用[13],尚未应用于发酵液处理。
本实验采用D4020树脂、硅藻土和凹凸棒土等三种吸附剂,同时去除普鲁兰多糖发酵液中的色素和蛋白。探究了时间、温度、pH和用量等因素对色素和蛋白质吸附效果的影响,筛选出同时去除色素和蛋白效果最佳的吸附剂,为普鲁兰多糖的理论研究及工业化提取提供理论依据。
1 材料与方法
1.1 材料与仪器
菌种 普鲁兰多糖高产菌株Y68,中国海洋大学海洋生命学院池振明教授提供;D4020树脂 天津南开和成科技有限公司;硅藻土 吉林省长白县青山源硅藻土有限公司;凹凸棒土 江苏玖川纳米材料科技有限公司;其他化学试剂 均为分析纯;
紫外可见分光光度计(UV-2450) 岛津公司;台式高速离心机(Neofuge15) 力康生物医疗科技控股有限公司;水浴恒温振荡器(SHZ-82) 江苏金坛市金城国胜实验仪器厂;循环水式多用真空泵(SHB-Ⅲ) 郑州长城科工贸有限公司;分析天平(FA2004N) 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 发酵液的制备 挑取普鲁兰多糖高产菌株Y68 1~2环接入培养基中,活化24h,以10%接菌量接入装有30L培养基的发酵罐中,28℃培养4d,得到普鲁兰多糖发酵液。将发酵液在80℃下加热60min进行预处理,杀死菌体并钝化发酵液中的普鲁兰酶,减少其对普鲁兰多糖的分解。灭酶的发酵液冷却至室温,冰箱保存备用。
1.2.2 吸附剂预处理 硅藻土、凹凸棒土预处理:分别将硅藻土和凹凸棒土放入烘箱内,在120℃下烘干4h,冷却后置于干燥器中保存。
树脂预处理:将树脂用95%乙醇浸泡24h,充分溶胀后用蒸馏水洗至无醇味,再次用95%乙醇浸泡3~5h,洗至无醇味后用5%HCl溶液浸泡5h,洗至中性,最后用蒸馏水浸泡保存。实验前将浸泡在水中的树脂于60℃下烘干[14]。
1.2.3 吸附剂脱色脱蛋白实验 为了解D4020树脂、硅藻土和凹凸棒土的吸附性质,挑选出最适合普鲁兰多糖发酵液脱色、脱蛋白的吸附剂及其吸附条件,分别对三种吸附剂的吸附时间、温度、发酵液pH以及吸附剂用量进行单因素实验。
1.2.3.1 吸附时间对脱色和脱蛋白效果的影响 分别取用量(w/v)为2.4%的D4020树脂、硅藻土和凹凸棒土于25mL发酵液中,室温下,设定吸附时间为10、20、30、40、60、80、100、140、180和240min,吸附完成后,离心(5000r/min,10min)、抽滤得上清液,按1.2.5所示方法分别测得色素脱除率、蛋白脱除率和多糖保留率。
1.2.3.2 吸附温度对脱色和脱蛋白效果的影响 分别取用量为2.4%的D4020树脂、硅藻土和凹凸棒土于25mL发酵液中,三种吸附剂对应的振荡时间分别为80、40、100min,设定温度为15、25、35、45、55和65℃,按上述方法测得色素脱除率、蛋白脱除率和多糖保留率。
1.2.3.3 pH对脱色和脱蛋白效果的影响 分别取用量为2.4%的D4020树脂、硅藻土和凹凸棒土于25mL发酵液中,三种吸附剂对应的振荡时间分别为80、40、100min,对应的温度分别为25、25、35℃,设定发酵液pH为2、3、4、5、6、7、8、9和10,按上述方法测得色素脱除率、蛋白脱除率和多糖保留率。
1.2.3.4 用量对脱色和脱蛋白效果的影响 分别取D4020树脂、硅藻土和凹凸棒土于25mL、pH为3.2的发酵液中,三种吸附剂对应的振荡时间分别为80、40、100min,对应的温度分别为25、25、35℃,设定吸附剂用量(w/v)为0.2%、0.4%、0.8%、1.2%、1.6%、2.0%和2.4%,按上述方法测得色素脱除率、蛋白脱除率和多糖保留率。
1.2.4 正交实验设计 综合考虑单因素实验中D4020树脂、硅藻土和凹凸棒土对多糖溶液色素、蛋白的脱除效果,选取硅藻土进行正交实验。考虑到发酵液原始pH为3.2,且在实验过程中发现发酵液的颜色随pH的增加而加深,故确定正交实验发酵液pH为3.2,选取吸附时间、温度和吸附剂用量3个因素,各取3个水平,以脱色率、脱蛋白率和多糖保留率为指标,设计L9(34)正交实验表。实验因素水平见表1。

表1 实验因素水平表
1.2.5 分析方法
1.2.5.1 脱色率的测定 发酵液中色素含量的相对值以721分光光度计在320nm处的吸光度值来表示。脱色率采用如下公式来进行计算:
脱色率(%)=(A0-Ae)/A0×100
其中,A0、Ae分别代表发酵液经吸附剂处理前后在320nm下的吸光值[15]。
1.2.5.2 蛋白含量的测定 采用考马斯亮蓝染色法测定蛋白质含量,蛋白脱除率采用如下公式来进行计算:
蛋白脱除率(%)=(C0-Ce)/C0×100
其中,C0、Ce分别代表普鲁兰多糖发酵液经吸附剂处理前后所含蛋白质含量[16]。
1.2.5.3 多糖含量的测定 用95%的冰冻乙醇沉淀多糖,将混合物于4℃下放置数小时,离心弃上清液,将获得的多糖在60℃烘干至恒重,称重,既得多糖含量。多糖保留率采用以下公式来进行计算:
多糖回收率(%)=Me/M0×100
其中,M0、Me分别代表普鲁兰多糖发酵液经吸附剂处理前后多糖的含量[15]。
1.3 数据统计分析
采用Excel统计函数STDEV计算标准差,数值以平均值±标准差表示;采用FDIST函数计算p值,p值小于0.05被认为差异显著,p值小于0.01被认为差异极显著。
2 结果与讨论
2.1 吸附时间对脱色和脱蛋白效果的影响
室温下,在经过相同预处理的发酵液中分别加入等量的D4020树脂、硅藻土和凹凸棒土,比较吸附时间对吸附效果的影响,如图1和图2所示。由图可知,三种吸附剂对色素、蛋白、多糖的吸附规律相近,开始时吸附较快,随着吸附时间的延长,吸附量逐渐增大,但增加速率减缓。这可能是由于开始时吸附质分子的扩散率较快所以吸附率增加较快,随着吸附时间的延长接触越来越充分,吸附剂表面及孔道内吸附质分子增多,分子间传质阻力增加,分子扩散率减小,所以吸附率增加缓慢。D4020树脂对色素、蛋白和多糖的吸附在80min时基本达到平衡;硅藻土在40min时对三种吸附质的吸附达到平衡;凹凸棒土的吸附较慢,100min时达到平衡。

图1 吸附时间对脱色率和脱蛋白率的影响Fig.1 Effect of adsorption time on decolorization and deproteinization ratios

图2 吸附时间对多糖保留率的影响Fig.2 Effect of adsorption time on polysaccharide recovery ratios
2.2 吸附温度对脱色和脱蛋白效果的影响
吸附温度对脱色、脱蛋白效果以及多糖保留率的影响如图3和图4所示。

图3 吸附温度对脱色率和脱蛋白率的影响Fig.3 Effect of adsorption temperature on decolorization and deproteinization ratios
由图3知,吸附剂的吸附性能与温度有较大关系,三种吸附剂对色素和蛋白的吸附规律均为吸附率随温度的升高先增大后减小。由图4可知,温度对三种吸附剂吸附多糖的能力影响较小。D4020树脂和硅藻土在25℃下,凹凸棒土在35℃下达到了最佳脱色、脱蛋白效果。这是由于随着温度的升高,被吸附的分子热运动加快,更容易达到吸附剂表面并附着于其上。与此同时,传质速度的加快也使得已经吸附的分子较易解吸,所以吸附率随温度的继续升高而降低。综上三种吸附剂进行脱色脱蛋白温度不宜过高,在以下实验中确定25℃为D4020树脂和硅藻土的吸附温度,35℃为凹凸棒土的吸附温度。

图4 吸附温度对多糖保留率的影响Fig.4 Effect of adsorption temperature on polysaccharide recovery ratios
2.3 pH对脱色和脱蛋白效果的影响
pH对脱色、脱蛋白效果以及多糖保留率的影响如图5和图6所示。

图5 pH对脱色率和脱蛋白率的影响Fig.5 Effect of pH value on decolorization and deproteinization ratios
pH决定着溶液中分子的带电性质,对吸附剂的吸附性能影响较大。如图5和图6所示,三种吸附剂对色素、蛋白、多糖的吸附效果均在酸性条件下较好,在碱性条件下较差,但吸附率随pH增加而变化的趋势不尽相同。D4020树脂在pH2条件下,同时达到了最佳脱色和脱蛋白效果,这可能是由于酸性条件下树脂与色素、蛋白、多糖易形成氢键,所以较易吸附,而在高pH条件下氢键容易破坏,所以吸附量减小[14]。硅藻土在pH2、pH4条件下分别获得最佳脱色、脱蛋白效果,随着pH的继续升高脱色率和脱蛋白率急剧下降。碱性条件下脱色率较低,可能是由于在碱性条件下部分还原糖发生了美拉德反应,发酵液颜色加深,故脱色效果较差[17]。蛋白脱除率在酸性条件下较高的原因可能是溶液中的蛋白在酸性条件下带正电荷,硅藻土表面带负电性,所以在酸性条件下蛋白吸附效果好。而在pH2强酸性条件下,硅藻土表面羟基在水溶液中解离困难,使表面的负电性降低[18],阻碍了硅藻土与蛋白分子的有效作用,所以硅藻土在pH4条件下较pH2下蛋白脱除效果好。凹凸棒土在pH2下脱色和脱蛋白效果较高,随pH的增加变化不大。综上,在酸性环境下三种吸附剂对色素和蛋白的脱除效果较好,但同时多糖损失率也较大。综合色素、蛋白脱除率和多糖保留率分析,且考虑到发酵液初始pH为3.2,确定后续实验发酵液pH为3.2。

图6 pH对多糖保留率的影响Fig.6 Effect of pH value on polysaccharide recovery ratios
2.4 用量对脱色和脱蛋白效果的影响
吸附剂用量对脱色、脱蛋白效果以及多糖保留率的影响如图7和图8所示。

图7 吸附剂用量对脱色率和脱蛋白率的影响Fig.7 Effect of dosage of adsorbents on decolorization and deproteinization ratios

图8 吸附剂用量对多糖保留率的影响Fig.8 Effect of dosage of adsorbents on polysaccharide recovery ratios
从图可知,随着吸附剂用量的增加,三种吸附剂对色素、蛋白和多糖的吸附量均明显增多。这是由于随着吸附剂用量的增加吸附面积增加,吸附剂与吸附质接触充分,从而杂质去除率逐渐增加而多糖保留率降低。硅藻土、D4020树脂、凹凸棒土的用量分别达到1.6%、1.2%和2.0%时,脱色和脱蛋白基本达到平衡,而多糖保留率随用量的增加继续降低。达到平衡时硅藻土的杂质去除率较高,而凹凸棒土的多糖保留率较高。
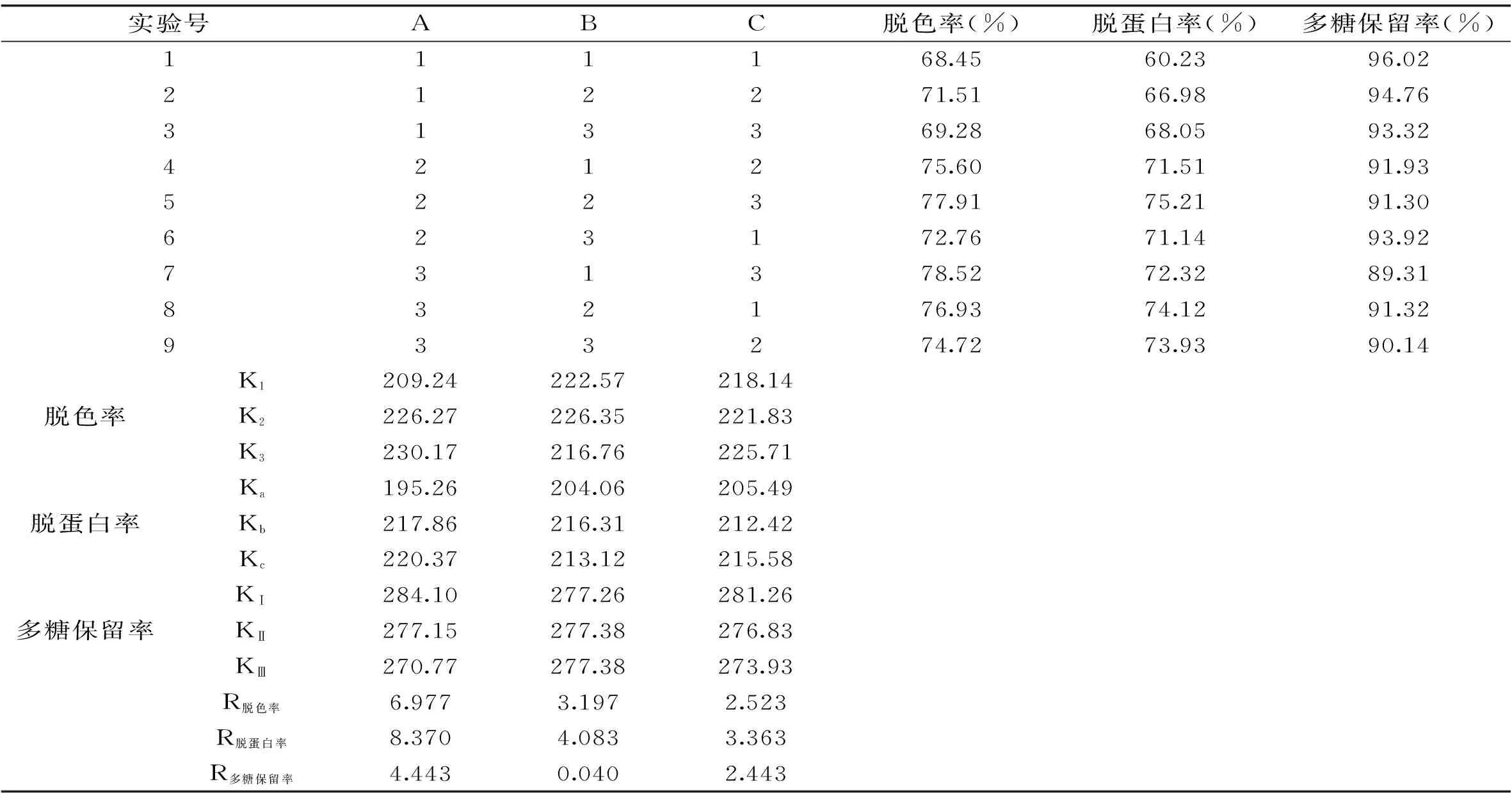
表2 正交实验结果表
2.5 正交实验结果
在单因素实验的基础上,选取硅藻土进行正交实验,确定普鲁兰多糖发酵液脱色、脱蛋白的最佳工艺条件,结果见表2。
表2表明,以脱色率为指标时,各因素的主次顺序为A>B>C,由表3知三个因素对脱色率影响均显著,最优脱色条件为A3B2C3;以脱蛋白率为指标时,各因素的主次顺序也为A>B>C,由表4知时间对脱蛋白率影响显著,最优脱蛋白条件为A3B2C3;以多糖保留率为指标时,各因素的主次顺序为A>C>B,由表5知吸附时间和吸附剂用量影响显著,最优条件为A1B2C1。对于因素A、C,不同指标所对应的最优水平不同,但本着在保证发酵液杂质脱除率高的前提下,尽可能得到较高多糖保留率的原则,优先考虑脱色率、脱蛋白率指标,故选取A3、C3;因素B,对于脱色率、脱蛋白率指标来说以B2为优,而因素B对多糖保留率影响不显著,故选取B2。综上分析,最优组合条件为A3B2C3,即时间60min,温度35℃,吸附剂用量1.6%。
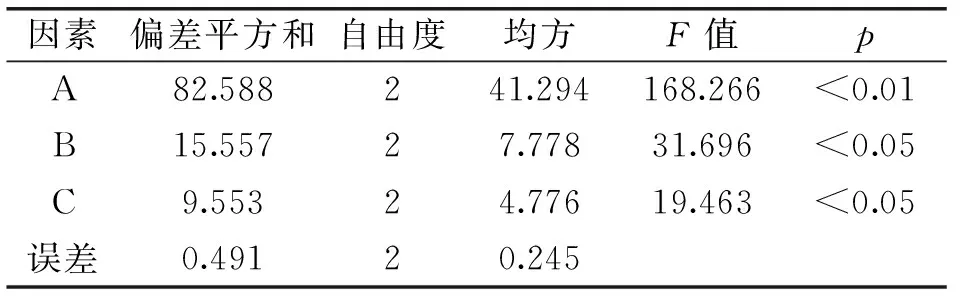
表3 脱色率方差分析表
注:F0.05(2,2)=19,F0.01(2,2)=99。

表4 脱蛋白率方差分析表

表5 多糖保留率方差分析表
2.6 验证实验
对最优工艺条件进行验证,在A3B2C3条件下,进行三次平行实验,脱色率为80.17%,脱蛋白率为76.28%,多糖保留率为89.82%。该结果在保证较高脱色率、脱蛋白率的前提下,得到了较高的多糖保留率,为普鲁兰多糖工业化生产提供工艺基础。
3 结论
实验采用D4020树脂、硅藻土、凹凸棒土等三种吸附剂脱除普鲁兰多糖发酵液中的色素和蛋白,结果表明:三种吸附剂对普鲁兰多糖发酵液色素和蛋白的脱除均有明显效果,其中硅藻土所需时间最短、用量最少,且脱除效果最好。硅藻土的最优吸附条件为:时间60min,温度35℃,发酵液pH3.2,吸附剂用量1.6%。在上述条件下硅藻土脱色率为80.17%,脱蛋白率为76.28%,多糖保留率为89.82%。
实际应用中,可以选用硅藻土同时去除普鲁兰多糖发酵液中的色素和蛋白,大大降低后续纯化工作的负荷。相比于硅藻土,D4020大孔树脂在吸附完成后吸附剂较易去除,而凹凸棒土具有多糖保留率高的优点,因此,在选择某种吸附剂时应考虑所需产品的具体要求进行取舍,才能达到预期的目的和效果。但无论采用哪种吸附剂,发酵液中仍含有少量色素和蛋白,可能是其与多糖牢固结合形成了复合物,如要获得纯多糖制品,还需要经过其他一系列提纯工序。
[1]Prajapati V D,Jani G K,Khanda S M. Pullulan:An exopolysaccharide and its various applications[J]. Carbohydrate polymers,2013,95(1):540-549.
[2]杨强,李新华,林子木. 银杏果多糖树脂脱色工艺[J]. 食品与发酵工业,2012,38(12):107-110.
[3]李小蓉,黄毓娟,权彦. 倒卵叶五加多糖脱色工艺研究[J].食品工业科技,2013,34(4):296-299.
[4]佟苗苗,翟延君,王添敏,等. 急性子多糖脱蛋白方法研究[J]. 中药材,2011,34(2):296-298.
[5]周鸿立,杨晓虹. 玉米须多糖中蛋白质脱除的Sevag与酶法联用工艺优化[J]. 食品科学,2011,32(8):129-132.
[6]袁红波,张劲松,贾薇,等. 利用大孔树脂对低分子量灵芝多糖脱色的研究[J]. 食品工业科技,2009(3):204-206.
[7]孙晨辰,沃原青,张慧. 乌骨藤多糖脱蛋白工艺的研究[J].中国医药科学,2013,3(23):55-56.
[8]张善玉. 天然产物多糖脱蛋白方法的研究[J]. 中国药房,2009,20(33):2633-2635.
[9]Singh R S,Saini G K,Kennedy J F. Pullulan:microbial sources,production and applications[J]. Carbohydrate Polymers,2008,73(4):515-531.
[10]吕蕾,郭志军,胡耀辉. 大孔树脂对茁霉多糖发酵液色素吸附性能的研究[J]. 食品与发酵科技,2009,45(4):39-41.
[11]李鹏,彭修娟,杨新杰,等.大孔吸附树脂技术在中药化学研究中的应用[J].亚太传统医药,2010,6(2):117-120.
[12]王宝民,宋凯,韩瑜. 硅藻土资源的综合利用研究[J]. 材料导报:纳米与新材料专辑,2012,25(2):468-469.
[13]张彦灼,任珺,陶玲,等. 凹凸棒石粘土的物化性质研究进展[J]. 中国非金属矿工业导刊,2013(1):24-26.
[14]Fu B,Liu J,Li H,et al. The application of macroporous resins in the separation of licorice flavonoids and glycyrrhizic acid[J]. Journal of Chromatography A,2005,1089(1):18-24.
[15]Wu S,Jin Z,Kim J M,et al. Downstream processing of pullulan from fermentation broth[J]. Carbohydrate polymers,2009,77(4):750-753.
[16]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical biochemistry,1976,72(1):248-254.
[17]孙明礼,付会鹏,张静. 半枝莲多糖脱色及清除羟基自由基作用的研究[J]. 离子交换与吸附,2008,24(4):305-312.
[18]朱健,王平,罗文连,等. 硅藻土对Fe3+的吸附性能及热力学研究[J]. 中南林业科技大学学报:自然科学版,2011,30(12):108-115.
Decolorization and deproteinization of pullulan from fermentation broth
HE Xiao-han,WANG Hai-zeng*,HAO Hua-wei,GAO Xue-li
(Key Laboratory of Marine Chemistry Theory and Technology,Ministry of Education,College of Chemistry and Chemical Engineering,Ocean University of China,Qingdao 266100,China)
There are many problems in decolorization and deproteinization of pullulan from fermentation broth,such as large toxic organic reagents usage,high repetition times and easy polysaccharide degradation etc. To solve these issues,study for the decolorization and deproteinization of pullulan was developed through static adsorption tests of D4020 macroporous resins,diatomite and attapulgite. This paper investigated how the ratios of decolorization,deproteinization and polysaccharide recovery changed along with the adjustments of adsorption time,temperature,pH and dosage. The results showed that these three kinds of adsorbents all performed well in adsorbing the impurities,and diatomite was the most suitable one. Based on the single factor experiment,diatomite was then chosen for the orthogonal experiment. The results showed that the optimal processing conditions were as follows:60min adsorption time,35℃ adsorption temperature,pH value 3.2 and 1.6% diatomite. Under such conditions,the decolorization ratio was 80.17%,the deproteinization ratio was 76.28% and the polysaccharide recovery ratio was 89.82%.
adsorption;decolorization;deproteinization;pullulan;fermentation broth
2014-07-14
贺晓晗(1990-),女,硕士,研究方向:多糖的纯化及其性质研究。
*通讯作者:王海增(1965-),男,博士,教授,研究方向:海水化学资源的综合利用研究。
国家863计划项目(2012AA021505)。
TS201.1
A
1002-0306(2015)07-0138-06
10.13386/j.issn1002-0306.2015.07.021
