血浆多巴胺β羟化酶与阿尔茨海默病相关性研究
2015-05-08朱言亮
孟 云,朱言亮
(襄阳市中心医院神经内科,湖北襄阳441021)
血浆多巴胺β羟化酶与阿尔茨海默病相关性研究
孟 云,朱言亮*
(襄阳市中心医院神经内科,湖北襄阳441021)
阿尔茨海默病(AD)是一种神经退行性紊乱疾病,表现为记忆缺失和认知功能损伤,由于人的寿命普遍延长,老龄化是AD的主要危险因子之一,65岁以上的人群发病率急剧上升[1],目前,所有关于AD病因的假说均不能解释其全部病理特征,AD是遗传兼环境等多因素相互作用的复杂疾病,神经影像研究发现大脑皮质和海马及其他脑区有明显的萎缩,早期胆碱能神经系统功能丧失[2-4],AD患者脑干血清素能及去甲肾上腺素能神经元胞核缺失表明这些神经递质系统在AD发病过程中起着重要作用[3]。其中,去甲肾上腺素能神经系统与AD的病因与疾病进程相关,但其从中所起的作用并不明确,多巴胺β羟化酶(DBH)作为一种儿茶酚胺合成酶,对去甲肾上腺素的合成与更新发挥着重要作用,在基因的调控下,血浆DBH的活性在不同个体间表现出广泛的遗传性,DBH可调节NA水平,但这一作用对AD的发生与疾病进程的影响却尚不清楚,在AD患者中,海马和皮质中DBH活性减低,可能是970T等位基因和随后降低的DBH活性使去甲肾上腺素(NA)的合成减少并失去了神经保护作用,因而,血浆DBH很可能是AD疾病发展和认知功能损伤的生物标志物,由于血浆DBH活性受基因型控制,因而本研究通过测定患者血浆DBH活性及C-970T和C1603TDBH基因多态性,以阐明DBH调节NA对AD疾病进程的影响。
1 对象与方法
1.1 研究对象
2011年4月至2013年10月来本院接受治疗的285名AD患者,患者均属晚发散发型AD,年龄为63-95岁,平均年龄82±6.9岁,其中124名男性患者,161名女性患者;健康志愿者124名,年龄为64-96岁,平均年龄78.0±8.1岁,其中男性34人,女性90人,AD的诊断按照美国精神病学会制定的DSM-IV痴呆诊断标准和美国神经病学会制定的NINCDS-ADRDA老年性痴呆诊断标准,所有受试者均接受问询以排除轴I精神障碍并评估当前和过去的治疗状况,排除AD患者和健康对照组中诊断患有严重心脏病、癫痫、脑创伤和癌症者;主要功能性精神障碍,如抑郁和精神分裂症;高血压、吸烟及酗酒。患者服用胆碱酯酶抑制剂或抗精神病药,但采血前停止用药5天,患者认知状况评价采用MMSE评分法,健康对照组评分为25-30平均值为28.46±2.24,AD患者评分为0-23,平均值为10.87 ±9.05,依据该评分进一步将AD患者分为3组,其中发病早期患者75人,评分为18-24,平均值为20.54±2.13,中期108人,评分为11-18,平均值为13.68±2.16,晚期102名,评分为0-10,平均值为2.01±3.11。
1.2 指标检测
常规方法采血,每人采血4mL于含有1mL的抗凝剂的采血管中,血样3 500r/min离心10分钟,-20℃冰箱保存备用,血浆DBH活性检测采用ELISA法,其操作严格按照多巴胺β羟化酶活性检测试剂盒(上海研晶生化试剂有限公司,E-ELH1226)进行。血液样品DNA的提取采用盐析法,DBH(C-970T)、DBH(C 1603T)及ApoE(rs7412)多态性基因型采用ABI Prism 7000型基因测序仪进行测定,按照美国应用生物系统公司描述的步骤进行操作,引物和探针购自博奥生物有限公司。
1.3 统计学分析
2 结果
2.1 两组患者血浆DBH活性比较 见表1。
2.2 两组患者C-970T和C1603T DBH基因多态性分布比较
AD患者与健康对照组的DBH(C-970T)基因型多态性分布未出现明显漂变(χ2=0.619,P>0.05),符合Hardy-Weinberg平衡;AD患者与健康对照组DBH(C1603T)基因型多态性分布也未出现明显漂变(χ2=4.233,P>0.05)。AD患者C-970T DBH和C1603TDBH多态性的基因型和T等位基因(CT+TT)载体频率与健康对照组相比无显著性差异(P>0.05),见表2。
表1 健康对照组与AD组血浆DBH活性比较(±s)
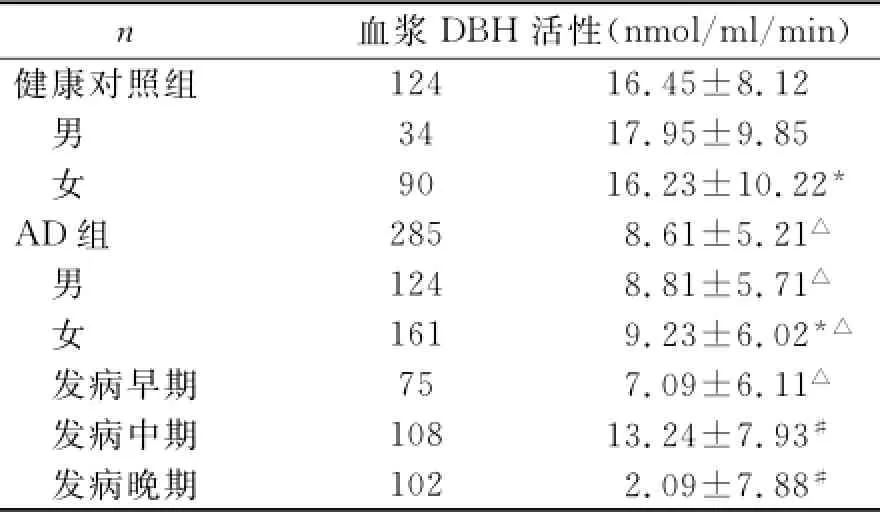
表1 健康对照组与AD组血浆DBH活性比较(±s)
与男性比较*P>0.05,与对照组比较△P<0.05,早期AD患者与中晚期AD患者比较#P<0.05
n血浆DBH活性(nmol/ml/min)124 16.45±8.12男34 17.95±9.85女90 16.23±10.22*AD组285 8.61±5.21△男124 8.81±5.71△女161 9.23±6.02*△发病早期75 7.09±6.11△发病中期108 13.24±7.93#发病晚期102 2.09±7.88健康对照组#

表2 健康对照组与AD组C-970T和C1603T DBH基因多态性分布构成比
2.3 两组C-970T和C1603T不同基因型患者血浆DBH活性
在AD患者组中,DBH(C-970T)基因型CC、CT、TT载体组患者血浆DBH活性分别为11.26 ±5.12nmol/min/ml、6.51±4.26nmol/min/ml和3.31±3.01nmol/min/ml,三组间两两比较均具有显著性差异(P<0.01),DBH(C-970T)基因型CC、CT、TT载体健康对照组血浆DBH活性分别为21.01±10.34nmol/min/ml、11.66±7.78nmol/min/ml和4.68±1.57nmol/min/ml,三组间两两比较均具有显著性差异(P<0.01)。在AD患者组中,DBH(1603T)基因型CC、CT、TT载体组患者血浆DBH活性分别为9.38±6.11nmol/min/mL、6.13±3.43nmol/min/mL和5.75±1.78nmol/min/mL,三组间两两比较无显著性差异(P>0.05);在健康对照组中,DBH(1603T)基因型CC、CT载体组患者血浆DBH活性分别为15.31± 11.02nmol/min/ml、12.48±6.03nmol/min/ml和11.22±2.17nmol/min/mL,三组间两两比较亦无显著性差异(P>0.05)。见表3。
表3 健康对照组与AD组C-970T和C1603T不同基因型患者血浆DBH活性(±s)
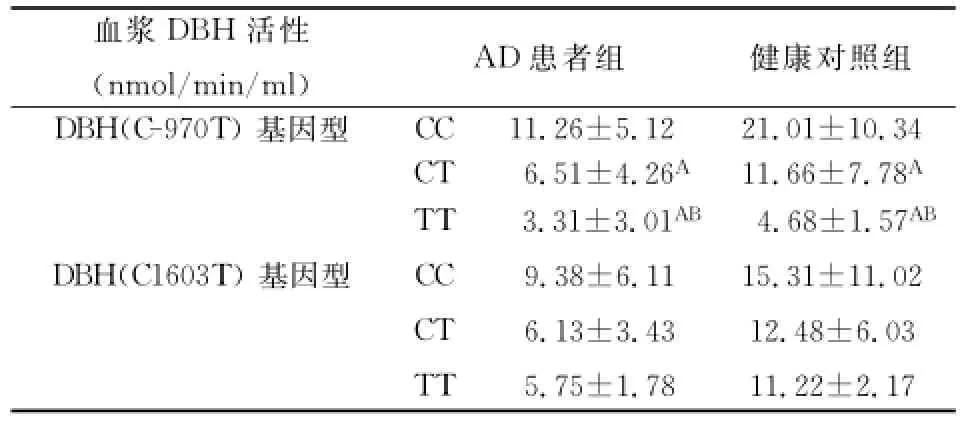
表3 健康对照组与AD组C-970T和C1603T不同基因型患者血浆DBH活性(±s)
注:A表示与CC组比,P<0.01;B表示与CT组比,P<0.01
患者组健康对照组DBH(C-970T)基因型血浆DBH活性(nmol/min/ml)AD CC 11.26±5.12 21.01±10.34 CT 6.51±4.26A11.66±7.78ADBH(C1603T)基因型4.68±1.57AB15.31±11.02 12.48±6.03 11.22±2.17 TT CC CT TT 3.31±3.01AB9.38±6.11 6.13±3.43 5.75±1.78
2.4 DBH C-970T和C1603T多态性对AD患者DBH活性的影响
为了进一步明确基因对血浆DBH活性的影响,对DBH C-970T和C1603T多态性对DBH活性的作用进行了评价,双因素方差分析DBH C-970T多态性与分期诊断对血浆DBH活性影响表明,分期诊断(F=24.734,P<0.01)和基因型(F=47.765,P<0.01)均对血浆DBH活性有明显影响,但分期诊断与基因型间无明显相互作用(F=0.281,P>0.05),早、中、晚期AD患者CC、CT和TT基因型频率亦无显著性差异;通过调整年龄、性别及ApoE4等位基因等因素进行回归分析表明,AD与DBH C-970T基因型CC和T等位基因之间无明显相关性(OR=1.12,95%CI 0.86-4.35,P>0.05);双因素方差分析DBH C1603T多态性与分期诊断对血浆DBH活性影响表明,DBH C1603T基因型(F=4.304,P<0.05)和分期诊断(F=13.240,P<0.01)均对血浆DBH活性具有明显影响,但二者之间无明显相互作用(F=0.004,P>0.05),通过调整年龄、性别及ApoE4等位基因等因素进行回归分析表明,AD与DBH C1603T基因型CC和T等位基因之间无明显相关性(OR=0.91,95%CI 0.35-2.23,P>0.05)。
3 讨论
去甲肾上腺素能神经系统有两个主要部分,一个源于腹侧被盖区的去甲肾上腺素能细胞体,主要参与性行为和饮食行为,另一个源于蓝斑,与学习、记忆和认知功能相关[5,6],蓝斑去甲肾上腺素能神经元缺失与胞外β淀粉样蛋白(Aβ)沉积增加[6]、AD早期神经纤维异常、发病及持续性痴呆[7]有关,在AD患者的多个脑区NA浓度明显降低[8],另外,AD脑脊液NA水平升高支持了胆碱能神经和去甲肾上腺素能神经元缺失产生代偿的假说[8,9],一些研究认为NA不仅是AD的危险因子,而且是真正的病原因子[7,10,11,12],除作为神经递质,NA还是内源性抗炎物质,通过激活小胶质细胞来抑制炎症[13],因此,说明蓝斑神经细胞死亡与NA介导的抗炎蛋白缺失可使炎症加剧,从而导致AD的发生。
多巴胺β羟化酶(DBH)可催化多巴胺对NA的氧化羟化,DBH存在于去甲肾上腺素能神经元、外周神经节后交感神经元及肾上腺髓质,是突触囊泡内唯一的儿茶酚胺合成酶,以游离和膜结合状态存在,DBH与NA可通过胞吐作用共同释放,可在脑脊液、血浆及血清中检测到,血浆DBH活性受遗传因素调控,其个体差异大,血浆DBH活性非常稳定,不会因机体活动等发生变化,单核苷酸多态性分析DBH基因启动子C-970T区可解释30%-50%的DBH活性差异,而且等位基因T-970可通过共显性遗传降低血浆DBH的活性[14],后者似乎能够解释血浆DBH活性差异,但内含子11中C1603T多态性的作用几乎没有[15,16]。
本研究结果表明,与相同年龄条件下的健康对照组相比,AD患者血浆DBH活性的降低并不依赖于基因型,从血浆DBH活性与AD的严重程度的关系来看,AD发病初患者蓝斑去甲肾上腺素能神经元能够增加NA产生的活性,显然是去甲肾上腺素能神经元缺失的一种代偿作用,这一研究结果表明AD患者早期应用选择性去甲肾上腺素重摄取抑制剂治疗使蓝斑缺失的去甲肾上腺素能神经元得到补偿,后期将继续研究DBH活性变化对去甲肾上腺素能神经元缺失的代偿机制。
[1]Alzheimer's Association.2010Alzheimer's disease facts and figures[J].Alzheimers Dement,2010,6:158.
[2]Giacobini E.Cholinergic function and Alzheimer's disease[J].Int J Geriatr Psychiatry,2003,18:S1.
[3]Lyness SA,Zarow C,Chui HC.Neuron loss in key cholinergic and aminergic nuclei in Alzheimer disease:a meta-analysis[J].Neurobiol Aging,2003,24:1.
[4]Wenk GL.Neuropathologic changes in Alzheimer's disease[J].J Clin Psychiatry,2003,64:7.
[5]Grudzien A,Shaw P,Weintraub S,et al.Locus coeruleus neurofibrillary degeneration in aging,mild cognitive impairment and early Alzheimer's disease[J].Neurobiol Aging,2007,28:327.
[6]Heneka MT,Nadrigny F,Regen T,et al.Locus ceruleus controls Alzheimer's disease pathology by modulating microglial functions through norepinephrine[J].Proc Natl Acad Sci USA,2010,107:6058.
[7]Counts SE,Mufson EJ.Noradrenaline activation of neurotrophic pathways protects against neuronal amyloid toxicity[J].J Neurochem,2010,113:649.
[8]Herrmann N,Lanctot KL,Khan LR.The role of norepinephrine in the behavioral and psychological symptoms of dementia[J].J Neuropsychiatry Clin Neurosci,2004,16:261.
[9]Giubilei F,Calderaro C,Antonini G,et al.Increased lymphocyte dopamine beta-hydroxylase immunoreactivity in Alzheimer's disease:compensatory response to cholinergic deficit[J].Dement Geriatr Cogn Disord,2004,18:338.
[10]Fitzgerald PJ.Is elevated norepinephrine an etiological factor in some cases of Alzheimer's disease?[J].Curr Alzheimer Res,2010,7:506.
[11]Weinshenker D.Functional consequences of locus coeruleus degeneration in Alzheimer's disease[J].Curr Alzheimer Res,2008,5:342.
[12]McMillan PJ,White SS,Franklin A,et al.Differential response of the central noradrenergic nervous system to the loss of locus coeruleus neurons in Parkinson's disease and Alzheimer's disease[J].Brain Res,2011,1373:240.
[13]Szot P,White SS,Greenup JL,et al.Compensatory changes in the noradrenergic nervous system in the locus ceruleus and hippocampus of postmortem subjects with Alzheimer's disease and dementia with Lewy bodies[J].J Neurosci,2006,26:467.
[14]Heneka MT,O'Banion MK.Inflammatory processes in Alzheimer's disease[J].J Neuroimmunol,2007,184:69.
[15]Zabetian CP,Buxbaum SG,Elston RC,et al.The structure of linkage disequilibrium at the DBH locus strongly influences the magnitude of association between diallelic markers and plasma dopamine beta-hydroxylase activity[J].Am J Hum Genet,2003,72:1389.
[16]Tang Y,Anderson GM,Zabetian CP,et al.Haplotype-controlled analysis of the association of a non-synonymous single nucleotide polymorphism at DBH(+1603C→T)with plasma dopamine beta-hydroxylase activity[J].Am J Med Genet B Neuropsychiatr Genet,2005,139B:88.
2014-10-22)
1007-4287(2015)09-1505-03
*通讯作者
