含伯胺基二苯甲酮紫外线吸收剂的合成及表征
2015-05-08崔志华汪仁良陈维国b
郑 旭, 崔志华, 汪仁良, 陈维国b
(1. 浙江理工大学, a. 先进纺织材料与制备技术教育部重点实验室; b. 生态染整技术教育部工程研究中心, 杭州 310018; 2. 浙江龙盛集团股份有限公司, 浙江 上虞 312368)
含伯胺基二苯甲酮紫外线吸收剂的合成及表征
郑 旭1a, 崔志华1, 汪仁良2, 陈维国1b
(1. 浙江理工大学, a. 先进纺织材料与制备技术教育部重点实验室; b. 生态染整技术教育部工程研究中心, 杭州 310018; 2. 浙江龙盛集团股份有限公司, 浙江 上虞 312368)
以二苯甲酮紫外线吸收剂UV-9为原料,硫酸和硝酸组成的混酸为硝化试剂,并以二氧化硫脲为还原剂,通过硝化反应和还原反应合成了一种分子内含有伯胺基的二苯甲酮紫外线吸收剂DP-1。研究表明,硝化反应采用以浓硫酸为介质的均相硝化法,2-羟基-4-甲氧基二苯甲酮与浓硝酸的摩尔比为1∶1.2,在反应温度体系为0~10℃下进行4 h,能取得良好收率;还原反应采用硝化产物、二氧化硫脲和氢氧化钠的摩尔比为1∶5∶11,在反应温度为80℃下进行2 h,效果良好。通过红外光谱、质谱、核磁氢谱、紫外-可见光谱和液相色谱等手段,对硝化产物和还原产物DP-1进行了结构表征,表明其结构与设计相符。
二苯甲酮; 硝化; 还原; 紫外线吸收剂; 合成
0 引 言
随着经济社会的发展,臭氧层被破坏,到达地球表面的紫外线辐射量也随之增大,致使人体皮肤和各种有机材料受到了越来越多的损害。为了减少紫外线带来的危害,人们通常采用添加紫外线吸收剂的方法来保护材料。紫外线吸收剂能够吸收紫外线并进行能量转换,将紫外线变成低能量的热能或波长较长的电磁波,从而达到防紫外辐射的目的[1],其中以二苯甲酮类和苯并三唑类的紫外线吸收剂应用最为广泛。就纺织材料领域而言,以蚕丝、羊毛为代表的蛋白质纤维,由于自身结构中含有酪氨酸等易于发生光氧化反应的残基,更容易出现光致泛黄、脆损等问题[2]。但传统的紫外线吸收剂大多数通过物理吸附、粘合、交联、掺杂等手段与纺织纤维结合[3],通常存在着与织物结合牢度差、耐久性不佳或手感、透气性差等问题,影响织物的服用性能。
针对蛋白质纤维耐光稳定性差和传统紫外线吸收剂在应用过程中存在的问题,一些研究人员在合成紫外线吸收剂的过程中尝试引入一些能与蛋白质纤维发生化学反应的反应性基团,并通过化学反应与蛋白质纤维形成共价键结合,该方法既能提高织物耐光稳定性,又不影响手感及其它服用性能。唐金波等[4]合成了一种可反应的水溶性苯并三唑紫外线吸收剂,能与羊毛纤维上的氨基以共价键结合;潘冬辉[5]合成了一种含有伯胺基的苯并三唑紫外线吸收剂,通过重氮和偶合反应与蚕丝上的酪氨酸残基形成偶氮键。以上两种方法能够较好地解决紫外线吸收剂在蛋白质纤维上的耐久性和手感问题。
作为一种重要的中间体,含有芳伯胺基的紫外线吸收剂不仅容易引入反应性基团将其制成反应性光稳定剂,还可以通过重氮化偶合的方法修饰蛋白质纤维。鉴于含有芳伯胺基的紫外线吸收剂的通用性,本文将采用紫外线吸收剂2-羟基-4-甲氧基二苯甲酮(UV-9)作为原料,通过硝化反应[6]引入硝基,然后通过还原反应[7]将硝基还原成氨基,最终合成一种含有二苯甲酮光稳定片段的芳伯胺衍生物DP-1。
1 试 验
1.1 实验材料与仪器
实验材料:UV-9、硫酸、硝酸、二氧化硫脲、盐酸、氢氧化钠、无水乙醇(均为市售分析纯)。
仪器:Nicolet 5700型傅立叶红外光谱仪(美国尼高力公司)、AVANCE-400 MHz核磁共振波谱仪(瑞士布鲁克公司)、Agilent1260型液相色谱仪(美国安捷伦公司)、LCQ-Fleet质谱仪(美国赛默飞公司)、Cany紫外/可见分光光度计(美国瓦里安公司)。
1.2 二苯甲酮类紫外线吸收剂DP-1的合成
本实验合成一种分子内含有二苯甲酮光稳定片段的芳伯胺衍生物DP-1。其合成路线见图1,具体为:
a) 硝化反应:在100 mL三口烧瓶中加入15.1 mL浓硫酸,然后向其中缓缓加入2.3 g(0.01 mol)紫外线吸收剂UV-9,体系温度保持在0~10℃。向三口烧瓶中缓慢滴加含1 mL(0.012 mol)浓硝酸,滴加完后保持体系温度继续反应4 h,反应结束后用冰水析出,并用水洗至中性,抽滤并烘干,得到淡黄色硝化产物A。
b) 还原反应:称取2.8 g(0.01 mol)UV-9硝化产物A和4.4 g(0.11 mol)NaOH溶于25 mL乙醇和25 mL去离子水的混合溶液中,室温搅拌均匀后升温至70℃,在10 min内分次加人5.4 g(0.05 mol)二氧化硫脲,继续保温反应2 h。反应结束后自然冷却至室温,然后向反应溶液中缓慢滴加1.5 mL(5 mol/L)的HCl,充分搅拌,pH调至近中性,冷却静置0.5 h,抽滤并减压干燥,得到UV-9硝化还原产物DP-1。

图1 二苯甲酮紫外线吸收剂DP-1的合成路线
1.3 HPLC分析实验
样品浓度:150 mg/kg,流速:1.0 mL/min,进样量:20μL,柱温:30℃,最大压力为26 MPa,梯度:0~9 min流动相比例8 mmol/L甲酸水溶液∶乙腈=95∶5到5∶95,9~12 min流动相比例维持在8 mmol/L甲酸水溶液∶乙腈=5∶95,检测波长为276 nm。
1.4 傅立叶红外光谱分析实验
取少量待测样品于研钵中,研磨成均匀粉状,制成KBr压片,然后在Nicolet 5700型傅立叶红外光谱仪上进行FT-IR测试,分辨率为4 cm-1,扫描次数32次。
1.5 核磁共振氢谱分析实验
取5~20 mg的待测样品溶解在0.6 mL左右的氘代氯仿溶剂中,转移至核磁管中,用AVANCE-400 MHz型核磁共振波谱仪进行测试。
1.6 质谱分析实验
取0.1 g待测样品于烧杯中,用10 mL N,N-二甲基甲酰胺将其溶解配成溶液。用滴管吸取约1 mL溶液于烧杯中,并用N,N-二甲基甲酰胺将其稀释至近无色,用10 μL进样针注射进样,用LCQ-Fleet质谱仪进行测试。
2 结果与讨论
2.1 硝化产物A的结构表征与分析
2.1.1 硝化产物A的红外光谱分析
如图2所示,3 345 cm-1为羟基的—O—H伸缩振动吸收峰;2 950、2 838 cm-1为甲基中的—C—H的伸缩振动吸收峰;1 634 cm-1为羰基中的—C—O伸缩振动吸收峰;1 529、1 343 cm-1为—NO2伸缩振动吸收峰;1 015 cm-1为甲氧基的—C—O伸缩振动吸收峰。通过分析红外光谱各基团的特征吸收峰,表明UV-9的硝化产物A存在。

图2 硝化产物A的红外光谱图
2.1.2 硝化产物A的质谱分析
对硝化产物A进行质谱分析,在m/z 272.1处出现了一个很强的[M-H]-准分子离子峰,这是产物失去一个氢后的分子量,从而可以确定产物的分子量为273.1,这与产物的理论分子量273.1相符。
2.1.3 硝化产物A的核磁谱图分析
从图3可以看出,δ12.99处显示一个质子单峰,这是1号位羟基中的氢与羰基中的氧形成一个六元环,导致其化学位移向低场移动,故可确定δ12.99处为1号位羟基中氢的质子归属;在δ8.40处显示一个质子单峰,可初步确定为7号位的氢,其受到吸电子基硝基和羰基的影响,化学位移向低场移动,故确定δ8.40处为7号位氢的质子归属;从UV-9硝化产物的分子结构来看,2和6号位氢的化学环境相同,3和5号位氢的化学环境相同,2和3号位氢相互耦合裂分为二重峰,6和5号位氢相互耦合裂分为二重峰,同时3和5号位的氢还受到4号位氢的影响,耦合裂分成多重峰,故可确定δ7.58~δ7.54处为3和5号位氢的质子归属;4号位氢与2和6号位氢化学位移重叠,在δ7.68~7.63处质子数为3,与2、6和4号位的质子数之和相吻合,故δ7.68~7.63处为2、6和4号位氢的质子归属;在δ6.66处显示出一个质子单峰,这是9号位的氢受到供电子基甲氧基和羟基的影响,化学位移向高场移动,故确定δ6.66处为9号位氢的质子归属;δ4.04处显示出质子单峰且质子数为3,故可确定δ4.04为8号位氢的质子所属;在δ3.98和δ12.93处各有一个伴峰的出现,推测可能是由于一部分硝化产物中的硝基连接在9号位的碳上,对8号位和1号位上氢的化学位移造成了一定的影响;δ1.58为水的质子峰,δ7.26为CDCl3的溶剂峰。

图3 硝化产物A的核磁谱图
2.1.4硝化产物A的液相色谱分析
图4是UV-9原样和硝化产物A的液相色谱图。从图4(a)中可以看出,UV-9原样的保留时间为10.7 min,峰面积为99.9%;从图4(b)中可以看出,硝化产物A的保留时间为10.0 min,峰面积为89.9%。对比两者可知,大部分的UV-9都发生了硝化反应,但是还有少量的UV-9未被硝化。

图4 UV-9原样和硝化产物A的液相色谱图
2.2 DP-1的结构表征与分析
2.2.1 DP-1的红外光谱分析


图5 DP-1的红外光谱图
2.2.2 DP-1的质谱分析
从图6中可以看出:在M/Z242.2处出现产物很强的[M-H]-准分子离子峰,这是产物失去一个氢后的分子量,从而可以确定产物的相对分子质量为243.2,这与产物的理论相对分子质量243.1相符。

图6 DP-1的质谱谱图
2.2.3 DP-1的核磁谱图分析
从图7可以看出,δ12.37处显示一个质子单峰,这是1号位羟基中的氢与羰基中的氧形成一个六元环,导致其化学位移向低场移动,故可确定δ12.37处为1号位羟基中氢的质子归属;从DP-1的分子结构来看,2和6号位氢的化学环境相同,3和5号位氢的化学环境相同,2和3号位氢相互耦合裂分为二重峰,6和5号位氢相互耦合裂分为二重峰,同时3和5号位的氢还受到4号位氢的影响,耦合裂分成多重峰,故可确定δ7.64、δ7.62处为2和6号位氢的质子归属,δ7.50~δ7.46处为3和5号位氢的质子归属;4号位氢与2和6号位氢相互耦合裂分形成一组双重峰,故可确定δ7.55~δ7.53处为4号位氢的质子归属;在δ6.86处显示一个质子单峰,可初步确定为7号位的氢,其受到吸电子基羰基的影响和供电子基氨基的影响,化学位移向低场移动,故确定δ6.86处为7号位氢的质子归属;在δ6.50处显示出一个质子单峰,这是10号位的氢受到供电子基甲氧基和羟基的影响,化学位移向高场移动,故确定δ6.50处为10号位氢的质子归属;δ3.93处显示出质子单峰且质子数为3,故可确定δ3.93为9号位氢的质子所属;在δ3.49处显示出质子单峰且质子数为2,为8号位氨基上氢的质子归属;δ1.62为水的质子峰,δ7.26为CDCl3的溶剂峰。

图7 DP-1的核磁谱图
2.2.4 DP-1的液相色谱分析
图8是DP-1的液相色谱图。从图中可以看出,DP-1的保留时间为7.5 min,峰面积为64.9%,硝化产物A的保留时间为10.0 min,峰面积为18.3%。与图4(b)硝化产物A的液相色谱图对比可知,通过还原反应,UV-9硝化产物A大部分已经被还原,但是还有一部分硝化产物未被还原。

图8 DP-1的液相色谱图
2.2.5 DP-1的紫外-可见光谱图分析
图9是二苯甲酮类紫外线吸收剂UV-9和DP-1的紫外-可见吸收光谱图。从图9(a)中可以看出UV-9原样在276 nm有最大吸收峰,在322 nm处有较强的吸收,符合二苯甲酮类紫外线吸收剂双吸收峰的特征。在可见光区基本上没有吸收,说明UV-9无明显颜色。由图9(b)可以看出DP-1在230~275 nm范围内有较强的吸收,但是无明显差别;在322 nm附近也有较强的吸收,但是在可见光区内也有一部分吸收。对比两者的区别可以看出,DP-1的二苯甲酮类紫外吸收剂双吸收峰特征已不明显,分析认为可能是由于氨基的引入,对分子的共轭体系以及分子内原子的电子云密度产生较大的影响,所以导致了吸收区域和吸收峰的改变,而且硝化还原产物DP-1的颜色也变成了浅黄色。
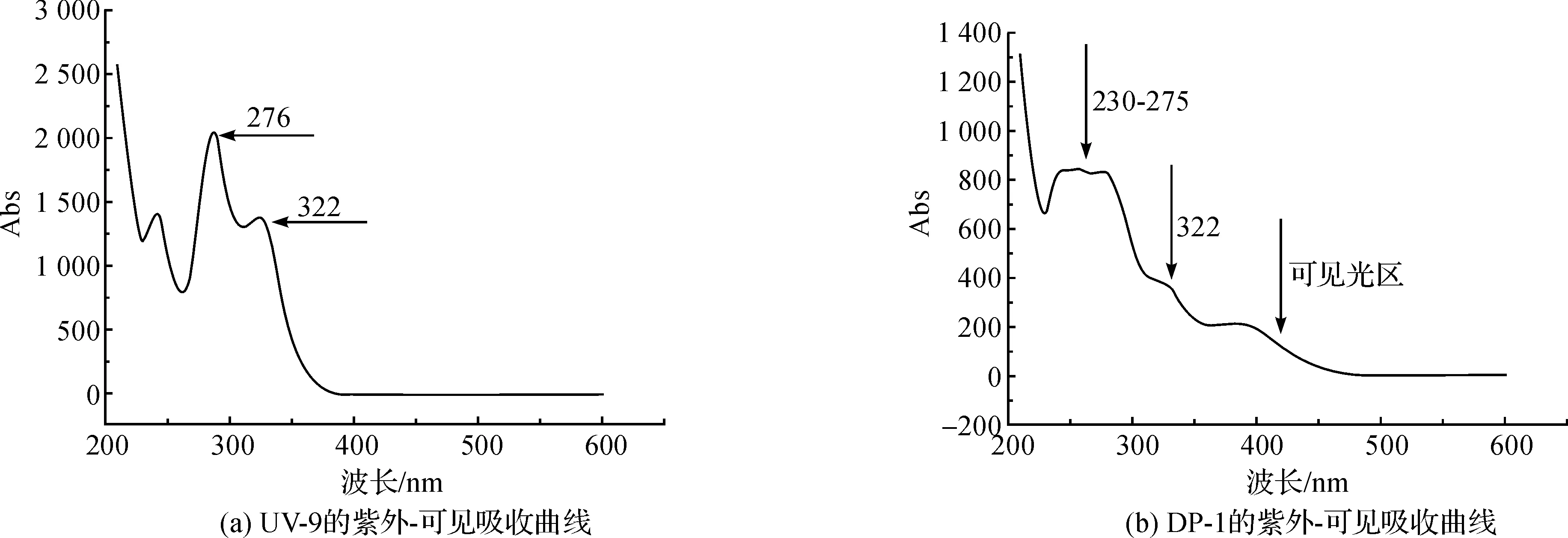
图9 UV-9和DP-1的紫外-可见吸收光谱
2.3 还原反应的投料摩尔比工艺优化
对还原反应的投料摩尔比进行了工艺优化,其结果见表1。如表所示,当UV-9硝化产物、二氧化硫脲与氢氧化钠的摩尔比为1∶5∶11时,DP-1所占的峰面积最大;当UV-9硝化产物、二氧化硫脲与氢氧化钠的摩尔比为1∶4∶9时,DP-1所占的峰面积为47.1%,分析认为可能是由于二氧化硫脲和氢氧化钠的用量不够,导致收率偏低;当UV-9硝化产物、二氧化硫脲与氢氧化钠的摩尔比为1∶6∶13时,DP-1所占的峰面积与UV-9硝化产物、二氧化硫脲与氢氧化钠的摩尔比为1∶5∶11时相近,分析认为继续提高二氧化硫脲与碱的用量,有可能引起副反应的发生,从而导致DP-1的收率略有下降。综上所述,对硝化产物进行还原反应时,UV-9硝化产物、二氧化硫脲与氢氧化钠的最佳投料摩尔比是1∶5∶11。

表1 不同投料摩尔比的还原反应结果对比
3 结 论
将二苯甲酮紫外线吸收剂UV-9,通过硝化和还原反应,在分子内引入一个通过化学反应能与蛋白质纤维形成共价键结合的芳伯胺基团。通过红外光谱、质谱、核磁氢谱、液相色谱、紫外-可见光谱等手段,对硝化产物A以及最终产物DP-1进行了表征,结果表明目标产物被成功合成。同时对还原反应的投料摩尔比进行了工艺优化,当UV-9硝化产物、二氧化硫脲与氢氧化钠的摩尔比为1∶5∶11时,反应收率最高。DP-1具有能和羊毛、蚕丝等蛋白质纤维进行化学反应,并最终通过化学键结合的方式固定在纤维上的潜质,在蛋白质纤维的抗紫外整理方面具有广阔的应用前景。
[1] 高 妍, 谢孔良. 纺织品防紫外线整理剂发展综述 (一)[J]. 染整技术, 2010, 32(12): 11-14.
[2] Millington K R. Photoyellowing of wool. part 1: factors affecting photoyellowing and experimental techniques[J]. Coloration Technology, 2006, 122(4): 169-186.
[3] 金 雅, 殷志剑, 朱 泉, 等. 反应性紫外线吸收剂研究进展[J]. 精细与专用化学品, 2007, 18(15) : 1-3.
[4] 唐金波, 陈维国, 崔志华. 毛用反应性紫外线吸收剂的应用性能[J]. 浙江理工大学学报, 2012, 29(4): 474-479.
[5] 潘东辉. 蚕丝蛋白质侧基偶合修饰及其光稳定性研究[D]. 杭州: 浙江理工大学, 2013.
[6] 张铸勇. 精细有机合成单元反应[M]. 上海: 华东化工学院出版社, 1990.
[7] 顾尚香, 姚卡玲. 二氧化硫脲对有机化合物的还原作用研究[J]. 有机化学, 1998, 18(2): 157-161.
(责任编辑: 许惠儿)
Synthesis and Characterization of Benzophenone UV Absorber Containing Primary Amino
ZHENGXu1a,CUIZhi-hua1,WANGRen-liang2,CHENWei-guo1b
(1a. Key Laboratory of Advanced Textile Materials and Manufacturing Technology, Ministry of Education of China; 1b. Engineering Research Center for Eco-Dyeing & Finishing of Textiles, Ministry of Education, Zhejiang Sci-Tech University, Hangzhou 310018, China, Hangzhou 310018; 2. Zhejiang Lonsen Group Co., Ltd., Shangyu 312368, China)
In this paper, Benzophenone UV absorber DP-1 containing primary amido was synthesized through nitration reaction and reduction reaction with benzophenone UV absorber UV-9 was raw material, mixed acid (composed of sulfuric acid and nitric acid) as nitration reagent and thiourea dioxide as the reducing agent. The research shows that we can obtain good yields under the following conditions: nitration reaction adopts homogeneous phase nitration method with concentrated sulfuric acid as the medium; the molar ratio of 2-hydroxy-4-methoxy benzophenone and concentrated nitric acid is 1∶1.2; the reaction temperature system is 0~10℃ for 4 h. The result of reduction reaction is good when the molar ratio of nitration product, thiourea dioxide and sodium hydroxide is 1∶5∶11 under the temperature of 80℃ for 2 h. In addition, structural characterization was conducted for nitration product and reduzate DP-1 through FTIR, mass spectrometry, nuclear magnetic resonance, ultraviolet-visible spectroscopy and HPLC. The result shows the structure complies with the design.
Benzophenone; nitration; reduction; ultraviolet absorber; synthesis
1673- 3851 (2015) 01- 0001- 05
2014-06-30
国家自然科学基金(21106315)
郑 旭(1990-),男,河南南阳人,硕士研究生,主要从事纺织品染整理论与新技术方面的研究。
崔志华,E-mail:zhhcui@zstu.edu.cn
TQ610.491
A
