超声波改性与MTGase诱导的大豆分离蛋白凝胶强度的研究
2015-05-07田海娟王蕾张智宇
田海娟,王蕾,张智宇
(1.吉林工商学院食品工程分院,吉林长春130062;2.吉林工商学院粮油食品深加工吉林省高校重点实验室,吉林长春130062;3.山东省食品药品检验研究院,山东济南250101)
大豆分离蛋白(Soy Protein Isolated,SPI)是大豆蛋白质含量在90%以上的粉状蛋白大豆产品[1]。在大豆蛋白的4个组分中,具有胶凝能力的只有7s和11s成分,又在硬度和组织性方面,11s组分胶凝性高于7s组分,导致这种现象的原因是由于这两个组分各自所含的巯基和二硫键数目不同以及胶凝过程中的变化不同所致。7s球蛋白和11s球蛋白的二级结构几乎没有什么区别,7s球蛋白是一个具有9个亚基的四元结构,在三级结构中,7s球蛋白中的每一个分子是以-SS-的形式结合;11s球蛋白在三级结构中,在一个分子内,大约有44个胱氨酸残基侧链,一部分以-SH形式存在,另一部分以-S-S-形式存在[2]。MTGase(微生物谷氨酰胺转移酶)会催化诱导大豆分离蛋白中的蛋白疏水基暴露,对大豆分离蛋白形成凝胶网络结构奠定了基础,其凝胶强度也相应增强。以大豆分离蛋白为原料,采用超声波物理改性处理手段与利用MTGase进行诱导制备凝胶、用单因素与正交试验设计的方法优化凝胶过程,并对比改性与未改性大豆分离蛋白凝胶强度的差别,以获得性能较好的凝胶,对大豆分离蛋白的工业化转化有现实的指导意义,同时为MTGase进一步在医药及食品领域的广泛研究提供参考。
1 材料与方法
1.1 材料
大豆分离蛋白(SPI):哈高科大豆食品有限责任公司;微生物谷氨酰胺转移酶(MTGase):江苏泰兴一鸣精细化工有限公司;其他试剂均为国产分析。
1.2 仪器与设备
超声波生化仪:广州省新动力超声电子设备有限公司;TA-XT2i型质构仪:美国Brookfield;恒温水浴锅:北京国华医疗器械厂。
1.3 方法
1.3.1 大豆分离蛋白溶液的制备
准确称量6.5 g的大豆分离蛋白粉,置于100 mL烧杯中,加入50 mL蒸馏水后,匀速并充分搅拌,使大豆分离蛋白溶液达到均匀、稳定状态。
1.3.2 未经超声波改性的大豆分离蛋白凝胶的制备
大豆分离蛋白凝胶的制备:将制备好的大豆分离蛋白溶液放入恒温水浴锅内,在90℃温度下加热40 min后,迅速将其从水浴锅中取出,并置于冰水浴中迅速冷却,直至形成凝胶,然后放入4℃条件下的冰箱内静置24 h[3]。
1.3.3 大豆分离蛋白凝胶性能的测定
利用制备好的凝胶,采用物性测试仪,探头类型圆柱型探头,探头型号为TA11(25.4 mm DIA、35 mm Long);前进速度:1.00 mm/s;冲压速度:0.5 mm/s;后退速度10.00 mm/s;冲压深度:5.00 mm;触发类型:自动;触发力:5.0 g;检测温度为室温,重复3次,取其平均值为试验结果[4]。
1.3.4 超声波预处理对SPI凝胶特性影响的研究
将探头浸入SPI样品液面以下2 cm并位于液面中间,同时将盛放样品的烧杯置于冰水浴中,采用超声波法对大豆分离蛋白分别从对时间和对功率的控制这两个因素对其强度的影响进行试验。超声处理时间t选择10min和20min,功率P选择150W和200W。
1.3.5 MTGase对超声改性后的大豆分离蛋白凝胶强度影响的研究
超声波预处理SPI条件依据1.3.4试验结果进行,用MTGase诱导制备大豆分离蛋白凝胶。在前期试验中发现,加热时间(t)、加热温度(T)、pH 和 MTGase的用量均对大豆分离蛋白凝胶强度有影响,所以选取这4个因素分别对大豆分离蛋白的凝胶强度进行单因素试验;在单因素试验基础上设计正交试验。
1.3.6 超声波改性处理与未改性的大豆分离蛋白MTGase诱导凝胶强度对比
经超声波处理过的大豆分离蛋白与未超声波处理的大豆分离蛋白,通过MTGase诱导研究其凝胶强度的差异。
2 结果与分析
2.1 超声波法对SPI凝胶强度影响的结果与分析
超声波对大豆分离蛋白的改性是物理改性的方法之一,超声波振荡处理后大豆分离蛋白分子的内部结构发生了变化,分子间的交互作用力加大,从而紧密交叉联系在一起,其凝胶强度也随之改变。超声波法对大豆分离蛋白凝胶强度影响见表1。
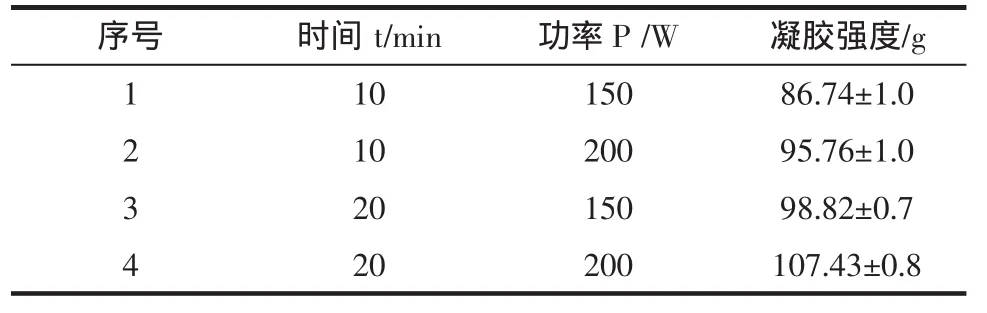
表1 超声波法对大豆分离蛋白凝胶强度影响的结果Table 1 The influence of ultrasonic method on the gel strength of soy protein isolated
由表1试验结果表明,随着超声时间的延长和功率的增加能提高凝胶强度,而超声处理功率更能影响到大豆分离蛋白的强度,因此,对于大豆分离蛋白的改性预处理选择的最佳条件是超声时间20 min、功率是200 W。
2.2 MTGase对SPI凝胶特性影响的研究
2.2.1 单因素试验结果
2.2.1.1 加热时间对MTGase诱导的SPI凝胶强度的影响
加热时间对MTGase诱导的SPI凝胶强度的影响见图1。
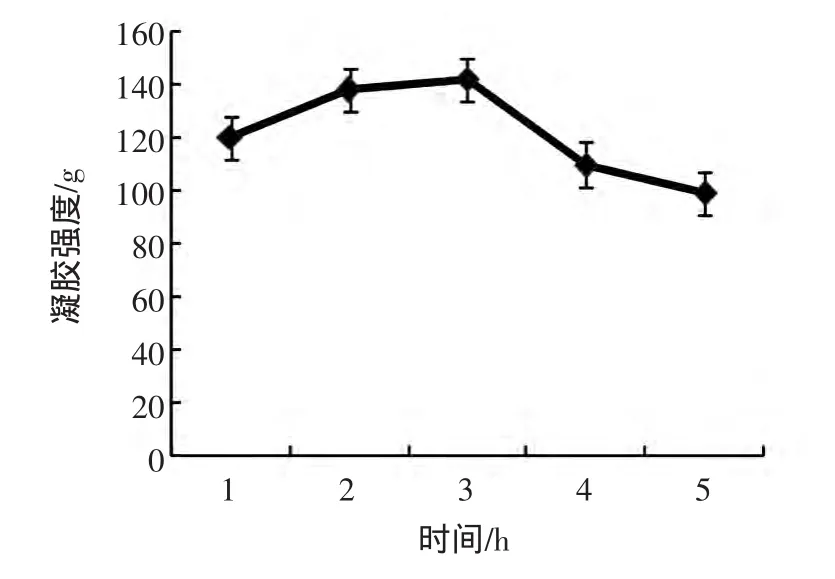
图1 作用时间对MTGase催化SPI凝胶强度的影响Fig.1 The effect of time on SPI gel strength induced by MTGase
从图1可知,当反应时间在1 h~3 h之间时,随着时间的延长,凝胶强度显著增加,在3 h时凝胶强度最显著可达到140 g。在3 h之后,继续延长反应的时间,凝胶强度呈现明显下降趋势,最终达到100 g。因为时间能影响酶促反应的进行,酶会有一个最合适它反应的时间,就在这段时间内,产物也会有所提高,随着时间的增加,酶的底物逐渐耗尽,酶的浓度也随之下降,便会影响大豆分离蛋白的凝胶性能,随着作用时间的延长,MTGase催化样品的反应越来越慢,导致大豆分离蛋白的凝胶强度呈下降趋势。
2.2.1.2 加热温度对MTGase诱导SPI凝胶强度的影响加热温度对MTGase诱导的SPI凝胶强度的影响见图2。
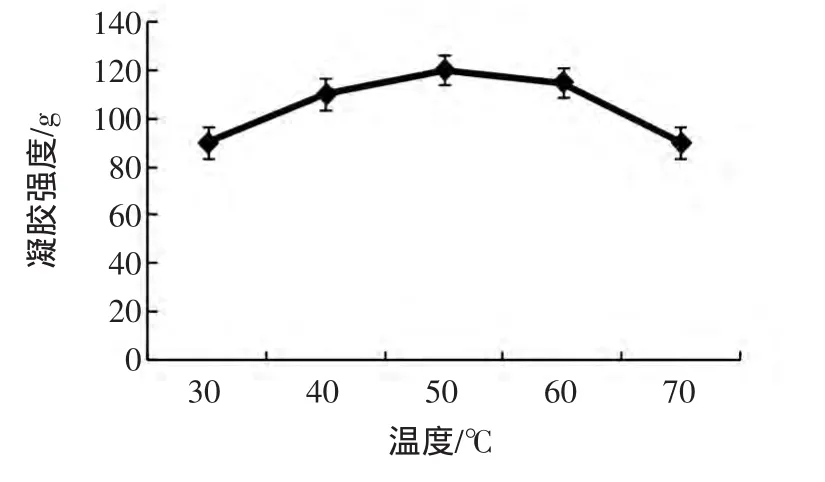
图2 反应温度对MTGase催化SPI凝胶强度的影响Fig.2 The effect of temperature on SPI gel strength induced by MTGase
从图2可以看出,起初随着加热温度的升高,凝胶强度有明显上升趋势,在30℃~50℃范围内,凝胶强度从最初的90 g达到最高为120 g,但50℃以后,呈下降趋势,到70℃时,凝胶强度已经降低到80 g。这是由于温度影响了酶的反应速度,一般升高温度,酶的反应速度就会加快,但温度超过一定数值后,反应速度不会再继续增加,而是受其他因素影响而减慢;加热温度还能影响酶的活性,影响MTGase的最适温度在50℃左右,如果加热时间过长,酶就会失去活性,失活就会导致变性,一旦变性便失去了原本的功能特性,会引起大豆分离蛋白的凝胶失去水分,蛋白质分子间的交联作用也会减弱,故导致大豆分离蛋白的凝胶强度的降低。
2.2.1.3 pH对MTGase诱导SPI凝胶强度的影响
pH对MTGase诱导的SPI凝胶强度的影响见图3。
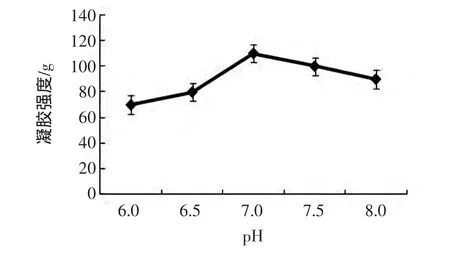
图3 pH对MTGase催化SPI凝胶强度的影响Fig.3 The effect of pH on SPI gel strength induced by MTGase
由图3可以得出,pH在6.0~6.5之间时,凝胶强度是有所增大的,从70 g增大到80 g,但是变化的不明显;随着pH的继续增大,当pH为7.0时,凝胶强度最大,达到了110 g;但从7.0以后,随着pH的继续增大,凝胶强度逐渐降低到90 g。说明pH在6.0~8.0范围内,大豆分离蛋白凝胶强度发生了显著的变化。研究表明:MTGase的最适pH范围是6.0~7.5,本试验结果与之基本一致。只有在特性的pH下,酶与底物才能完美的结合,pH过高或者过低都会降低酶的活性,从而影响大豆分离蛋白的强度,此外如果远离最适pH时,整个大豆分离蛋白溶液体系的稳定性、溶解性都会受到影响,导致反应的过程中蛋白质之间的静电作用和疏水作用的平衡受到影响,从而影响蛋白质分子间的凝胶网状结构。当pH的某一值适合该体系时,蛋白质分子多带的静电荷不会减少,此时酶的活性也适合体系的这种环境,较易形成有序的凝胶网状结构,所以增加了凝胶的强度。
2.2.1.4 MTGase用量对MTGase诱导SPI凝胶强度的影响
MTGase用量对MTGase诱导SPI凝胶强度的影响见图4。
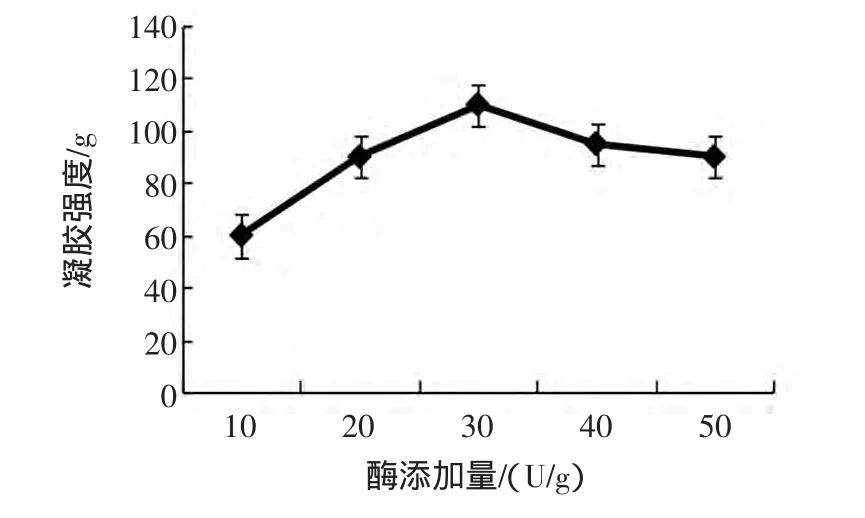
图4 酶添加量对MTGase催化SPI凝胶强度的影响Fig.4 The effect of enzyme amount on SPI gel strength induced by MTGase
由图4可知,酶的用量在10 U/g~30 U/g之间时,随着MTGase用量的增加,凝胶强度呈上升趋势较显著,从70 g最后达到110 g,酶添加量在30 U/g时,凝胶强度达到最大,即110 g;但在酶添加量30 U/g以后,继续增加酶的用量,凝胶强度突然下降,最后趋于平稳,达到80 g。这说明酶的添加量虽然能改善大豆分离蛋白的凝胶强度,但达到一定用量以后,继续添加就会妨碍蛋白质分子间形成凝胶的网络结构,因为被酶催化的蛋白质表面暴露出来的结合位点与酶很快结合在了一起,达到了饱和,而在这些蛋白质周围的蛋白质则没有机会与酶进行交联形成凝胶网络结构了,在分子外形成的交联对蛋白质的凝胶不起作用。
2.2.2 MTGase诱导凝胶正交试验结果与分析
由单因素试验结果,设计正交试验,因素水平见表2,结果见表3。
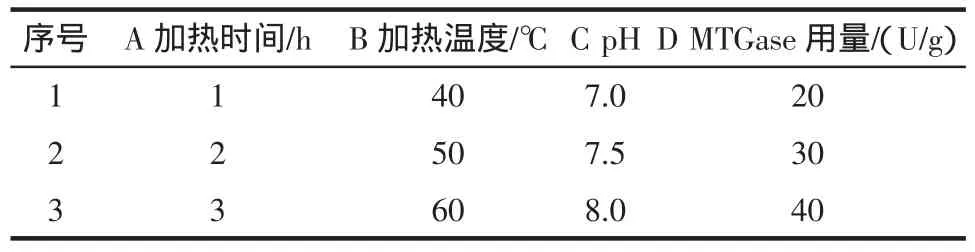
表2 正交试验因素水平Table 2 Orthogonal factor level table
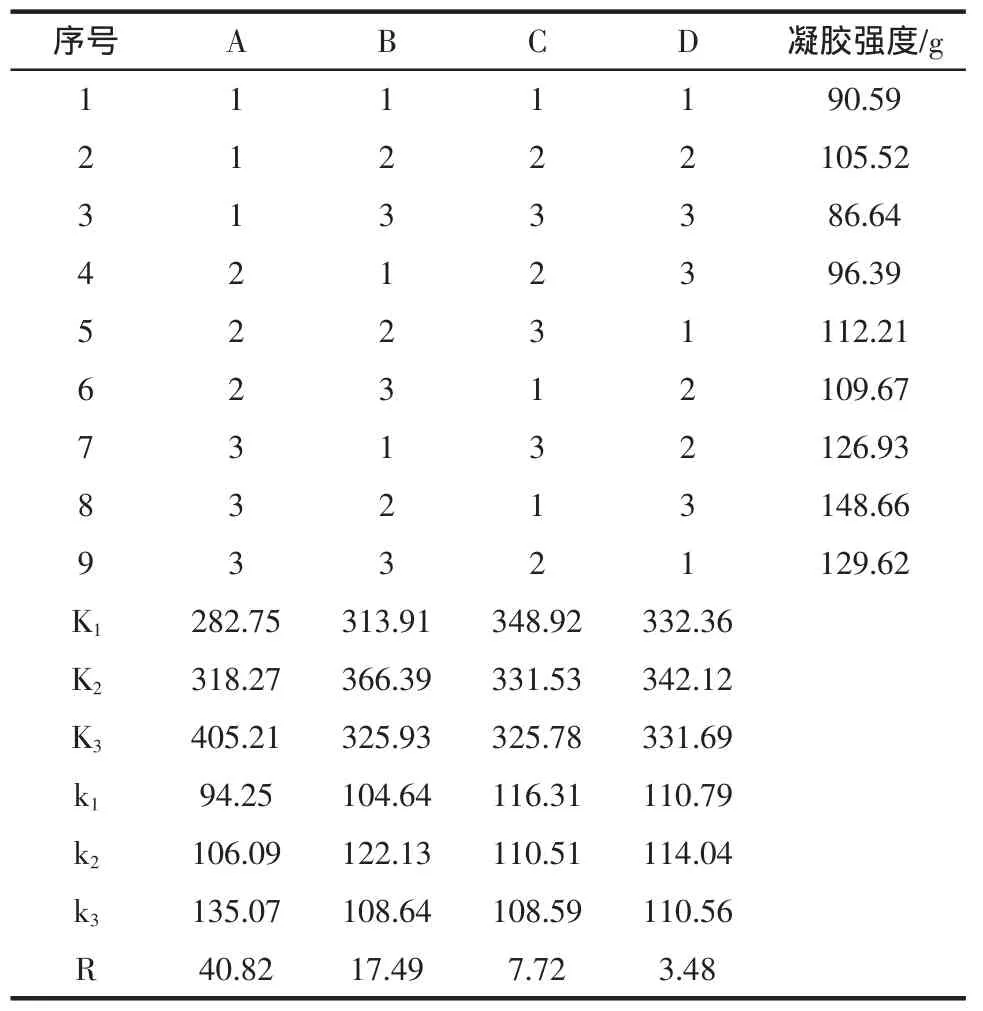
表3 正交试验结果Table 3 The Result of Orthogonal test
由表3可知,各因素对MTGase诱导大豆分离蛋白凝胶强度的影响主要依次为加热时间>加热温度>pH>酶添加量,即在加热时间上影响最大,其次是加热温度、pH,酶添加量影响最小。从试验结果来看,最优组合为A3B2C1D2。综合各因素的作用,得出适合本试验的最佳组合条件是加热时间3 h、加热温度50℃、pH 7.0、MTGase添加量30 U/g,在此条件下进行验证试验,其凝胶强度达到154.32 g。
2.3 超声波改性处理与未改性的SPI MTGase诱导凝胶特性对比结果
试验结果表明,经MTGase诱导对超声波改性后的大豆分离蛋白凝胶强度高于未经超声波改性处理的大豆分离蛋白的凝胶强度。两种方法均能影响大豆分离蛋白的凝胶强度及质构,但前者更为显著,见表4。

表4 物理改性与未物理改性MTGase诱导SPI凝胶的凝胶强度对比结果Table 4 The gel strength comparison results of physical modification and physical modification SPI induced by MTGase
4 结论
未经超声处理的SPI通过MTGase诱导,诱导时间 3 h、温度 50 ℃、pH7.0、MTGase添加量 30 U/g,此条件下获得的凝胶,其凝胶强度为154.32 g;经超声波改性处理时间为20 min、功率为200 W的SPI样品由MTGase诱导,时间 3 h、温度 50℃、pH7.0、MTGase添加量30 U/g,获得凝胶其强度为165.84 g。故SPI经超声改性再由MTGase诱导能显著提高大豆分离蛋白凝胶的凝胶强度。
[1] 石彦国,李次力,刘颖.大豆制品工艺学[M].2版.北京:中国轻工业出版社,2011
[2] 梁少华,谷克仁,王俊国,等.植物油料资源综合利用[M].2版.南京:东南大学出版社,2009
[3] 张英华,王丽.前处理对大豆分离的嫩白热凝胶流变学特性的影响[J].东北农业大学学报,2011,42(2):17-19
[4] 胡坤,赵谋明,林伟峰,等.物理作用力对大豆分离蛋白凝胶质构特性的影响[J].食品科学.2005,26(6):69-75
